片仔癀对部分肝切除小鼠的肝再生的作用研究
项龙庆,罗 渢 (中国人民解放军9608部队卫生防疫检验所,上海 0009;上海第七人民医院口腔科,上海 0037)
片仔癀对部分肝切除小鼠的肝再生的作用研究
项龙庆1,罗渢2(1中国人民解放军92608部队卫生防疫检验所,上海 200092;2上海第七人民医院口腔科,上海 200137)
【摘要】目的:研究片仔癀对70%肝切除小鼠肝再生的影响,为临床肝再生用药研究提供动物模型. 方法:将8周龄雄性C57BL/6小鼠随机分为实验组(片仔癀预处理组)和对照组(生理盐水预处理组). 采用70%肝切除方法建立肝再生模型,术前连续两周通过灌胃给予小鼠片仔癀0.2 mg/g体质量(实验组)和生理盐水(对照组). 第14天灌胃完片仔癀和生理盐水2 h后对两组小鼠分别进行70%肝切除手术(PH). 用肝质量/体质量比、实时荧光定量聚合酶链式反应(Real Time PCR)、丙氨酸转氨酶(ALT)和免疫组化等研究方法来评估片仔癀对小鼠部分肝切除手术后肝再生的影响. 结果:与对照组相比,70%肝切除手术后48、72、168 h,实验组肝质量/体质量比降低,差异具有统计学意义(P<0.05);术后12、24、48、72 h,实验组血清ALT水平升高,差异具有统计学意义(P<0.05);术后12、24、48、72、168 h,实验组肝细胞生长因子(HGF)降低;术后48 h,实验组Ki-67表达量低于对照组. 结论:片仔癀对70%肝切除小鼠的肝再生产生抑制作用,延缓了肝再生过程.
【关键词】片仔癀;小鼠;部分肝切除;肝再生
0引言
肝脏的再生能力很强,但在正常的肝脏中肝细胞处于分化成熟状态,很少见到核分裂. 当肝脏遭受手术切除、创伤、中毒、感染坏死以及肝移植术等致部分肝脏丧失后,低分化状态发生改变,肝细胞快速增殖重新修复[1]. 因此研究肝再生的机制具有重要的临床意义,促进肝再生的药物研发也备受关注. 部分肝切除是研究肝再生的经典模型[2-3]. 片仔癀是蜚声中外的名贵中成药,由麝香、牛黄、蛇胆、三七等名贵中药精制而成,它原是明代太医的秘方,被广泛用于治疗急慢性肝炎、多种创伤、炎症反应,甚至癌症[4]. 研究[5-6]发现,片仔癀对四氯化碳造成的肝细胞坏死具有缓解作用,它还可抑制结肠癌小鼠模型的肿瘤血管生成. 目前尚无片仔癀对肝切除术后肝再生的研究报道,本研究旨在探讨片仔癀对肝再生的作用,为进一步开发片仔癀提供依据.
1材料和方法
1.1实验动物及分组将雄性8周龄的C57BL/6小鼠(体质量20~25 g)(由上海斯莱克实验动物有限公司提供)随机分为实验组(片仔癀预处理组)和对照组(生理盐水预处理组),实验组每天灌胃0.2 mg/g体质量片仔癀悬液,对照组灌胃等量的生理盐水,干预持续两周. 第15天对两组小鼠进行肝切除手术,切除肝脏的70%.
1.2指标测定
1.2.1小鼠肝质量/体质量比以上两组小鼠于术后12、24、48、72、168 h分别麻醉后处死8只,进行称重,并且计算肝质量/体质量比. 将其中4只小鼠的部分肝组织立即置于4%多聚甲醛中固定;另外4只小鼠分别取肝组织冻存在液氮中.
1.2.2RNA提取及实时定量聚合酶链反应(Real Time PCR)用反转录和Real Time PCR法来分析mRNA表达水平. 总RNA用TRIzol(购自美国Invitrogen Corp)法根据制造商的步骤来提取. 将RNA用反转录酶(购自Takara公司)反转录成cDNA. Real Time PCR体系包括cDNA,SYBR Green PCR混合液(购自Takara公司)及引物(购自铂尚生物技术有限公司).
1.2.3Ki-67免疫组织化学检测冰冻切片由-20℃冰箱取出后放室温30 min,用0.01 M的柠檬酸钠缓冲液微波煮沸修复抗原15 min. 室温冷却,滴加封闭用正常羊血清工作液室温孵育30 min. 甩掉后滴加Ki-67抗体(美国Epitomics公司产品),1∶100,室温,1~2 h,PBS洗涤. 滴加荧光兔二抗Alexa Fluor 546 goat anti-rabbit IgG(美国ThermoFisher公司产品)工作液,1∶250,室温,1~2 h,PBS洗涤. 滴加DAPI染色液,37 ℃,5 min. PBS洗涤3次,5 min/次. 封片剂封片,荧光显微镜下观察.
1.2.4血清中丙氨酸转氨酶(alanine aminotransferase, ALT)活性检测血液样本4 ℃静置过夜,4℃,9000 rpm,离心10 min,分离血清. 血清中丙氨酸转氨酶(ALT)的活性用上海申索佑福医学诊断用品有限公司丙氨酸转氨酶的活性测量试剂盒测量,详细方法与产品说明书一致.
1.3统计学处理采用SPSS13.0统计学软件对数据进行分析,计量资料用x±s表示,组间比较用t检验,P<0.05表示差异具有统计学意义.
2结果
2.1片仔癀干预对肝脏质量的影响肝脏受到损伤之后就立即开始了再生过程,在70%肝切除模型中,术后24h肝脏残余部分代偿性增生至原肝质量的45%,72h达到70%,7~14d达到93%,20d左右恢复原肝质量[7]. 实验组和对照组小鼠的肝脏均有不同程度的增生,增生肝脏的形状不规则. 术后12、24h两组小鼠肝脏的质量比较,差异无统计学意义(P>0.05). 术后48h开始,与对照组相比,实验组小鼠肝脏的质量的增加较少;术后72、120、168h,小鼠肝质量(g)/体质量(g)比值显示实验组肝脏再生能力下降,差异具有统计学意义(P<0.05),小鼠肝质量(g)/体质量(g)比值显示实验组肝脏再生能力下降. 术后168h,对照组小鼠的肝脏质量基本恢复到术前水平,而实验组小鼠的肝脏质量仍显著低于正常水平,差异具有统计学意义(P<0.01,表1).
表1两组小鼠肝脏质量(肝质量/体质量)变化
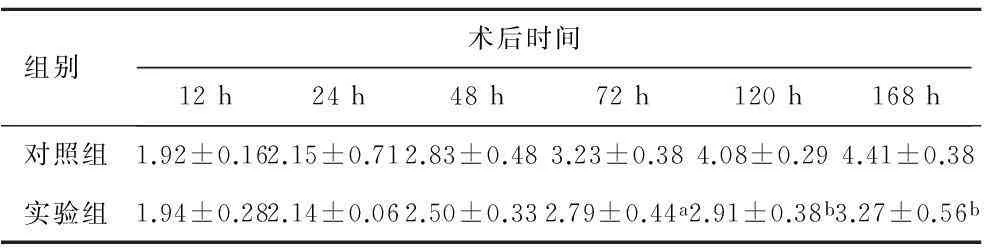
(n=48,x±s,%)
aP<0.05vs对照组;bP<0.01vs对照组.
2.2血清丙氨酸转氨酶水平变化情况丙氨酸转氨酶(ALT)大部分存在于肝细胞的胞浆中,当肝细胞受损,细胞膜通透性增加时,肝细胞中的ALT就会释放到血液中,引起血清ALT的活性上升. 因此,ALT被当做检测肝脏损伤的重要生物学标志. 部分肝切除对肝脏造成的损伤导致两组小鼠血清中的ALT活性都显著上升,术后12 h、24 h、48 h和72 h,实验组小鼠的血清ALT活性均显著高于对照组,差异具有统计学意义(P<0.05);对照组小鼠的血清ALT活性在术后72 h恢复至术前水平,而实验组小鼠在术后72 h仍维持在较高水平,差异具有统计学意义(P<0.05,表2).
表2两组小鼠血清丙氨酸转氨酶变化情况

(n=30,x±s,U/L)
aP<0.05vs对照组;bP<0.01vs对照组.
2.3Ki-67在肝脏中的表达Ki-67是细胞增殖的标志物,在细胞增殖的各期(G1,S,G2和M)中均有表达,但在细胞静止期G0期不表达[8]. 肝组织中Ki-67阳性反应产物为红色荧光颗粒,在肝细胞核中表达. 在小鼠肝脏切除术后24 h可见Ki-67少量表达,48 h肝脏表达Ki-67最为活跃,72 h未见明显表达. 与对照组相比,实验组小鼠术后24、48、72 h肝脏Ki-67表达量均低于对照组(图1).
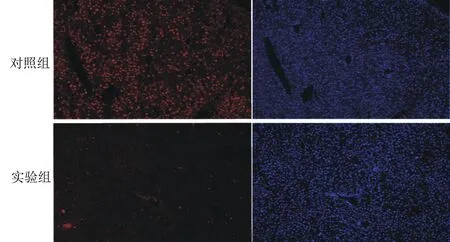
图1 部分肝切除48 h后肝组织Ki-67表达
2.4组织HGFmRNA相对表达量肝细胞生长因子(hepatocyte growth factor, HGF)是存在于急性肝损伤动物血浆中的蛋白因子,可以刺激细胞有丝分裂、细胞运动,在血管生成、肿瘤发生和组织再生的过程中发挥着重要的作用[9]. 从术后12 h开始,实验组小鼠的HGF mRNA表达量低于对照组,差异具有统计学意义(P<0.05)(图2).
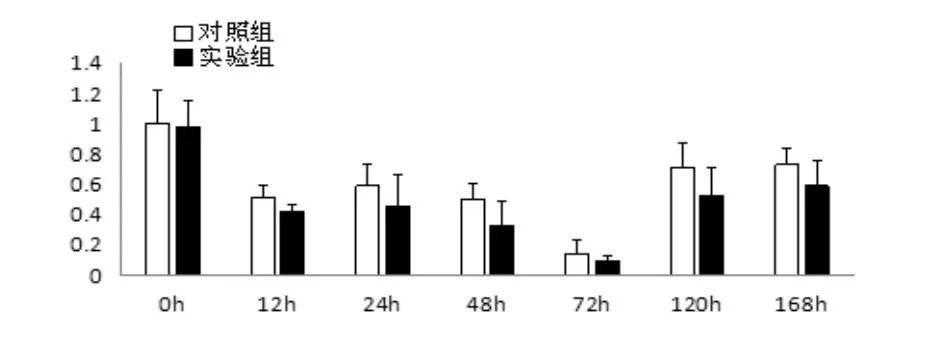
图2 组织HGF mRNA相对表达量
3讨论
肝脏具有很强的再生能力,经手术切除部分肝组织后,残余的肝组织细胞便会立即进入快速增殖状态. 肝再生不是被切除的肝叶重新长出,而是残余肝细胞的增生,肝细胞增殖的过程受控于临近细胞释放的多种信号分子,是一个多基因参与和多步骤协同的复杂过程[10].
本研究成功建立了小鼠的70%肝切除模型,以肝质量/体质量比、血清ALT水平、肝脏Ki-67表达水平、HGF mRNA水平作为标志来判断肝再生的强弱. 研究结果表明,片仔癀对于肝切除小鼠的肝再生过程会产生不利影响.
对于片仔癀的保肝作用,科学研究[5]发现,片仔癀对四氯化碳造成的肝损伤具有保护作用,进一步的肝癌细胞实验证明片仔癀可以激活重要信号通路的反应元件. 而另一项研究[11]则表明取代片仔癀的一种重要成分麝香并不影响其对四氯化碳肝损伤的保护作用. 对于片仔癀的抗癌作用,研究[12-14]发现,其可显著降低神经母细胞瘤细胞SH-SY5Y的存活率,并可抑制结肠癌细胞的增殖并促进其凋亡. 片仔癀对癌细胞生长的抑制作用在一定程度上可以解释其对肝再生过程产生的不利影响.
片仔癀作为蜚声中外的名贵中成药,其处方、工艺均属国家绝密级秘密,客观上不利于对该药的进一步研究. 此外,其复方制剂中的多种成分之间可能存在相互作用,即药效的协同作用和拮抗作用,这也从一定程度上增加了对其有效成分和机制研究的难度. 片仔癀等中成药的临床应用应在经验丰富的医生的指导和观察下使用,不宜作为日常保健品自行服用.
【参考文献】
[1] Wolf JH, Bhatti TR, Fouraschen S, et al. Heat shock protein 70 is required for optimal liver regeneration after partial hepatectomy in mice[J]. Liver Transpl, 2014, 20(3):376-385.
[2] Kountouras J, Boura P, Lygidakis NJ. Liver regeneration after hepatectomy[J]. Hepatogastroenterology, 2001, 48(38):556-562.
[3] Michalopoulos GK, DeFrances MC. Liver regeneration[J]. Science, 1997, 276(5309):60-66.
[4] 刘丛盛. 片仔癀药理及临床应用综述[J]. 慢性病学杂志,2006(S2):64-66.
[5] Lee KK, Kwong WH, Chau FT, et al. Pien Tze Huang protects the liver against carbon tetrachloride-induced damage[J]. Pharmacol Toxicol, 2002, 91(4):185-192.
[6] Shen AL, Hong F, Liu LY, et al. Effects of Pien Tze Huang on angiogenesis in vivo and in vitro[J]. Chin J Integr Med, 2012,18(6):431-436.
[7] Higgs GM, Anderson RM. Experimental pathology of the liver: restoration of the liver of the white rat following partial surgical removal[J]. Arch Pathol, 1931,12:186-202.
[8] Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown[J]. J Cell Physiol, 2000, 182(3):311-322.
[9] Gallagher, J. and M. Lyon, Molecular structure of heparan sulfate and interactions with growth factors and morphogens[J]. Proteoglycans: structure, biology and molecular interactions, 2000:27-59.
[10] Fukuda T, Fukuchi T, Yagi S, et al. Immunohistochemical analyses of cell cycle progression and gene expression of biliary epithelial cells during liver regeneration after partial hepatectomy of the mouse[J]. Exp Anim, 2015.
[11] Chan WY, Chau FT, Lee KK, et al. Substitution for natural musk in Pien Tze Huang does not affect its hepatoprotective activities[J]. Hum Exp Toxicol, 2004, 23(1):35-47.
[12] Lü L, Wai MS, Yew DT, et al. Pien Tze Huang, a composite Chinese traditional herbal extract, affects survival of neuroblastoma cells[J]. Int J Neurosci, 2009, 119(2):255-262.
[13] Shen A, Lin J, Chen Y, et al. Pien Tze Huang inhibits tumor angiogenesis in a mouse model of colorectal cancer via suppression of multiple cellular pathways[J]. Oncol Rep, 2013, 30(4):1701-1706.
[14] Shen A, Hong F, Liu L, et al. Pien Tze Huang inhibits the proliferation of human colon carcinoma cells by arresting G1/S cell cycle progression[J]. Oncol Lett, 2012, 4(4):767-770.
Effect study of Pien Tze Huang on liver regeneration after partial hepatectomy in mice
XIANGLong-Qing,LUOFeng
1Sanitary and Anti-epidemic Institute, 92608 Regiment of PLA,Shanghai 200092;2Department of Stomatology, Shanghai Seventh People’s Hospital, Shanghai 200137, China
【Abstract】AIM: To explore the influence of Pien Tze Huang on liver regeneration after 70% PH and provide an animal model for clinical investigation of drugs for liver regeneration. METHODS: The C57BL/6 mice were randomly divided into experimental group and control group. Mice in the control group were given 0.9% saline by intragastric administration, while the mice in the experimental group were given 0.2 mg/g body weight Pien Tze Huang for two weeks before 70% PH. A C57BL/6 mice model of liver regeneration were established by 70% hepatectomy. Mice were all subjected to 70% PH two hours later at day 14. The influence of Pien Tze Huang on liver regeneration were assessd by liver weight/body weight ratio, real-time PCR, ALT activity detection and immunochemical staining of Ki-67. RESULTS: At 48, 72 and 168 h after 70% PH, the liver weight/body weight ratio in the experimental group decreased when compared with the control group, with statistically significant difference(P<0.05); At 12, 24, 48, 72 h after PH, ALT levels in serum in the experimental group increased, and the difference was statistically significant(P<0.05); At 12, 24, 48, 72 and 168 h after PH, HGF level of experimental group was significantly lower than the control group, and the difference was statistically significant(P<0.05);At 48 h after PH, the Ki-67 expression of the experimental group was significantly less than the control group, and the difference was statistically significant(P<0.05). CONCLUSION: Pien Tze Huang can obviously inhibit liver regeneration on mice after 70% partial hepatectomy, which delays regeneration process of liver.
【Keywords】Pien Tze Huang;mice;partial hepatectomy;liver regeneration
【中图分类号】R657.3
【文献标识码】A
作者简介:项龙庆. 本科,主治医师. E-mail:kakka171@hotmail.com
收稿日期:2015-12-01;接受日期:2015-12-18
文章编号:2095-6894(2016)01-09-03
·基础与转化医学·

