刍议电化学试题的类型知识点拨
加兵

高中新课标人教版化学《必修2》和《选修4》中都有电化学的内容,包括原电池和电解池两大部分,这部分内容是对金属活动性、氧化还原反应、电解质的电离、离子反应以及化学反应的能量变化等知识的综合考查。本文主要从严谨审题和科学思维两个角度,深入剖析学生在电化学学习中认识误区,希望对广大学生有所启迪。
一、注意电极材料的性质
例1在25 ℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有W g Na2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为()。
A.WW+18a×100%B.WW+36a×100%
C.71W161(W+18a)×100%
D. 71W161(W+36a)×100%
例2在25 ℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有W g Na2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为()。
A.WW+18a×100%B.WW+36a×100%
C.71W161(W+18a)×100%
D. 71W161(W+36a)×100%
分析这两道题,仔细一看,只有一字之别,而电解原理却大相径庭。例1中,以铂惰性电极电解硫酸钠溶液,其实质是电解水,晶体析出的原因是由于在电解过程中H2O转化为H2、O2而减少的结果,剩余溶液仍是饱和溶液。阴极逸出a mol气体为H2,由2H2O通电2H2↑+ O2↑知,电解水的物质的量为a mol,即析出的W g Na2SO4·10H2O溶解在18ag水中恰好是25℃的饱和溶液,该溶液中溶质的质量分数与剩余溶液中溶质的质量分数相等。正确答案选C
例2中,铜是活性金属,作阳极时,优先氧化。电解过程中两极发生的反应为:Cu-2e-Cu2+(阳极),2H++2e-H2 ↑ (阴极)。电解的总反应为:Cu+2H2O通电Cu(OH)2↓+H2↑。阴极逸出了a mol H2,被电解的水为2a mol,即析出的W g Na2SO4·10H2O溶解在2a mol水中恰好是25℃的饱和溶液。正确答案选D
知识点拨电解池中,当阳极材料是活性金属时,电极优先参与反应。
二、注意电解质溶液的差异
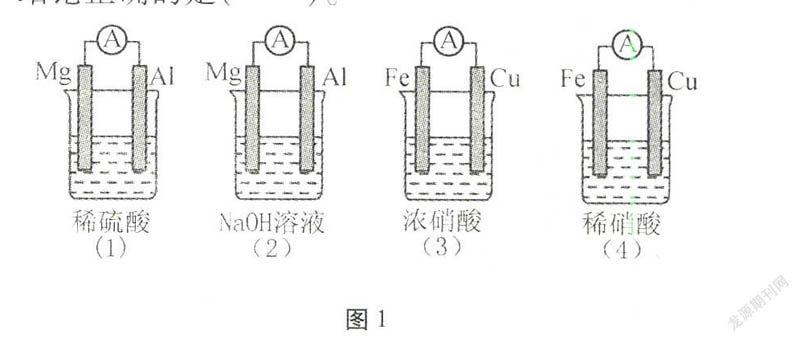
例3分析如图1所示的四个原电池装置,结论正确的是()。
分析许多学生认为,原电池中,较活泼的金属作负极。Mg比Al活泼,Mg作负极;Fe比Cu活泼,Fe作负极,给出答案A。殊不知,(2)中Mg不与NaOH溶液发生反应,而发生2Al+2NaOH+2H2O2NaAlO2+3H2↑,Al失去电子,则Al为负极,负极反应为Al-3e-+4OH-AlO-2+2H2O;(3)中Fe在常温下遇浓硝酸发生钝化,原电池发生Cu与浓硝酸的氧化还原反应,Cu作负极,Cu-2e-Cu2+;(4)中电解质溶液为稀硝酸,Cu作正极,电极反应式为NO-3+3e-+4H+NO↑+2H2O。正确答案是B
知识点拨原电池的正负极不仅与电极材料有关,也与电解质溶液的性质有关。
三、注意电解质溶液中离子反应
例4(2013年全国高考)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是()。
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
分析发生的电极反应为:负极:2Al-6e-2Al3+;正极:3Ag2S+6e-6Ag+3S2-,两极产生的Al3+和S2-会发生双水解反应,即2Al3++3S2-+6H2O2Al(OH)3↓+3H2S↑。原电池总反应方程式可写成:3Ag2S+2Al+6H2O6Ag+2Al(OH)3↓+3H2S↑,C错误;处理过程中,硫化银变为银单质,质量减少,A错误;硫化银发生还原反应,生成银单质,B正确;黑色褪去的原因是硫化银变为银单质,D错误。正确答案选B
例4在水中加入等物质的量的Ag+、Pb2+、Na+、SO2-4、NO-3、Cl-,该溶液放在用惰性材料作电极的电解槽中,通电片刻(假定溶液足量),则氧化产物与还原产物的质量比为()。
A.35.5∶108 B.71∶108 C.8∶1 D.16∶207
分析该题容易出现的问题是,有的学生忽略离子共存问题从而得出选项A的错误结论。根据离子反应发生的条件可知,溶液中会生成氯化银、硫酸铅白色沉淀,即实际是硝酸钾溶液,所以电解的实质是电解水。由此得出氧化产物为O2,还原产物为H2,物质的量之比为1∶2,故质量比为(1×32)∶(2×2)=8∶1。正确答案选C
知识点拨电化学习题中,要将离子共存和盐的水解的知识结合起来。
四、注意离子放电的顺序
例6电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是()。
A.0.10 mol/L Ag+ B.0.02 mol/L Zn2+
C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+
分析题中涉及五种阳离子,电解时,其放电的先后顺序是:Ag+、Cu2+、H+、Pb2+、Zn2+,结合电子守恒,当电路中通过0.04 mol电子时,理论上析出的金属质量依次是()。
Ag:0.10 mol/L×0.1 L×108 g/mol=1.08 g;
Cu:0.02 mol/L×0.1 L×64 g/mol=1.28 g;
Pb:(0.04 mol-0.03 mol)÷2×207 g/mol=1.05;
Zn:(0.04 mol-0.03 mol)÷2×65 g/mol=0.325 g。
正确答案选C。
例5将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用惰性电极电解一段时间后,若在一极析出0.3 mol Cu,此时在另一极上产生的气体在标准状况下的体积为()。
A.4.48 L B.5.6 L C.6.72 L D.7.84 L
分析由Ag++Cl-AgCl↓可知,0.2 mol Ag+和0.2 mol Cl-沉淀,溶液中剩余0.4 mol Cl-;题中,在阴极上有0.3 mol Cu2+放电,由Cu2++2e-Cu知,转移的电子为0.6 mol;在阳极上先有0.4 mol Cl-放电,由2Cl--2e-Cl2↑知,生成氯气0.2 mol,结合电子得失守恒,还有0.2 mol的OH-放电:4OH--4e-2H2O+O2↑,生成0.05 mol氧气,共生成0.25 mol气体,在标准状况下的体积为5.6 L。正确答案为B
知识点拨离子放电顺序应结合离子的氧化性或还原性来识记,还应兼顾电子守恒。
五、注意电解液复原中的“水”
例8(2014北京东城)用惰性电极电解一定质量某浓度的NaCl溶液,一段时间后停止电解,此时加入100 g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同。下列说法正确的是()。
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8 mol
D.原某浓度的NaCl溶液中溶有117 g NaCl
分析电解NaCl溶液的总反应为:2NaCl+2H2O通电H2↑+Cl2↑+2NaOH,如果只是电解NaCl,那么应该补充HCl气体即可复原,而题中加入的是100 g 36.5%的浓盐酸,其中含HCl为100×36.5%36.5 g/mol=1 mol,含水为100×63.5% g18 g/mol=3.5 mol,由此可知还应有电解的第二个阶段,水的电解,即2H2O通电2H2+O2,综上分析知阴极只有H2产生,而阳极产生的是Cl2和O2,且阴极所得的气体体积比阳极多,A、B选项错误;1 mol Cl-转移1 mol电子,1 mol H2O转移2 mol电子,转移电子的总数是1×1+3.5×2=8 mol,C选项正确;原NaCl溶液中溶有1 mol的Cl-离子,NaCl溶液中溶有58.5 g NaCl,D选项错误。正确答案为C
例6用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液中加入0.1 mol碱式碳酸铜晶体[Cu2(OH)2CO3],恰好使溶液恢复到电解前的浓度和pH。(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为()。
A.0.4molB.0.5molC.0.6molD.0.8mol
分析电解后的硫酸铜溶液呈酸性,加入碱式碳酸铜能恢复到原溶液,发生反应为:Cu2(OH)2CO3+2H2SO42CuSO4+CO2↑+3H2O溶液质量增加的是Cu2+和OH-,所以实际上电解硫酸铜溶液分两个阶段进行:第一阶段 2CuSO4+2H2O通电2Cu+O2↑+2H2SO4, 第二阶段 2H2O通电2H2↑+O2↑。将碱式碳酸铜化学式变形为2CuO·H2O·CO2,所以加入0.1 mol Cu2(OH)2CO3相当于加入0.2 mol CuO和0.1 mol H2O,根据CuO和H2O的物质的量计算即可得出正确答案为C。
知识点拨电解后的溶液复原问题,审题时要注意“水”的电解。
六、注意电荷的迁移方向
例7人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。图2是通过人工光合作用制备HCOOH原理示意图,下列说法错误的是()。
图2A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e-HCOOH
分析原电池工作时,外电路电子从负极流出,流向正极;内电路阳离子向正极迁移,阴离子向负极迁移。b电极为正极,a电极为负极。根据题中信息和反应特点,该电池中发生的总反应为:2CO2+2H2O2HCOOH+O2↑;故其将太阳能转化为化学能,A对;催化剂a表面发生氧化反应:2H2O-4e-4H++O2↑,B对;催化剂a表面产生H+,酸性增强,C错;催化剂b表面发生:CO2 +2H++2e-HCOOH,D对。正确答案为C
知识点拨原电池和电解池工作时,注意外电路电子的流动方向和内电路阴阳离子的迁移方向,同时还要注意“电子不下水,离子不上岸”。(收稿日期:2015-11-15)

