恒定pH值对粘质沙雷氏菌产灵菌红素的影响
荣广健,张佑红,谌 颉,黄 萌,周 锋,胡 凯
(武汉工程大学化工与制药学院 绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
恒定pH值对粘质沙雷氏菌产灵菌红素的影响
荣广健,张佑红,谌颉,黄萌,周锋,胡凯
(武汉工程大学化工与制药学院 绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
摘要:探讨了恒定pH值对粘质沙雷氏菌ZSG7发酵产灵菌红素的影响。结果表明,当发酵系统pH值恒定为7时,粘质沙雷氏菌生长速度最快,灵菌红素产生速度最快且产量最高(0.3033 g·L-1),比不调pH值的灵菌红素最高产量0.2296 g·L-1高出32.1%。
关键词:灵菌红素;粘质沙雷氏菌;恒定pH值
灵菌红素(prodigiosin,PG)是天然红色素的统称,通常含由3个吡咯环组成的甲氧基吡咯骨架结构[1]。它是由某些放线菌(如链霉菌属)[2]、某些细菌(如粘质沙雷氏菌属[3]、假单胞菌属[4])等微生物产生的一种次级代谢产物。灵菌红素具有多种重要特性,如抗菌、抗疟疾、抗癌、免疫抑制、除藻等[5-10],特别是对肺癌、前列腺癌、胰腺癌等多种人癌细胞有一定的抑制作用,而且在相同的剂量下对正常细胞没有明显的毒害作用,因此灵菌红素极有潜力被开发成为一种新型的抗癌药物[11-13]。pH值是一个重要的环境因素,对发酵过程中细菌生长和产物生成有重要影响[14]。目前,采用恒定pH值研究粘质沙雷氏菌发酵产灵菌红素的研究还未见报道,因此,作者采用自动发酵系统,研究恒定pH值对粘质沙雷氏菌产灵菌红素的影响。
1实验
1.1菌种
粘质沙雷氏菌ZSG,由本实验室从糖化车间酸性土壤中筛选获得并保藏于中国典型培养物保藏中心(CCTCCNo:M209195),菌株编号ZSG;粘质沙雷氏菌ZSG7,由粘质沙雷氏菌ZSG诱变所得。
1.2仪器
BIOSTAT®Aplus型生物反应器、BS124S型分析天平,Sartorius公司;AIRTECH型超净工作台,苏净集团安泰公司;SPX-250B-D型振荡培养箱、DZF-6050型真空干燥箱、YXQ-LS-75S型立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;TG18M型高速离心机,长沙平凡仪器仪表有限公司;UV-1800型紫外可见分光光度计,苏州岛津仪器有限公司;MFS-Ⅱ型多功能三维旋混仪,深圳潘西诺生物科技有限公司;200μL、1 000μL和5 000μL移液枪吸嘴、50mL离心管,Corning公司;移液枪,Nichiryo公司;封口膜,Parafilm公司;5mL流式管,武汉谷歌生物科技有限公司。
1.3培养基
固体培养基:牛肉膏0.5%,蛋白胨1%,琼脂粉2%,NaCl0.5%。
种子培养基:蔗糖0.5%,蛋白胨1.5%,NaCl0.5%,MgCl20.25%,吐温80 1.0%。
发酵培养基:蔗糖0.5%,蛋白胨1.5%,NaCl0.5%,MgCl20.25%,吐温80 1.0%,用0.1mol·L-1盐酸溶液和1mol·L-1氢氧化钠溶液调节发酵液pH值。
1.4方法
发酵方法:保藏菌种活化后接种于装有50 mL种子培养基的250 mL锥形瓶中,于29 ℃、160 r·min-1培养24 h后,按10%的接种量接入发酵罐中培养。
培养条件:5 L发酵罐中装液量为3 L,培养温度29 ℃,发酵周期66 h,前12 h通气量1.0 vvm且搅拌转速控制在200 r·min-1;第12~24 h,将溶氧保持在30%;第24~66 h,将溶氧保持在60%。溶氧值用溶氧探头实时监控,并进行溶氧偶联转速自动调节。
实验设置4个变量:不调控pH值、恒定pH值为5、恒定pH值为6、恒定pH值为7。通过发酵系统主机的蠕动泵用0.1 mol·L-1盐酸溶液和1 mol·L-1氢氧化钠溶液调节发酵液pH值。
1.5菌体干重的测定
菌体干重标准曲线的绘制:取20 mL发酵液置于已知质量的50 mL离心管中,10 000 r·min-1离心20 min,蒸馏水洗涤后再离心,重复2次,余下的湿菌体置于80 ℃烘箱中烘干至恒量,称量菌体干重(DCW,g·L-1)。再取1 mL发酵液,同样用蒸馏水洗涤菌体2次,然后用生理盐水将剩余湿菌体溶解稀释至10 mL,测定600 nm处吸光度(OD600)。以DCW为横坐标、OD600为纵坐标绘制菌体干重标准曲线。
通过测定发酵液在600 nm处吸光度即可依标准曲线拟合线性方程计算1 L发酵液中菌体干重。
1.6灵菌红素含量的测定
灵菌红素标准曲线的绘制:准确称取提纯的灵菌红素粉末100 mg,用酸性甲醇溶液(pH=3.0)溶解并定容至1 000 mL,作为0.1 mg·mL-1的色素母液。分别准确吸取色素母液0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,用酸性甲醇溶液定容至10 mL,测定534 nm处吸光度(OD534)。以灵菌红素浓度为横坐标、OD534为纵坐标绘制灵菌红素标准曲线。
取发酵液1 mL,加入9 mL酸性甲醇溶液,剧烈振荡5 min,破碎菌体,10 000 r·min-1离心10 min后取上清液,测定534 nm处吸光度,依标准曲线拟合线性方程计算发酵液中灵菌红素含量。
2结果与讨论
2.1菌体干重标准曲线(图1)
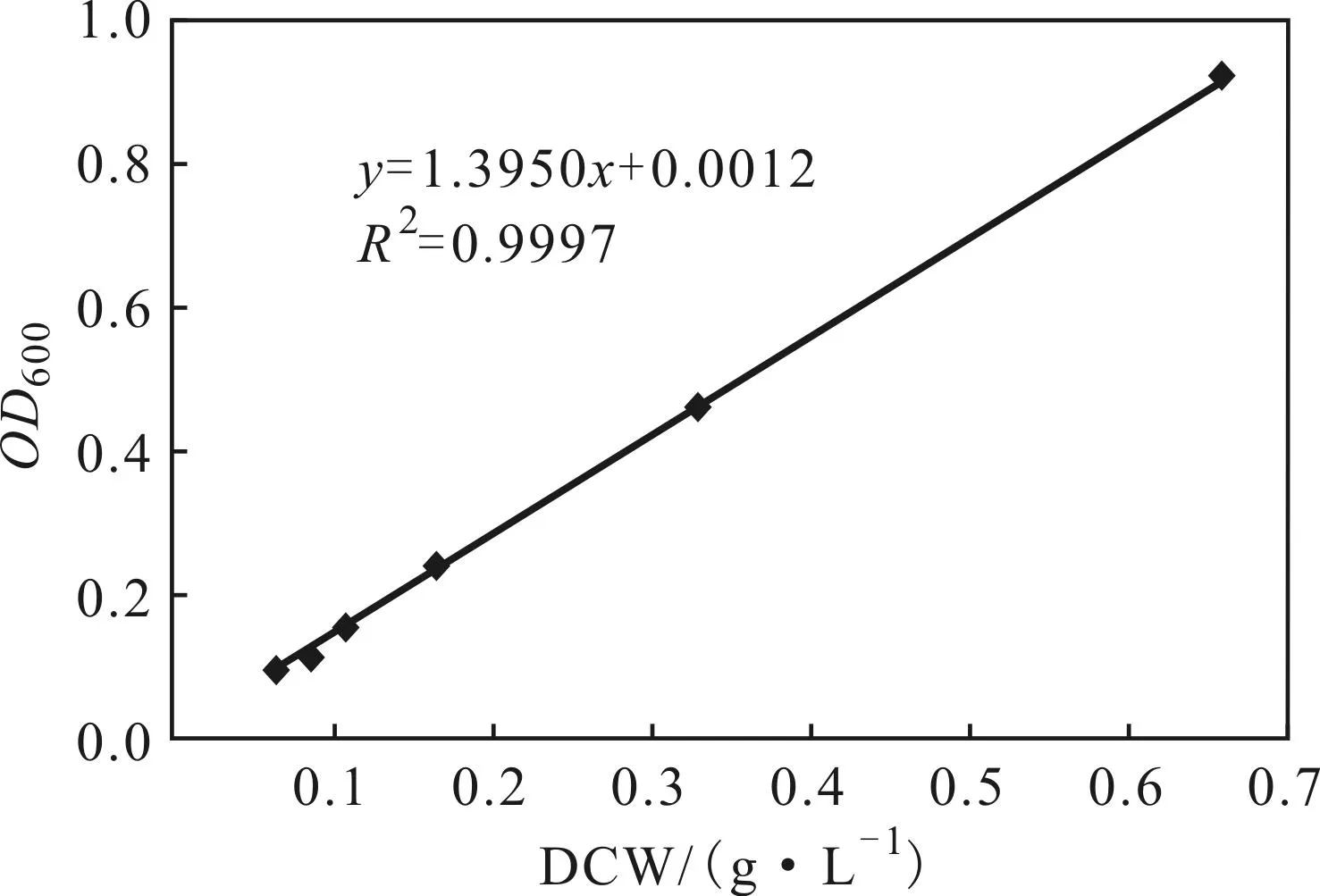
图1 菌体干重标准曲线
由图1可看出,菌体干重与吸光度OD600线性关系良好,回归得线性方程:y=1.3950x+0.0012,R2=0.9997。
2.2灵菌红素标准曲线(图2)
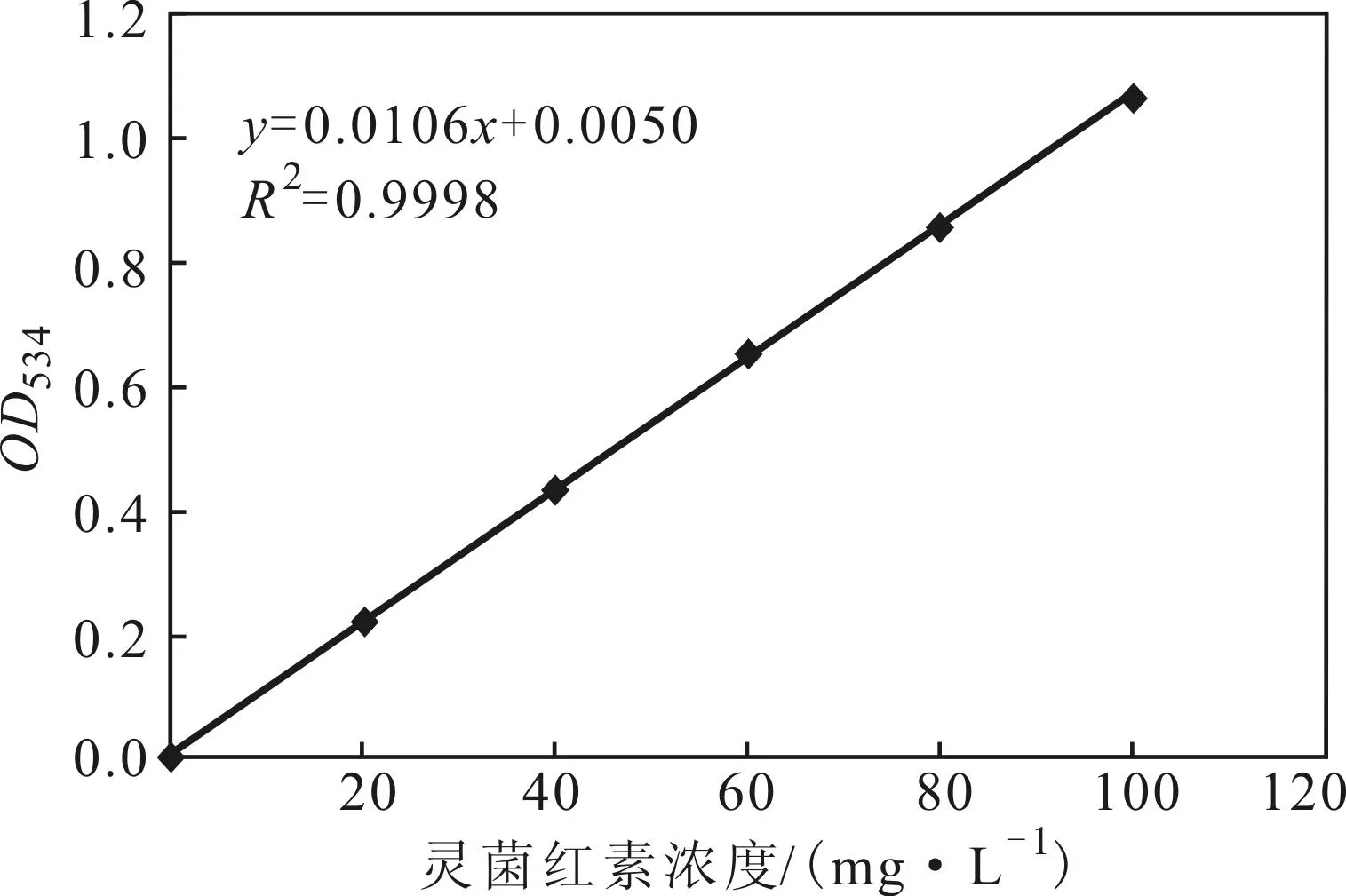
图2 灵菌红素标准曲线
由图2可看出,灵菌红素浓度与吸光度OD534线性关系良好,回归得线性方程:y=0.0106x+0.0050,R2=0.9998。
2.3不同恒定pH值下菌体干重的变化
不调pH值时,随着细菌的大量繁殖,发酵液pH值发生变化,如图3所示。
由图3可知,不调pH值时,发酵起始时pH值为5.4;之后经过很短的时间,pH值达到最低点5.2;随后发酵液pH值不断上升,发酵10 h时,pH值接近6.0,发酵22 h时,pH值达到7.0;随后发酵液pH值缓慢上升,在发酵50 h时pH值达到最高点7.8,随后一直稳定在7.8左右,直到发酵结束。
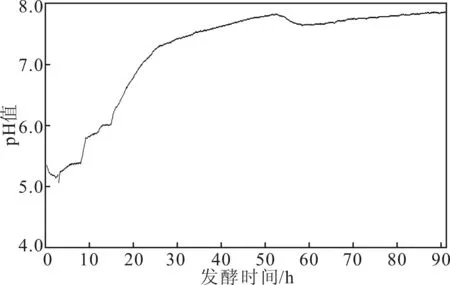
图3 不调pH值时发酵液pH值变化曲线
调节pH值为恒定值,不同恒定pH值下菌体干重的变化如图4所示。
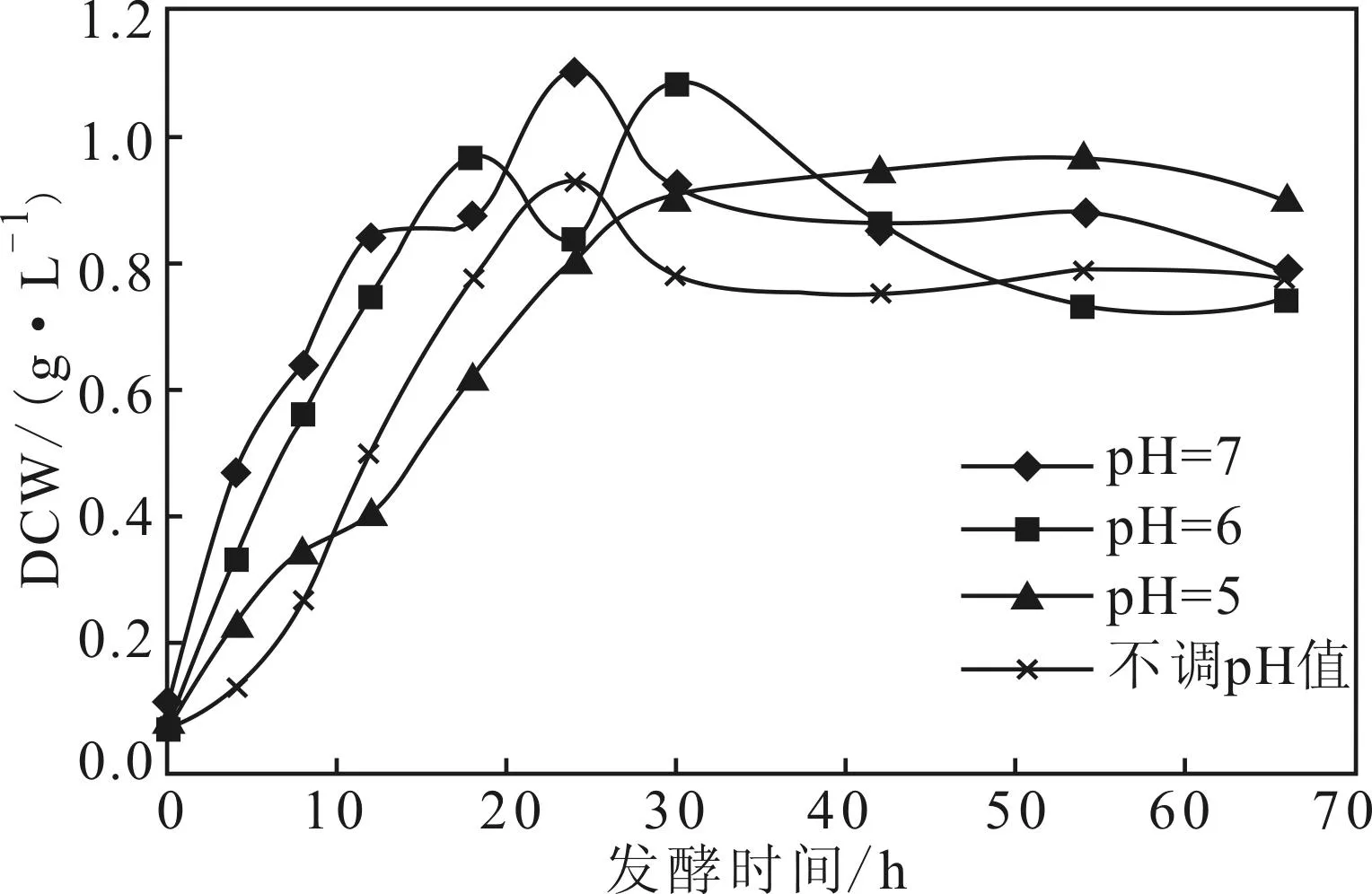
图4 不同恒定pH值下的菌体干重变化曲线
由图4可知,当菌体大量繁殖时,恒定pH值为7时的菌体生长速度最快,其次是恒定pH值为6,最后是恒定pH值为5;恒定pH值为5的粘质沙雷氏菌生长速度在前10 h比不调pH值的要快,但10 h后不调pH值时的生长速度明显比恒定pH值为5的要快,这是因为,发酵10 h后不调pH值的发酵液pH值接近6,并且随着发酵的进行pH值从6升高到7,粘质沙雷氏菌的生长速度相应加快;恒定pH值为5时的最大菌体干重0.9684 g·L-1与不调pH值时的0.9288 g·L-1比较接近,但明显低于恒定pH值为6时的1.0826 g·L-1与恒定pH值为7时的1.0998 g·L-1;恒定pH值为6与恒定pH值为7时的粘质沙雷氏菌的生长曲线接近,菌体干重最大值也比较接近,但恒定pH值为7时的菌体干重多高于恒定pH值为6时的菌体干重,且与恒定pH值为5的相差较大,表明粘质沙雷氏菌大量繁殖的最适恒定pH值为7。
2.4不同恒定pH值下灵菌红素产量的变化曲线(图5)
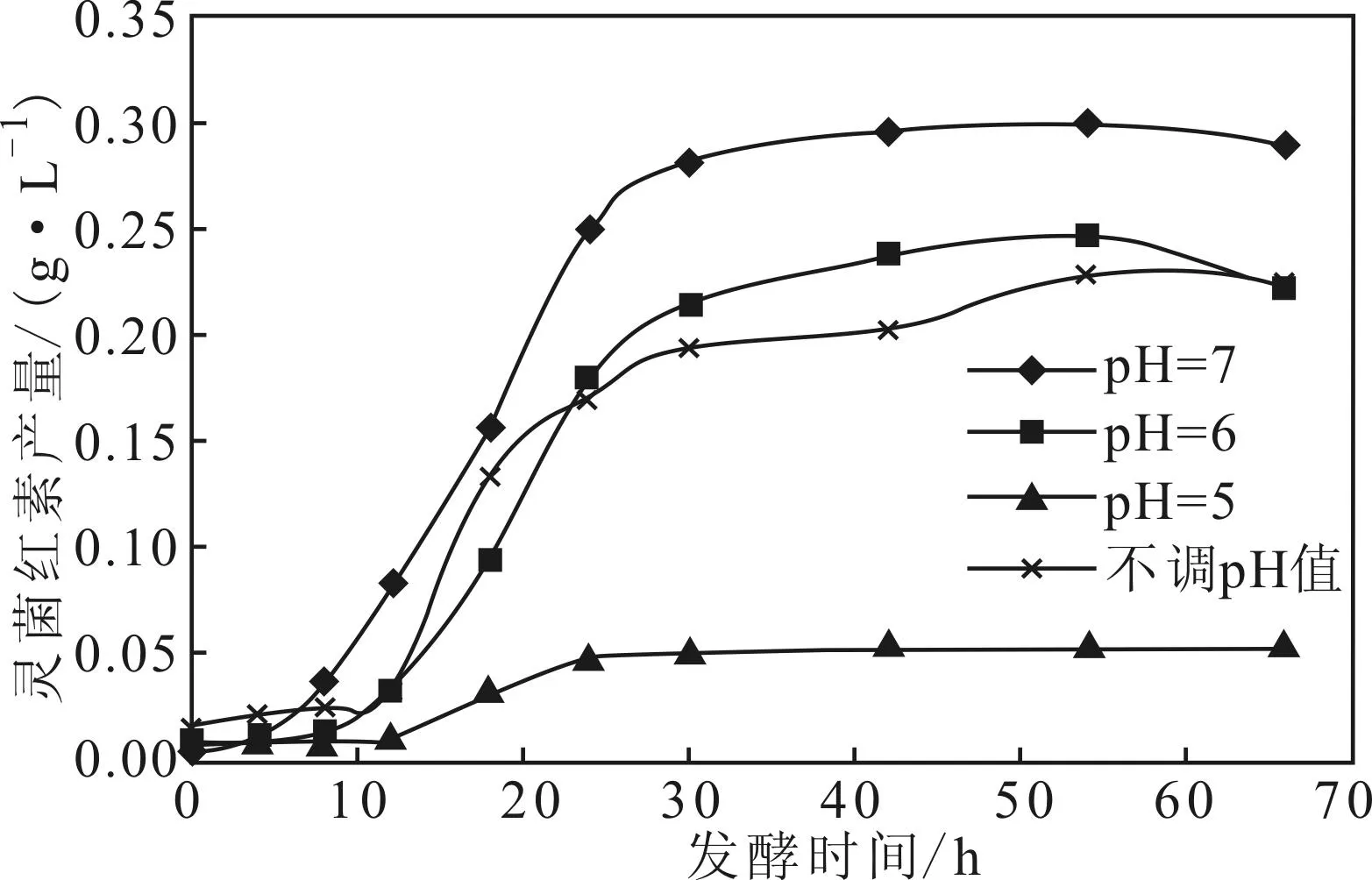
图5 不同恒定pH值下灵菌红素产量的变化曲线
由图5可知,第10~30 h,粘质沙雷氏菌快速生长,灵菌红素产量迅速升高,生长速度快慢依次为pH7>pH6>pH5,灵菌红素产量高低依次为pH7 >pH6>pH5,表明在恒定pH值为5时,粘质沙雷氏菌产灵菌红素受到影响,产量大大降低;恒定pH值为6时的灵菌红素最高产量为0.2461 g·L-1,仅比不调pH值时的0.2296 g·L-1高出7.2%,二者相差不大;而不调pH值时的灵菌红素产量在第12~24 h要高于恒定pH值为6,这是因为,不调pH值时的发酵液pH值在第12~24 h间从6上升到7,导致粘质沙雷氏菌的活性更高,产灵菌红素的速度加快;当恒定pH值为7时,灵菌红素产生速度最快,产量最高,达到0.3033 g·L-1,比不调pH值时高出32.1%。因此,粘质沙雷氏菌产灵菌红素的最适恒定pH值为7。
3结论
研究了恒定pH值对粘质沙雷氏菌ZSG7产灵菌红素的影响。当菌体大量繁殖时,恒定pH值下的菌体生长速度快慢依次为pH7>pH6>pH5。比较粘质沙雷氏菌最大菌体干重,发现恒定pH值为6与恒定pH值为7的比较接近,而且明显高于恒定pH值为5和不调pH值。比较灵菌红素产量,发现恒定pH值为5时的灵菌红素产量很低,恒定pH值为6时的灵菌红素产量大幅提高,与不调pH值时的产量接近,恒定pH值为7时的灵菌红素产量最高,达到0.3033 g·L-1,比不调pH值时的最高产量0.2296 g·L-1高出32.1%。
参考文献:
[1]MONTANER B,PEREZ-TOMAS R.The prodigiosins:A new family of anticancer drugs[J].Current Cancer Drug Targets,2003,3(1):57-65.
[2]EL-BONDKLY A M,EL-GENDY M M,BASSYOUNI R H.Overproduction and biological activity of prodigiosin-like pigments from recombinant fusant of endophytic marineStreptomycesspecies[J].Antonie van Leeuwenhoek,2012,102(4):719-734.
[3]GUTIERREZ-ROMAN M I,HOLGUIN-MELENDEZ F,BELLO-MENDOZA R,et al.Production of prodigiosin and chitinases by tropicalSerratiamarcescensstrains with potential to control plant pathogens [J].World Journal of Microbiology and Biotechnology,2012,28(1):145-153.
[4]SAKATA T,YOSHIKAWA T,NISHITARUMIZU S.Algicidal activity and identification of an algicidal substance produced by marinePseudomonassp.C55a-2[J].Fisheries Science,2011,77(3):397-402.
[5]LIU T J,YANG H L,TANG H.Progress on prodigiosin[J].Food and Drug,2007,8:15.
[6]SURYAWANSHI R K,PATIL C D,BORASE H P,et al.Studies on production and biological potential of prodigiosin bySerratiamarcescens[J].Applied Biochemistry and Biotechnology,2014,173(5):1209-1221.
[7]MANSSON M,GRAM L,LARSEN T O.Production of bioactive secondary metabolites by marineVibrionaceae[J].Marine Drugs,2011,9(9):1440-1468.
[8]PAPIREDDY K,SMILKSTEIN M,KELLY J X,et al.Antimalarial activity of natural and synthetic prodiginines[J].Journal of Medicinal Chemistry,2011,54(15):5296-5306.
[9]HE J,HE X,ZHANG H Y,et al.Effect of the Chinese herbMesimareishiUE-1 on invasion of human ovarian cancer cellsinvitro[J].African Journal of Biotechnology,2011,10(48):9888-9897.
[10]JEONG H,YIM J H,LEE C,et al.Genomic blueprint ofHahellachejuensis,a marine microbe producing an algicidal agent[J].Nucleic Acids Research,2005,33(22):7066-7073.
[11]KAVITHA R,AISWARIYA S,RATNAVALI C M.Anticancer activity of red pigment fromSerratiamarcescensin human cervix carcinoma[J].International Journal of Pharmaceutical Research,2010,2(1):784-787.
[12]PANDEY R,CHANDER R,SAINIS K B.Prodigiosins as anti-cancer agents:Living upto their name[J].Current Pharmaceutical Design,2009,15(7):732-741.
[13]SOTO-CERRATO V,VINALS F,LAMBERT J R,et al.Prodigiosin induces the proapoptotic gene NAG-1viaglycogen synthase kinase-3βactivity in human breast cancer cells[J].Molecular Cancer Therapeutics,2007,6(1):362-369.
[14]HORIUCHI J I,SHIMIZU T,TADA K,et al.Selective production of organic acids in anaerobic acid reactor by pH control[J].Bioresource Technology,2002,82(3):209-213.
Effect of Constant pH Value on Prodigiosin Producing bySerratiaMarcescens
RONG Guang-jian,ZHANG You-hong,CHEN Jie,HUANG Meng,ZHOU Feng,HU Kai
(KeyLaboratoryforGreenChemicalProcessofMinistryofEducation,SchoolofChemicalEngineeringandPharmacy,WuhanInstituteofTechnology,Wuhan430074,China)
Abstract:The effect of constant pH value on prodigiosin producing by Serratia marcescens ZSG7 was discussed.The results showed that,when the pH value was kept 7,ZSG7 grew the fastest,generation speed of prodigiosin was the fastest,and the maximum production reached 0.3033 g·L-1,which was 32.1% higher than the maximum 0.2296 g·L-1under the unregulated pH value.
Keywords:prodigiosin;Serratia marcescens;constant pH value
中图分类号:TQ 920
文献标识码:A
文章编号:1672-5425(2016)02-0046-04
doi:10.3969/j.issn.1672-5425.2016.02.010
作者简介:荣广健(1989-),男,河北廊坊人,硕士研究生,研究方向:发酵工程、生物制药,E-mail:351966145@qq.com;通讯作者:张佑红,教授,博士生导师。
收稿日期:2015-11-20

