关于实验动物国家标准病毒检测项目思考
佟 巍
( 中国医学科学院 北京协和医学院 医学实验动物研究所,北京 100021)
关于实验动物国家标准病毒检测项目思考
佟巍
( 中国医学科学院 北京协和医学院 医学实验动物研究所,北京100021)
【摘要】通过多年的检测实践,笔者建议:① 我国国家标准参照国外实验动物质量标准设置我国特有的“核心检测项目”及“备选检测项目”质量标准。即:将现行国家标准检测内容设置为“核心检测项目”,“核心检测项目”中保留原有的“必检项目”(即“●”)及“必要时检测项目”(即“○”);将国家标准中未涉及的病毒检测内容设置为“备选检测项”。②目前“核心检测项目”中大鼠HV及小鼠Ect由“必检项目”调整为“必要时检测项目”;大鼠增加对LCMV的检测要求,设置为“必要时检测项目”;取消“核心检测项目”中对TMEV病毒的检测要求,将该病毒调整为“备选检测项目”清单中。
【关键词】实验动物;病毒学检测
在生命科学研究迅猛发展的今天,实验动物作为最精密的实验“仪器”,其标准化要求显得更为重要,并被世界范围的科研工作者们所重视。
1国内外实验动物质量检测概况
生命科学研究深入发展同时对实验动物质量提出更高要求。一些发达国家及地区实验动物机构建议实验动物生产和使用单位在制定健康监测方案时不仅要考虑实验动物等级标准,而且还应根据自身实际情况,制定个性化的健康监测方案。
欧洲实验动物科学协会联合会(FELASA)每隔几年更新一版最新的啮齿类、家兔繁殖和实验单元的健康监测指导意见[1]。指导意见在全球范围内得到广泛的使用,成为实验动物生产和使用单位健康监测的行动指南。该指导意见2014版涵盖的病毒检测项目小鼠19个、大鼠12个,具体见表1、表2[1]。FELASA强调其指导意见是健康监测的最低要求。
美国Charles River是全球最有实力的实验动物产品和技术服务提供商,其健康监测理念具有很高的参考价值。目前该实验室健康监测方案涉及病毒检测项目小鼠18项,大鼠13项,具体见表1、表2。强调指出要根据实际情况制定适合的健康监测方案[2]。
日本实验动物中央研究所(ICLAS)亦对实验动物健康检测方案进行了调整,将实验小鼠病毒检测项目20种及大鼠病毒检测项目12种,分为核心检测项目(小鼠5种,包括:SV、Ect、LCMV、MHV、HV;大鼠3种,包括:SV、HV、SDAV。)和备选的检测项目(小鼠13种,包括:Mad(FL)、Mad(K87)、GD7/TMEV、MVM、PVM、Reo-3、EDIM、KV、mouse cytomegalovirus、MPV、MTLV、MNV、POLY;大鼠9种,包括:Mad(FL)、Mad(K87)、GD7、MVM、PVM、Reo-3、H-1、KRV、RPV)。他们还将感染性病原分为A、B、C、D、E五类,涉及病毒的有三类:A人兽共患病,2种(LCMV、HV);B实验动物烈性传染病,3种(Ect、MHV、SV);C隐性感染性疾病,15种(EDIM/Rota、LDHV、MAd、MCMV、GD7/TMEV、MNV、POLY、PVM、Reo-3、MVM、KRV、H-1、MPV、RPV、SDAV)。检测内容基本涵盖了Charles River Laboratories的病毒检测内容。还有其他国家及地区检测清单中没有的检测项目(鼠星状病毒murine astrovirus)。(http://www.iclasmonic.jp/microbiology/inspection/mouse.html)
我国实验动物国家标准(GB14922.2-2011)规定实验小鼠病毒检测项目11种,其中必检项目6种(Ect、MHV、SV、PVM、Reo-3、MVM),必要时检测项目5种(LCMV、HV、GD7/TMEV、MAd、POLY);大鼠病毒检测项目8种(HV、SV、PVM、Reo-3、H-1/KRV、RCV/SDAV),全部为必检项目[3]。

表1 国内外实验小鼠病毒检测项目
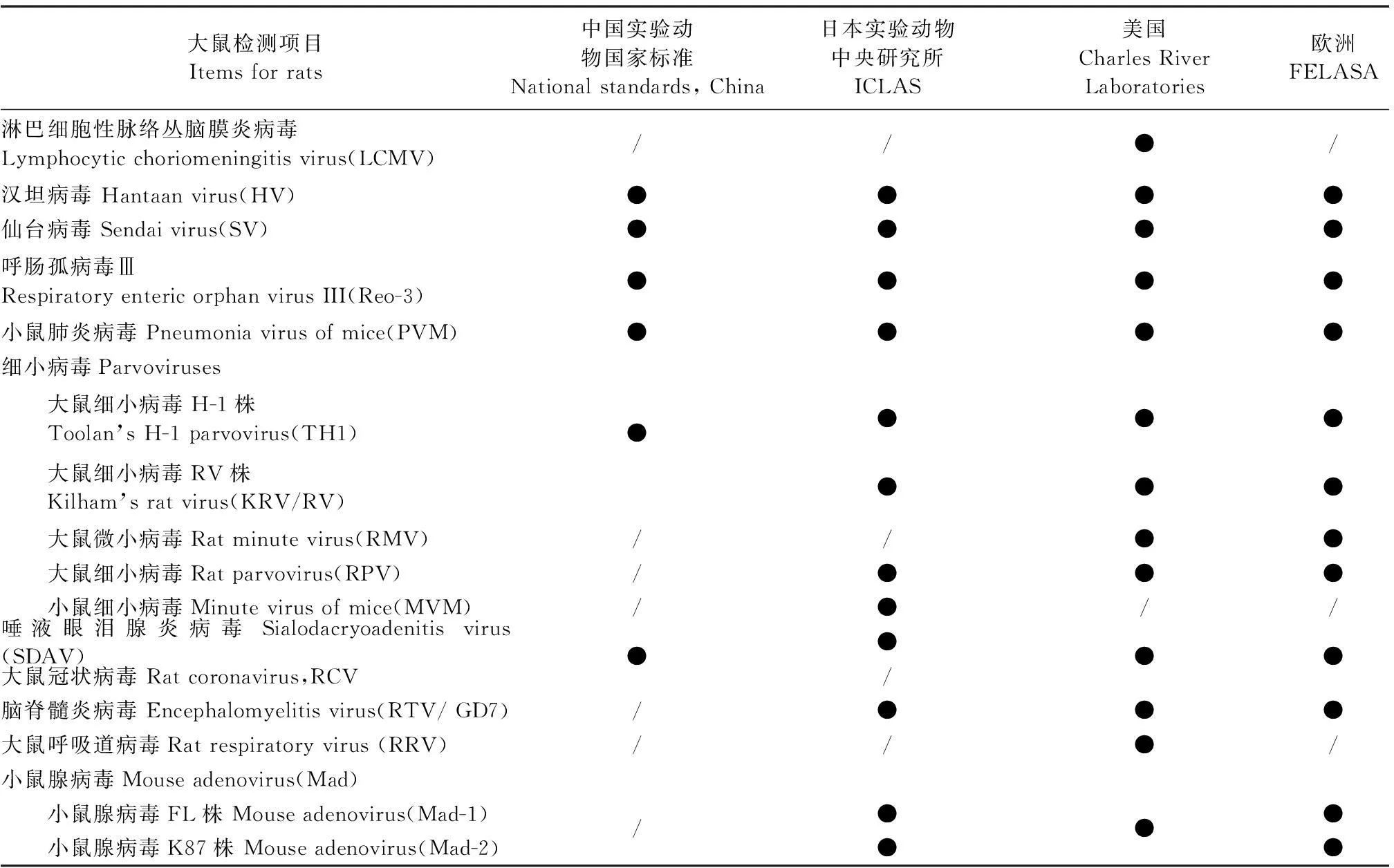
表2 国内外实验大鼠病毒检测项目
2病毒病原对动物健康及实验研究的影响
早在1991年美国《Biology and Life Sciences - Lab Animal Research》就不同感染性疾病对实验研究带来的影响进行了阐述。1998年美国《Clinical Microbiology Reviews》亦对同样问题进行了论述。他们均就不同病原对动物机体功能系统带来的危害进行了详尽说明[4-6]。见表3。
2.1呼吸系统疾病是小鼠、大鼠最常见健康问题
实验小鼠、大鼠呼吸道病毒病原为SV、PVM、RCV、KV。常为隐性感染导致亚临床症状,实验条件下也可导致疾病的发生。通常与其它病原微生物合并感染后导致严重呼吸道疾病。SV感染易感小鼠或免疫缺陷鼠可导致疾病甚至死亡,是重要的实验鼠群的病毒性传染病之一,干扰生理、病理、免疫学及肿瘤学方面的研究;PVM是重要的呼吸道病毒,自然条件下可感染实验鼠,对免疫缺陷鼠具有致病性,主要干扰生理、病理及肿瘤学方面的研究;RCV是感染率最高以及严重干扰实验,胸腺缺如大鼠更为易感;KV实验小鼠中较为少见,实验感染裸鼠可致病。
2.2消化系统疾病在小鼠和大鼠中极为常见
乳鼠或幼鼠感染病原体会对消化系统带来最严重的影响,产生明显的临床症状。当它们离乳或刚刚成年后临床症状可能已不存在,也可能出现更加明显消化道疾病临床症状(例如腹泻和生长阻滞)而未被发现。这些病毒病原包括:MCMV、RCMV、MPV、MTV、SDAV、MHV、MRV/ EDIM、RRV、Reo-3、Adenoviruses等。SDAV、MHV成年鼠常为隐性感染,新生鼠感染死亡率极高,是感染率最高以及严重干扰实验的病原体,干扰肿瘤学、免疫学、生理学及生殖技术方面的实验研究;MRV/ EDIM只对新生小鼠致病;大鼠感染Reo-3非常少见,一旦感染可能会干扰肿瘤移植和利用这些动物细胞进行的体外试验;曾有RRV感染导致消化系统疾病的报道;RCMV感染在实验鼠中极为罕见,野生鼠中较为常见,可以通过潜伏感染大鼠器官移植转移到受体大鼠器官;MTV可通过亚临床感染小鼠组织感染幼鼠对实验造成复杂的影响;MCMV未见自然感染报道,实验接种该病毒可引起严重干扰免疫反应;MPV是感染实验小鼠非常重要的病原体之一,病毒感染免疫活性的小鼠后病毒可在胰腺、小肠淋巴器官,肝脏中复制,并可能持续几个星期,病毒感染免疫缺陷小鼠后病毒可在机体内广泛存在;腺病毒(adenoviruses)包括K87及FL株(也称为MAd-1及MAd-2),MAd-1感染可对成年小鼠造成广泛持久的病变。
2.3皮肤和关节异常在实验鼠群中较为常见
可造成实验鼠皮肤和关节异常的病毒病原有:Ect、RPV、mouse papule virus和MMTV。Ect感染常为亚临床活动性,易感动物感染几乎全部死亡,是重要的小鼠烈性传染病,污染的动物组织及生物制品是实验室间传播的主要方式;RPV实验鼠群中较少见,可隐性感染,易感动物感染死亡率几乎50%,大鼠感染可造成肺、皮肤、肺及皮肤三种类型的损害;Mouse papule virus患病小鼠在脚和尾巴出现中央缩进或类似酒窝的丘疹,患处水肿和充血,皮肤损伤类似的鼠痘;MMTV高度致癌,是导致小鼠乳腺瘤的病毒。
2.4某些病原将机体的造血系统作为它们的主要目标组织
它们包括:LCMV、LDHV、MuLVs。LCMV是非常重要的人畜共患传染病病原,尽管传统被认为是中枢神经系统的主要病原体,实际上该病原主要损害的是机体的造血系统,主要影响免疫学、生理学和生理机能方面的研究;LDHV是小鼠肿瘤组织的常见污染物,感染鼠血清乳酸酶可增加5~10倍;MuLVs是一群基因相关的病毒被统称为小鼠白血病病毒,许多近交系小鼠敏感,与肿瘤发生相关。
2.5影响中枢神经系统的病毒是TMEV/GD7
少有自然感染,实验鼠感染该病毒出现类似人类感染脊髓灰质炎病毒的表现。
2.6对机体多系统造成损害的病毒病原有:KRV、H-1、MVM、MHV、POLY、HV、SDAV、MNV
KRV及H-1是细胞及生物制品的常见污染物,很少有自然感染,感染可能会干扰胎儿发育导致畸形发生;MVM在小鼠中流行较为广泛,是移植肿瘤及敏感动物细胞系的常见污染物,感染对于大多数的研究几乎没有意义,但对小鼠移植肿瘤、白血病和体外免疫测定等研究非常重要。常会干扰病理学、免疫学、生理学、细胞生物学、发育学及肿瘤学等方面的研究;POLY也是移植肿瘤及细胞系的常见污染物,自然感染免疫正常鼠对实验影响可能较小,没有POLY污染的鼠群一旦感染新生鼠可引起肿瘤广泛分布造成免疫力低下从而影响实验;HV是最重要的人畜共患病之一,可造成实验大鼠持久的亚临床感染,导致严重疾病;MNV在实验鼠群中感染率较高,免疫健全小鼠感染不引起临床症状,一些品系的免疫缺陷鼠可引起感言、间质性肺炎、脑炎等,从而影响实验。
3关于健康检测计划的制定
似乎制定更为全面的健康监测方案,采用更严格的微生物控制水平,才是实验动物健康以及动物实验可重复性的重要保证。然而在实际工作中,经济成本、可操作性以及对实验动物自然状态模拟等因素是必须考虑的问题。因此,采用最严格的微生物控制水平排除所有病原,使用最高级别的实验动物并不一定是最适合的[7、8]。
对于动物饲养机构来说,采用最严格的控制措施的确会浪费很多资源。实际上,有些病原体是相当难以清除的,一些动物设施实验动物鼠群中存在一种或几种病原感染的现象,所以彻底消除这些病原体是不现实的,应优先消除人兽共患病、动物烈性传染病以及对研究数据影响较大的病原体。并且,在有可能根除某病原时对其监测才有意义[7、8]。
对于实验动物使用者来说,实验动物健康监测方案应根据研究目的来制定,不同类型的科研项目不应使用同一种健康监测方案。实验人员应首先该考虑研究项目需要选择何种级别的实验动物,还要考虑需排除哪些可能干扰实验的其它病原以及实验设施或本地区的病原流行情况,才能制定更为科学的健康检测及监测方案[7、8]。
4对现行国标检测项目的建议
目前,我国实验动物国家标准(GB14922.2-2011)病毒检测与欧美日等国家和地区相比,涉及的检测项目相对较少,一些新兴的影响实验动物及动物实验的传染性病原未能涉及。
笔者建议,设置我国特有的核心检测项目(包括人兽共患病及实验动物烈性传染病,为最低检测要求)及“备选检测项目”(主要是隐性感染性病原,根据需要进行选择)。借鉴这样的分类方法既便于实验动物工作者识别病原危害程度及可能存在潜在影响的因素,设计出符合实际需要的健康监测计划,又可为实验动物商品化、国际化以及科研信息的交流提供必要的保障。“备选检测项目”可根据需要从中选择,不做强制要求。“备选检测项目”应包含尽可能多的检测内容,提供更为广泛的健康监测范围,最大程度地满足不同实验需要。

表3 影响实验动物小鼠、大鼠质量的病毒病原
备注:*存在感染的可能;**敏感;
另外,通过回顾十余年来我实验动物质量检测中心对二十余家实验动物饲养及使用单位的大鼠、小鼠活体及血清样本的检测结果,通过查阅十余年来我国部分检测实验室的大鼠、小鼠病毒检测报告,发现大鼠HV病毒、小鼠Ect病毒、GD7/TMEV病毒抗体检出率呈极低水平或未曾检出,在普通实验大鼠血清样品抽查过程中发现有人兽共患病LCMV病毒的检出[9]。
综上所述,作者建议实验动物国家标准的等级标准中,调整大鼠HV及小鼠Ect由“必检项目”(即“●”)调整为“必要时检测的项目”(即“○”);在大鼠“核心检测项目”清单中增加对LCMV的检测要求,设置为“必要时检测项目”(即,“○”);取消对TMEV病毒的检测要求,将该病毒列至“备选检测项目”清单中。见表4、表5。

表4 实验动物大鼠、小鼠病毒检测项目之——核心检测项目
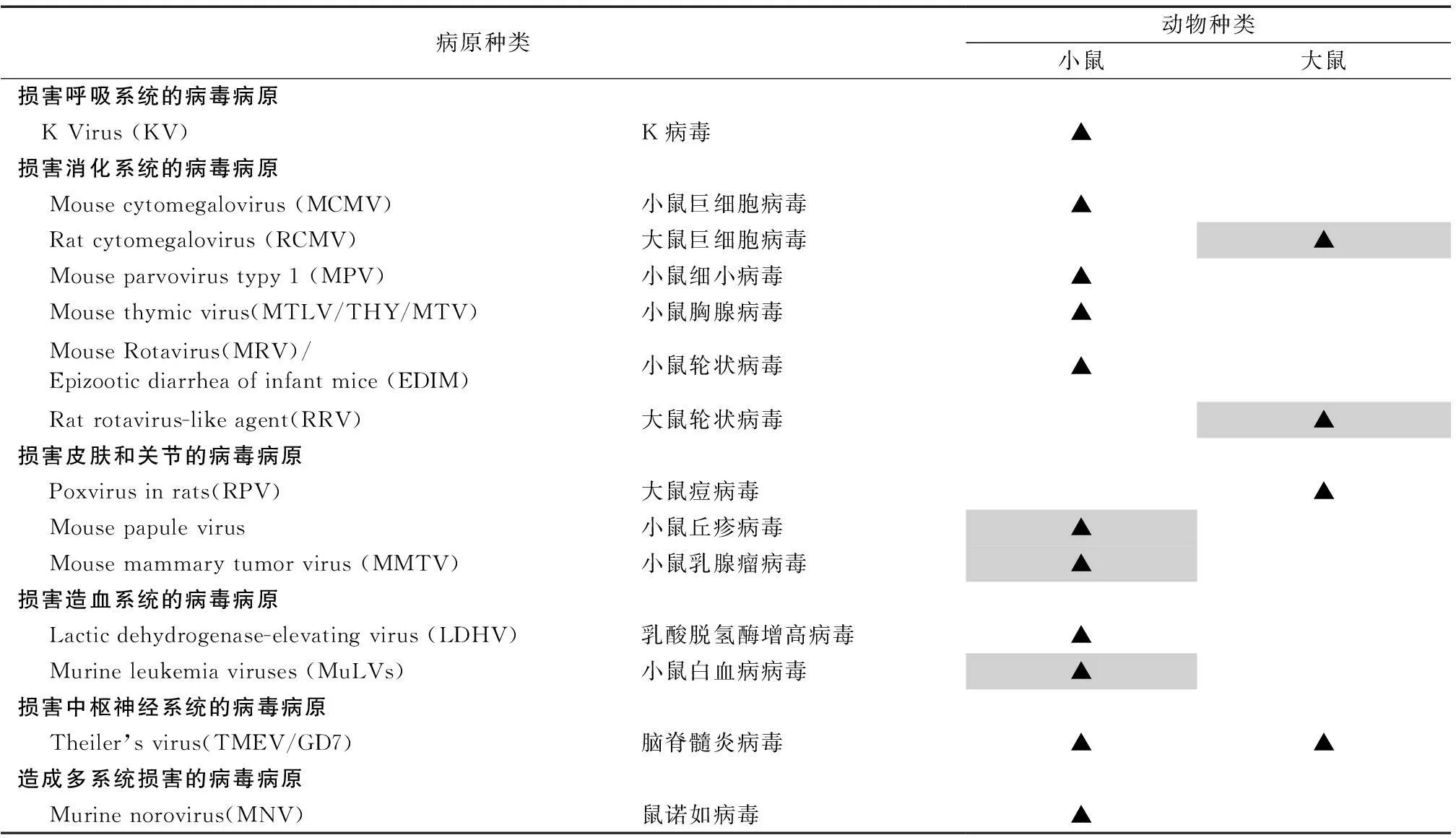
表5 实验动物大鼠、小鼠病毒检测项目之——备选检测项目
注:根据实验需要,选择需要排除的病毒病原。备注:表格中“▲”的检测项目为日本ICLAS、美国Charles River Laboratories、欧洲FELASA没有列出的检测项目。
参考文献:
[1]Mähler (Convenor) M, Berard M, Feinstein R, et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units [J]. Lab Anim Poblished Online, February 4, 2014,48(3):178-192.
[2]Clifford CB. Routine Health Monitoring of Charles River Rodent Barrier Production Colonie in Europe and North America [S]. Charles River Research Models. Technical Sheet. Charles River 2014, Laboratory International, Inc. http://www.criver.com/files/pdfs/rms/hmsummary.aspx
[3]GB/T14922.2-2001. 实验动物微生物学等级及监测[S]. 中国人民共和国国家质量监督检疫检疫总局, 2011:1-6.
[4]Baker DG. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research [J]. Clin Microbiol Rev, 1998; 11(2): 231-266.
[5]Infectious Diseases of Mice and Rats Committee on Infectious Diseases of Mice and Rats, Institute of Laboratory Animal Resources, Commission on Life Sciences, National Research Council. Infectious Diseases of Mice and Rats [M]. National Academy Press, Washington, D.C. 1991. ISBN: 0-309-55692-9. http://www.nap.edu/catalog/1429.html.
[6]Microbial and Phenotypic Definition of Rats and Mice: Proceedings of the 1998 US/Japan Conference [C]. International Committee of the Institute for Laboratory Animal Research, National Research Council. ISBN: 0-309-52018-5, (1999). http://www.nap.edu/catalog/9617.html.
[7]庞万勇,贺争鸣. 实验用生物样品的啮齿类微生物污染的检测管理中国比较医学杂志 [J].中国比较医学杂志, 2011, 21(10): 94-98.
[8]范文平, 贺争鸣. 西方国家实验动物健康监测的理念 [J]. 实验动物科学, 2011, 23(43): 62-67.
[9]佟巍, 乔红伟, 魏强, 等. 淋巴细胞脉络丛脑膜炎病毒在实验大鼠中的感染状况 [J]. 医学动物防治, 2010, 27(4): 46-48.
〔修回日期〕2015-12-27
Consideration of the virological items in the National Standard of Laboratory Animals
TONG Wei
(Institute of Laboratory Animals, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100021,China)
【Abstract】Based on the practice in laboratory animal monitoring, the following issues are suggested: (1) The core items and candidate items should be separated in the National Standard; (2) Hantaan virus and Ect virus should be omitted in the core list for mice; LCMV should be monitored as a candidate item for rats; TMEV should be listed as candidate item.
【Key words】Laboratory animals, Virological monitoring
doi:10.3969.j.issn.1671-7856. 2016.02.009
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016) 02-0042-06
[通讯作者]佟巍(1972-),女,主管技师,实验动物病毒学免疫学。E-mail: twtongwei@sina.com。
“实验动物国家标准论坛”专题

