强志组方对多发性抽动症复合恐惧行为大鼠的影响
金 枝,阎兆君,李亚群,赵兴友,吴金勇,袭雷鸣
(1. 山东中医药大学,济南 250000;2. 山东中医药大学附属医院,济南 250000)
研究报告
强志组方对多发性抽动症复合恐惧行为大鼠的影响
金枝1,阎兆君2,李亚群1,赵兴友1,吴金勇2,袭雷鸣2
(1. 山东中医药大学,济南250000;2. 山东中医药大学附属医院,济南250000)
【摘要】目的探究强志组方治疗多发性抽动症(TS)复合恐惧行为的作用机制。方法腹腔注射亚氨基二丙腈(IDPN)建立TS大鼠模型后,进一步声电刺激建立TS复合恐惧大鼠模型,给予不同药物灌胃治疗后,采用旷场试验、行为学检测大鼠行为变化,高效液相法(HPLC)检测脑组织中多巴胺(DA)的含量,免疫组织化学法检测酪氨酸羟化酶(TH)的含量,RT-PCR检测TH mRNA 的表达。结果与正常对照组相比,模型对照组刻板行为、运动行为增加,冻结时间延长,脑组织中 DA、TH、TH mRNA 含量无明显变化;与模型对照组相比,强志组方组刻板行为、运动行为减少,冻结时间缩短,脑组织中 DA、TH、TH mRNA 含量减少。结论强志组方可改善模型大鼠抽动复合恐惧行为,其作用机制可能是通过下调 TH mRNA表达,降低 TH 含量,减少 DA 合成实现的。
【关键词】强志组方;多发性抽动症;恐惧行为;多巴胺;酪氨酸羟化酶;
多发性抽动症(Tourette syndrome, TS)是儿童时期常见的精神行为性疾病,且在疾病的发生和发展过程中常常伴随恐惧行为等临床表现[1]。目前本病的发病机制仍不十分明确,普遍认为本病的发病与神经递质系统的异常有关。部分研究表明患儿脑纹状体存在多巴胺(dopamine, DA)活动过度现象[2]。酪氨酸羟化酶(tyrosine hydroxylase, TH)是 DA 合成过程中的限速酶,其含量影响 DA 的生成,两者之间密切关系。强志组方由巴戟天、制远志、茯神、清半夏、天麻、山药、大枣等药物组成,具有强志定意,安魂助勇之效,临床上用于治疗多发性抽动症,已取得显著疗效[3]。本研究基于3,3-氨基二丙腈((3,3’-iminodipropionitrile, IDPN)诱导的 TS 大鼠模型,与恐惧行为模型相复合建立复合大鼠模型,观察强志组方对大鼠模型行为学及脑组织中 DA、TH、TH mRNA 的影响,以探讨强志组方的作用机制。
1材料和方法
1.1实验动物及实验环境
SD 雄性大鼠,48 只,体重(200 ± 20)g,购自北京华阜康生物科技股份有限公司,许可证号为 SCXK(京)2014-0004,质量合格证号11401300018142。实验在山东中医药大学附属医院动物实验室进行,许可证号:SYXK(鲁)2011 0019。
1.2仪器与试剂
Agilent 1100高效液相色谱仪(Agilent),用于含量测定。RM 2235转轮式切片机(Leica)、TP 1020自动脱水机(Leica)、ST 5020多功能染色机(Leica)用于免疫组化检测。AB17500 PCR 仪(AB & Invitrogen)用于 PCR 检测。
强志组方是由巴戟天、制远志、茯神、清半夏、天麻、山药、大枣等药物组成,购自山东中医药大学附属医院药剂科。硫必利片,购自江苏恩华药业集团有限公司,批号为 201306181。IDPN 购自 Sigma 公司。DA、NE 标准品均购自中国药品生物制品检定所。一抗 Rb a tyrosine hydroxylase 购自北京博奥森生物技术有限公司。SP 检测试剂盒、DAB 显色试剂盒购自北京中杉金桥生物技术有限公司。TRIzol、逆转录试剂盒购、荧光定量试剂盒购自于天根生化科技有限公司。
1.3动物实验
1.3.1造模方法: 大鼠适应性喂养1周,腹腔注射 IDPN,300 mg /kg,1 次/d,连续注射 7 d,诱导大鼠出现抽动症状。抽动造模完成后,适应性喂养1周。将大鼠单独放入声电刺激仪,前 5 min 为适应期,之后给予 2 S 噪声信号(“滴滴”两声)并紧跟 1 S 电击(2 mA),间隔 1 min,每天 30 次,共 5 d。第 6、7 天实验只予噪音信号,不予电击;声电刺激连续重复 3 周。
1.3.2分组与给药: 大鼠随机分为正常对照组、TS 复合恐惧行为组(简称模型对照组)、强志组方组(5 g /kg)、硫比利组(25 mg /kg),每组 12 只。连续灌服 4 周,正常对照组、模型对照组同时灌服等量生理盐水。末次给药后禁食不禁水 24 h,断头取脑,冰盒上快速剥离大鼠脑组织,拍照,电子天平称重,分装后冷冻保存待检测。
1.3.3旷场试验:旷场试验综合评价抽动行为与恐惧行为。将动物置于旷场试验箱中(长×宽×高:100 × 100 × 50)cm,周壁为黑色,底面分成面积相等的 25 方格的旷场里。摄像记录动物 5 min 的行为,以穿越底面的格数为水平活动得分,以直立抬首的次数为垂直活动得分,旷场实验得分为两者之和。行为评定采用盲法,由 2 名观察者观看录像后评分,取其平均值,电脑记录其活动轨迹。
1.3.4刻板行为与运动行为测试:在安静、避光环境下,将大鼠放置于旷场试验箱中适应 5 min,按照文献[4]中对 TS 大鼠模型刻板行为的评分方法,在末次给药 1 h后,进行双盲观察 1 h,每 5 min 记录 1 次,并统计其总分平均值。评分标准见表 1。在进行刻板行为测试同时进行运动行为测试。按照文献方法[4],在末次给药 1 h后,进行双盲观察 1 h,每 5 min 记录 1 次,并统计其总分。评分标准见表 2。

表1 刻板行为测试评分标准

表2 运动行为测试评分标准
1.3.5恐惧行为检测: 恐惧行为学检测通过冻结时间判定。模型对照组大鼠在第 6、 7 天实验噪音后出现冻结姿势 (freezing posture),表现为静止、呆滞、蜷缩、蹲伏等,期间仅有呼吸和轻微摇摆运动。其总时间称为冻结时间 ( freezing time),冻结时间总时间(单位:s)即为大鼠恐惧行为学得分。行为评定采用盲法,单位以秒来计算。每测定完 1 组大鼠,氨水清洁自主活动箱中大鼠排泄物,以消除对下只鼠自主活动的影响。
1.3.6脑组织中单胺类神经递质 DA 检测:取脑组织 100 mg 放入玻璃匀浆器中,加入高氯酸 500 mg,充分匀浆,离心(12 000 r/min,15 min,4℃),仔细收集上清液,经 0.20 μm 滤器过滤后取 20 μL注入高效液相色谱仪中。色谱条件:固定相分析柱为 C18 反相色谱柱(250~x 4.6 mm),流动相组成 A 为 0.02 mol/L 磷酸二氢钾缓冲液,B 为乙腈。流速为 1 mL/min。柱温保持在 35℃,荧光检测器波长设置为:激发波长 280 nm,荧光波长 315 nm,以峰面积定量,根据标准曲线计算出大鼠脑组织内 DA 含量。
1.3.7脑组织中 TH 的检测:免疫组织化学法检测大鼠脑组织中 TH。大鼠脑组织用 4% 中性甲醛固定 24 h,石蜡包埋,切片,常规脱蜡至水,蒸馏水冲洗,PBS 浸泡 5 min。含 3% H2O2的去离子水孵育15 min,以消除内源性过氧化物酶活性。滴加试剂 A(蓝色液体)室温孵育 15 min,倾去液体。滴加一抗,4℃ 过夜。第2天取出后室温平衡 10 min,PBS 冲洗 3 次,每次 3 min。滴加试剂 B(黄色液体),37℃ 孵育 15 min,PBS 冲洗 3 次,每次 3 min。滴加试剂 C(橙色液体),37℃ 孵育 15 min,PBS 冲洗 3 次,每次 3 min。DAB 显色试剂盒显色,自来水充分浸泡冲洗,苏木素染液复染 5 s,脱水至透明,中性树胶封片。同时 PBS 代替一抗作为阴性对照,显微镜下观察细胞胞质或胞浆呈棕色或者棕黄色颗粒为阳性,不显色为阴性。每组选取 10 张片,光学显微镜 200 倍随机选取 10 个不重叠视野,采用 Leica Qwin V3 图像分析软件,对染色结果进行评分,在 200 倍镜下随机选取 4 个视野,进行灰度值测定,取平均值。
1.3.8脑组织中 TH mRNA 的检测: RT-PCR 检测脑组织中 TH mRNA 的含量。(1)TRIzol 试剂提取总 RNA:取脑组织 100 mg,液氮冷冻后低温充分研磨,加入 1 mL TRIzol 试剂,静置 5 min,加入氯仿 0.2 mL 混匀后室温放置 3 min, 离心(4℃,12 000 r/min)取上清液 0.5 mL,加入异丙醇 0.5 mL 混匀后室温沉淀 10 min,离心(4℃,12 000 r/min)弃上清液,加入 75% 乙醇(DEPC 水配置)混匀,离心(4℃,7 500 r/min)弃上清液,沉淀(即模板 RNA)略干后加入 DEPC 水 20 μL 备用。(2)RT 反应得 cDNA 模板:将10× RT Mix 2 μL、Super pure dNTPs 2 μL、Oligo-(Dt)152 μL、Quant Reverse Transcriptase 1 μL 震荡混合均匀后加 RNsae-free 双蒸H2O 及模板 RNA,保持总体积为 20 μL,涡旋震荡混合均匀简单离心收集管壁残余液体,37℃孵育 60 min,得到逆转录产物 cDNA。(3)使用 SYBR Green I master mix 试剂盒进行 PCR 扩增:SYBR Green PCR Master Mix 10 μL、上游引物 2 μL、下游引物 2 μL、模板 2 μL、dd H2O 4 μL(总计20 μL),均匀混合后入 PCR 仪进行扩增反应,测定 TH mRNA 浓度。其中上游引物为 GCAGCCCTACCAAGATCAAA,下游引物为CGCTGGATACGAGAGGCATA。
1.4统计学方法
2结果
2.1强志组方对复合大鼠模型自主活动的影响
与正常对照组相比,模型对照组自主活动减少(P<0.05);与模型对照组相比,硫必利组、强志组方组大鼠自主活动增多(P<0.05);与硫必利组相比,强志组方组无明显变化(P>0.05)。(图 1)。
2.2强志组方对复合大鼠模型刻板行为、运动行为的影响
与正常对照组相比,模型对照组全部造模完成后刻板行为、运动行为增多(P<0.05);与模型对照组相比,硫必利组、强志组方组刻板行为、运动行为均减少(P<0.05);与硫必利组相比,强志组方组治疗刻板行为作用明显(P<0.05),治疗运动行为硫必利效果明显(P<0.05)。(图 2、图 3)。
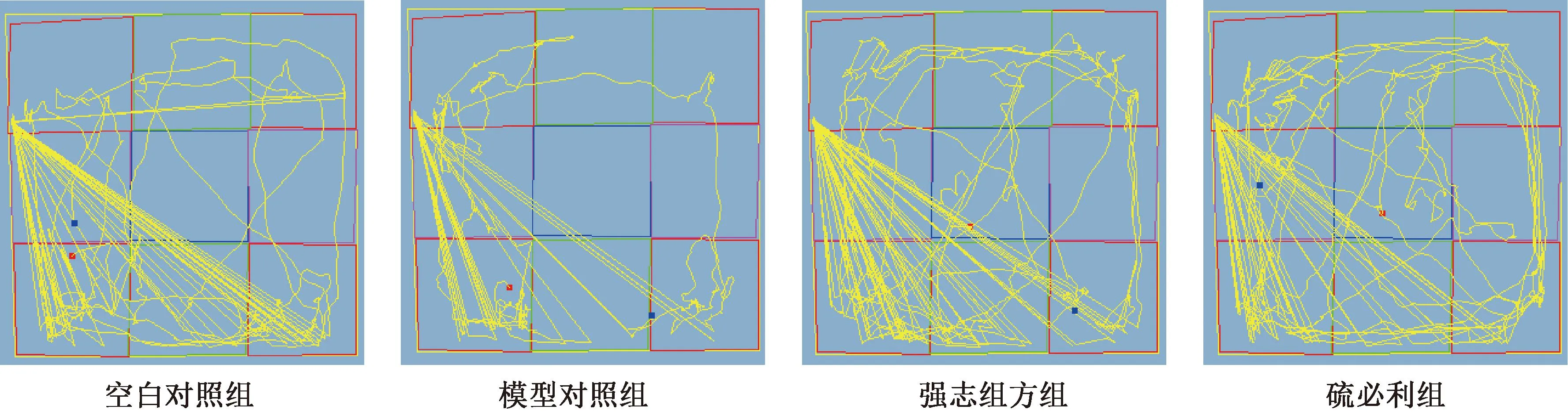
图1 强志组方对大鼠模型自主行为的影响Fig.1 Effects of “Qiangzhizufang” on autonomous behavior in the model rats
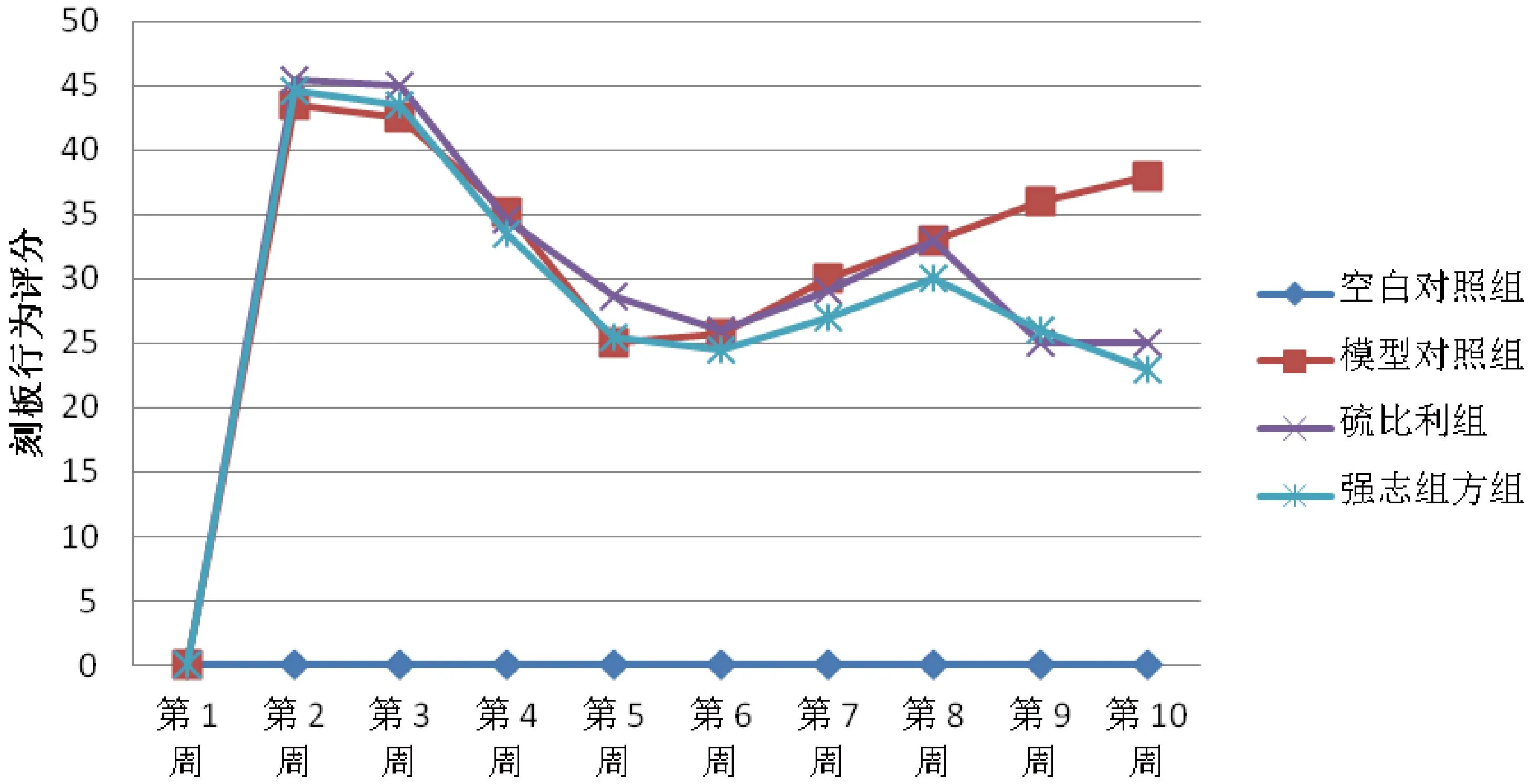
图2 强志组方对大鼠模型刻板行为的影响Fig.2 The effects of “Qiangzhizufang” on stereotyped behavior in the model rats
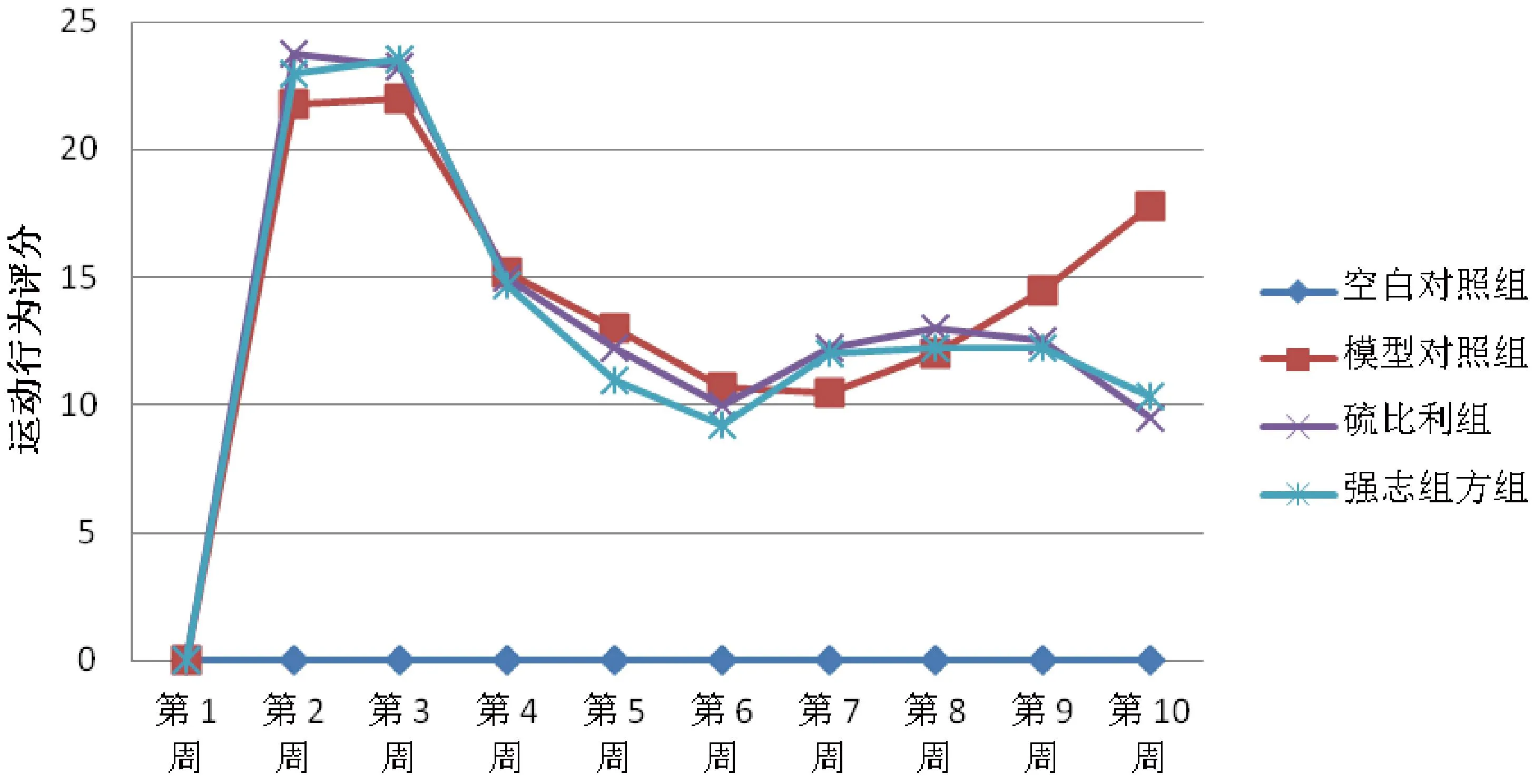
图3 强志组方对大鼠模型运动行为的影响Fig.3 The effects of “Qiangzhizufang” on exercise behavior in the model rats
2.3强志组方对复合大鼠模型恐惧行为的影响
与正常对照组相比,模型对照组全部造模完成后冻结时间延长(P<0.05);与模型对照组相比,硫必利组、强志组方冻结时间缩短(P<0.05);与硫必利组相比,强志组方组冻结时间明显缩短(P<0.05)(图 4)。
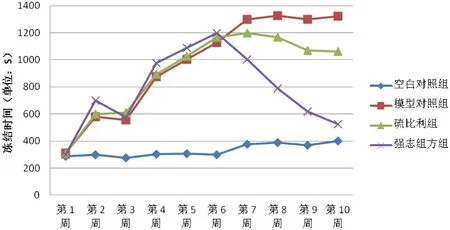
图4 强志组方对大鼠模型冻结时间的影响Fig.4 The effects of “Qiangzhizufang” on freezing time in the model rats
2.4强志组方对复合大鼠模型脑组织内 DA 影响
与正常对照组相比,模型对照组大鼠脑组织中 DA 含量无明显变化 (P>0.05);与模型对照组相比,强志组方组脑组织中 DA 含量降低 (P<0.05) (表 3)。
2.5强志组方对复合大鼠模型脑组织内 TH 的影响
应用 SP 染色方法观察各组大鼠脑组织中 TH 阳性率的变化,图 5 为各组大鼠脑组织 TH 免疫组化染色图片。与正常对照组相比,模型对照组大鼠脑组织中 TH 阳性率无明显变化 (P>0.05);与模型对照组相比,强志组方组脑组织中 TH 阳性率降低 (P<0.05) (表 3)。
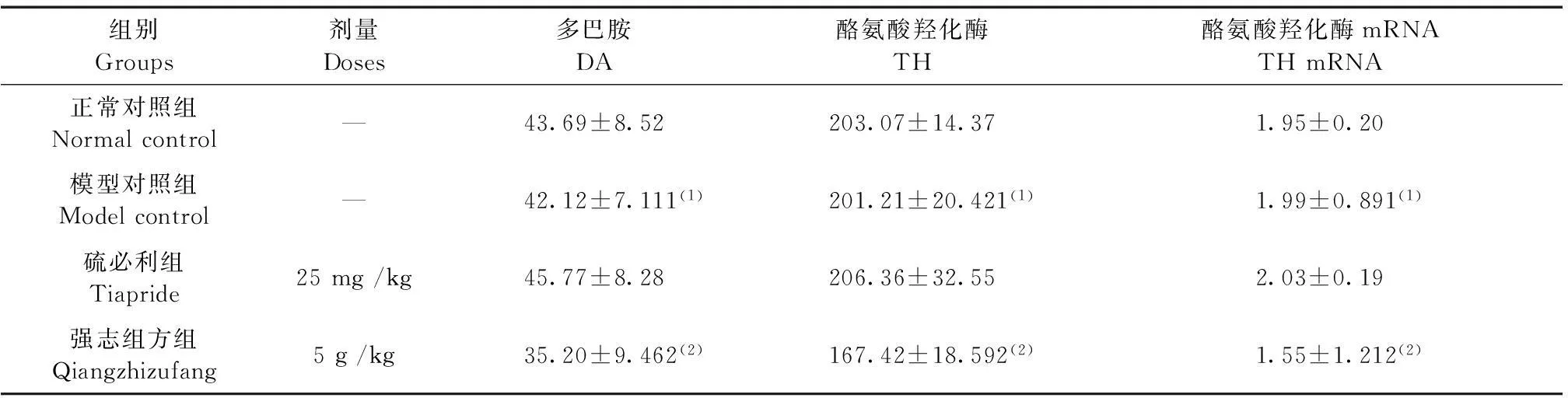
表3 强志组方对大鼠模型脑组织中 DA、TH、TH mRNA 含量的影响
注:与正常对照组相比,(1)P>0.05;与模型对照组相比,(2)P<0.05。
Note. Compared with the normal control group,(1)P>0.05; Compared with the model control group,(2)P<0.05.
2.6强志组方对复合大鼠模型脑组织中 TH mRNA 的影响
与正常对照组相比,模型对照组大鼠脑组织中 TH mRNA 含量无明显变化 (P>0.05);与模型对照组相比,强志组方组脑组织中 TH mRNA 含量降低 (P<0.05) (表 3)。
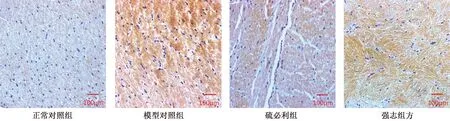
图5 大鼠脑组织免疫组化染色图片(标尺=100 μm)Fig.5 The immunohistochemistry in brain tissue of model rats(Bar=100 μm)
3讨论
TS 属中医学抽搐、慢惊风等范畴,是儿童时期常见的精神行为性疾病。临床观察发现 TS 的抽动动作不自主、无目的、重复,发作时可受意识控制暂时停止抽动,但不能持久,缺乏控制力是本病的特点,且在疾病的发生和发展过程中常常伴随恐惧行为等临床表现[1]。通讯作者认为疾病的发生与肾志不足相关,自拟强志组方治疗本病,临床取得明显疗效[3]。
目前 TS 动物模型的行为学体现不全面,仅能部分模拟临床TS患儿的行为学和神经生化方面的改变[5-7]。IDPN 腹腔注射诱导建立 TS 大鼠模型被公认是理想的 TS 动物模型之一,目前已被广泛用于 TS 发病机制及药物作用机制的研究[8,9]。实验发现,IDPN 连续腹腔注射 7 d后,大鼠刻板行为、运动行为增多,与文献描述一致[10],标志造模成功。后与恐惧模型复合,采用声电诱导建立恐惧模型,自主活动减少,刻板行为、运动行为减少,冻结时间明显延长,与文献描述一致[11,12],标志恐惧造模成功。本研究针对TS动物模型局限性,提出将TS大鼠模型与恐惧大鼠模型相复合,建立TS复合大鼠模型,考察强志组方治疗效用与作用机制。与空白对照组相比,模型对照组自主活动减少,刻板行为、运动行为增多,冻结时间延长,标志 TS 造模与恐惧造模均成功复制。该复合模型既模拟了患儿的抽动行为,又模拟了患儿常常伴有的恐惧行为,可以较为综合的评价药物的治疗效果。与模型对照组相比,强志组方组、硫必利组自主活动增加,刻板行为、运动行为明显减少,表明硫必利与强志组方均可治疗抽动症状;与模型对照组相比,强志组方组冻结时间缩短,而硫必利组无明显改变,表明强志组方可缓解恐惧行为,而硫必利则无此方面作用。另外与硫必利组相比,强志组方组一般情况较好,体重增加明显,提示强志组方具有疗效好,不良反应少的优点。
TS 的发病机制尚未完全明确[13],普遍认为此病的发生可能是由遗传、免疫、神经生物、心理、社会、感染、创伤、及药物滥用等因素单独或联合致病的结果[12]。其中,从神经生物学角度探讨的神经生化学说最受关注[14]。目前众多研究者认为此病的发生与 DA 系统的亢进有关,研究方向主要集中在 DA 异常分泌和 DA 受体超敏感方面[7]。而神经递质的合成、储存、释放或降解的任何环节受到干扰,或递质受体的功能异常,均可导致相应的神经精神功能的改变,如恐惧行为产生[15-16]。本研究中,与正常对照组相比,模型对照组中 DA 含量无明显改变;与模型对照组相比,强志组方组 DA 含量下降。本研究中选用 IDPN 腹腔注射建立 TS 大鼠模型,关于其 DA 含量变化,文献报道不一致[17],普遍认为其可导致 DA 含量下降或保持不变[18-20]。采用声电刺激建立恐惧大鼠模型,可导致 DA含量应激性升高[21]。本研究中 DA 含量无明显改变,猜测可能是由于其 IDPN 诱导建立 TS 模型导致 DA 含量下降,而后又进行声电刺激诱导建立恐惧模型导致 DA 含量应激性升高,两者最终相抵导致含量无明显变化。与模型对照组相比,强志组方组 DA 含量下降,硫必利组 DA含量无明显变化,因此推测强志组方与硫必利作用机制可能存在不同。TS的发生主要认为DA 异常分泌增加和 DA 受体超敏感方面[7],硫必利是多巴胺受体阻滞剂,因而考虑强志组方发挥作用可能是通过减少 DA 异常分泌而实现的。恐惧状态下 DA 含量升高[20],硫必利与多巴胺受体结合发挥治疗作用而不具备减少 DA 含量的作用,从而可治疗 TS 而不能改善恐惧行为,由此推测强志组方通过减少 DA 含量而发挥治疗 TS 和恐惧作用的。
多巴胺神经元摄取血液中的酪氨酸,酪氨酸在 TH的催化下生成多巴,再经多巴胺脱羧酶作用生成DA。其过程中TH 是DA生物合成过程的限速酶,TH的含量影响 DA的合成。本研究中,与空白对照组相比,模型对照组TH无明显变化;与模型对照组相比,强志组方组 TH含量下降,其变化趋势与各组DA含量变化趋势一致, TH mRNA变化趋势与 TH变化趋势一致,由此推测强志组方可能是通过减少 TH mRNA 的表达,降低TH含量,影响DA合成的。
综上所述,强志组方能改善复合模型大鼠抽动行为、恐惧行为,其作用机制可能是通过下调 TH mRNA 的表达,降低 TH 的含量,从而影响 DA 含量而实现的。疾病的发生与诸多因素相关,强志组方是否存在其他作用机制还有待更深入的研究。
参考文献:
[1]刘智胜. 小儿多发性抽动症 [M]. 北京:人民卫生出版社.2002: 92-92.
[2]Houeto JL,Gire P. Tics and Tourette syndrome: diagnosis, course and treatment principles [J]. Presse Med, 2008, 37(2): 263-270.
[3]阎兆君, 孙聪玲, 王晶. 多发性抽动症中医临床辨证现状与思考 [J]. 中国中医药现代远程教育, 2007, 5(1): 14-15.
[4]Diamond BI, Reyes MG, Borison R. A new animal model for Tourette syndrome [J]. Adv Neurol, 1982, 35: 221-225.
[5]Thomas DL, Susan H F. Neurobiological basis of serotonin-dopamine antagonists in the treatment of Gilles de la Tourette syndrome [J]. Progr Brain Res, 2008, 172: 495-513.
[6]王梦雨, 郑毅, 崔永华. 抽动秽语综合征动物实验模型研究进展 [J]. 中国健康心理学杂志, 2014, 22(10): 1598-1600.
[7]车立纯. 抽动障碍动物模型研究进展 [J]. 中国儿童保健杂志, 2013, 21(6): 615-617.
[8]Soler MC, Vilardosa U, Saldana RS, et al. Loss of neurofilaments in the neuromuscular junction in a rat model of proximal axonopathy [J]. Neuropathol Appl Neurobiol, 2012, 38(1): 61-71.
[9]刘智胜. 小儿多发性抽动症 [M]. 北京:人民卫生出版社. 2002: 237-238.
[10]卫利, 王素梅, 陈自佳, 等. 化学因素诱发的多发性抽动症动物模型的比较研究 [J]. 中华行为医学与脑科学杂志, 2010, 19(8): 683-686.
[11]董秋安, 刘晓伟. 恐惧应激大鼠行为学评估及比较 [J]. 黑龙江中医药, 2014, 43(1): 44-45.
[12]刘佳佳, 潘霄, 严进, 等. 大鼠恐惧应激模型的建立及指标筛选 [J]. 实用医药杂志, 2011, 28(5): 447-450.
[13]齐越, 魏小维. 多发性抽动症发病相关因素的研究进展 [J]. 中国儿童保健杂志, 2013, 21(6): 618-619.
[14]段玲玲, 张骠. 小儿多发性抽动症中枢神经生化介质研究进展 [J]. 江西中医药, 2008, 39(11): 78-80.
[15]董秋安, 刘晓伟, 许丽, 等. 惊恐应激对大鼠下丘脑单胺类递质的影响及中药干预 [J]. 辽宁中医杂志, 2006, 33(12): 1652-1653.
[16]谢忠礼, 李杰, 王兴华. 加味四逆散对慢性应激模型大鼠下丘脑单胺类神经递质的影响 [J]. 中国实验方剂学杂志, 2008, 14(1): 50-52.
[17]王道涵, 王素梅, 卫利, 等. 健脾止动汤对多发性抽动症模型小鼠纹状体多巴胺及其受体含量的影响[J]. 北京中医药大学学报, 2012, 35(7): 452-455.
[18]杜淑娟, 彭贝如, 陈秀梅. 益智宁神口服液对抽动秽语综合征模型大鼠神经生物学和行为学的影响 [J]. 广州中医药大学学报, 2012, 24(7): 358-360.
[19]朱先康, 韩新民, 王敏华. 定抽颗粒治疗小儿多发性抽动症的临床及实验研究 [J]. 中华中医药杂志, 2011, 26(2): 399-402.
[20]张如意, 张丽, 艾厚喜, 等. 金童颗粒治疗拟抽动秽语综合征模型大鼠的药理机制研究 [J]. 中国康复理论与实践, 2010, 16(10): 910-912.
[21]Inglis FM, Moghaddam B. Dopaminegic innervation of the amygdala highly responsive to stress [J]. Neuroehem, 1999, 72: 1088-1094.
〔修回日期〕2015-12-25
Effect of “Qiangzhizufang” on the rat model of Tourette syndrome combined with fear
JIN Zhi1, YAN Zhao-jun2, LI Ya-qun1, ZHAO Xing-you1, WU Jin-yong2, XI Lei-ming2
(1. Shandong University of TCM, Jinan 250014, China;2. Affiliated Hospital of Shandong University of TCM, Jinan 250014)
【Abstract】ObjectiveTo explore the functional mechanism of a Chinese medicine compound “Qiangzhizufang” on rat model of Tourette syndrome (TS) combined with fear. Methods The rat model of TS combined with fear was established by intraperitoneal injection of 3,3’-iminodipropionitrile (IDPN) combined with acoustic stimulation. After giving different drug lavage treatment, the changes of behavior of the rat models were assessed by field test and behavior test. The content of DA, TH and TH mRNA in the brain tissue was detected by HPLC, immunohistochemistry and RT-PCR, separately. ResultsCompared with the normal control group, stereotyped behavior and exercise behavior were increased, freezing time prolonged, but the content of DA, TH and TH mRNA in the brain tissue were not obviously changed in the model control group. Compared with the model control group, the stereotyped behavior and exercise behavior were decreased, content of DA, TH and TH mRNA in the brain tissue was decreased in the “Qiangzhizufang” group. ConclusionsThe Chinese medicine compound “Qiangzhizufang” can improve the behavior in rat models of TS combined with fear. This effect may be realized through down-regurating TH mRNA expression, reducing the content of TH, and reducing the dopamine synthesis.
【Key words】Qiangzhizufang, a Chinese medicine compound; Tourette syndrome, TS; Fear behavior; Dopamine; (DA); Tyrosine hydroxylase (TH); Brain; Rat
doi:10.3969.j.issn.1671-7856. 2016.02.015
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016) 02-0071-06
[作者简介]金枝(1986-),女,研究方向:中医儿科学。E-mail: jinzi-1986@163.com。[通讯作者]阎兆君(1963-),男,研究方向:中医儿科学。Email: yanzhaojun7790@sina.com。
[基金项目]山东省科技发展计划项目(编号:2009GG20002048)。

