DMBA/巴豆油二阶法联合NB-UVB照射构建小鼠皮肤鳞癌模型
吕 超, 刘保国, 郑海萍, 刘 青, 李志峰, 顾 静, 周 萌
(1. 承德医学院研究生院,承德,河北 067000;2. 河北工程大学附属医院,邯郸,河北056002)
研究报告
DMBA/巴豆油二阶法联合NB-UVB照射构建小鼠皮肤鳞癌模型
吕超1, 刘保国2,郑海萍2,刘青2,李志峰2,顾静1,周萌1
(1. 承德医学院研究生院,承德,河北 067000;2. 河北工程大学附属医院,邯郸,河北056002)
【摘要】目的用二甲基苯并蒽(DMBA)/巴豆油二阶法联合NB-UVB 照射,构建皮肤鳞状细胞癌小鼠模型。方法将50只BALB/c小鼠,随机分为3组:A组外涂DMBA/巴豆油;B组照射NB-UVB;C组外涂DMBA/巴豆油,联合NB-UVB照射。实验过程中定期观察小鼠的一般情况和实验部位皮肤的变化,于第5、10、15、20周统计各组小鼠的存活率及成瘤率。第20周时取小鼠皮损组织进行病理检查。结果第5周末,部分C组小鼠出现直径≥1 mm的丘疹,第20周后,三组成瘤率分别为86.67%,7.14%,94.12%;SCC发生率分别为:13.34%,0%,70.59%。结论DMBA/巴豆油二阶法联合NB-UVB构建小鼠皮肤鳞癌模型较单独应用DMBA/巴豆油二阶法或NB-UVB照射成瘤时间短,成瘤率和SCC发生率高。
【关键词】鳞状细胞癌;二甲基苯并蒽;巴豆油;模型,动物
皮肤鳞状细胞癌是人类皮肤较为常见的肿瘤之一,其发生与紫外线中的UVB诱导[1]、病毒感染、接触焦油衍生物、放射线、砷剂等物质有关,探讨鳞癌的发生机制、防治以及预后都具有重要意义。本实验通过探讨如何建立一个成瘤速度快,荷瘤率高,稳定性好,可行性高的小鼠皮肤鳞癌模型,为皮肤鳞状细胞癌的进一步研究提供实验基础。
1材料和方法
1.1实验动物及实验环境
BALB/c小鼠50只,SPF级,雌、雄各半,6~8周龄,体重在16~18 g左右,从北京维通利华实验动物技术有限公司引进[实验动物生产许可证号:SCXK(京)2012-0001],由河北省邯郸市康业制药有限公司动物实验中心负责饲养[实验动物使用许可证号:SYXK(冀)2012-0001]。本单位动物伦理委员会批准号为20150406。实验前适应周围环境1周,动物饲养室为清洁级,室温20~24℃,给予BALB/c小鼠专用饲料和普通水饲养。
1.2仪器与试剂
脱毛剂:硫化钠、洗衣粉、淀粉按3∶1∶7的比例混合,并加水兑成乳胶状;诱癌剂:二甲基苯并蒽(DMBA,Sigma公司)与丙酮液配制成0.75 g/L的DMBA丙酮液,巴豆油(Sigma公司)与丙酮液配制成0.25%的巴豆油丙酮液。 SH-4 B型紫外线光疗仪(产品标准号:YZB/沪4663-26-2012),辐照强度值13.4 mW/cm2,波长311~313 nm,上海希格玛公司产品。
1.3动物实验
1.3.1动物分组:各组小鼠的体重及周龄的平均值通过方差分析,差异无统计学意义(P>0.05)。实验小鼠以数字编码随机分成3组:A组(15只):仅外涂DMBA/巴豆油;B组(15只):仅照射NB-UVB;C组(20只):外涂DMBA/巴豆油联合NB-UVB照射。
1.3.2模型构建阶段:A组小鼠在实验的第1、5、10 天,分别将200 μL DMBA丙酮液涂抹于背部脱去毛发处,每次涂药前1 d进行皮肤脱毛处理,从第3周开始每周四、周日涂抹200 μL巴豆油丙酮液。B组从第3周开始进行NB-UVB照射,每周进行脱毛1次,照光时将小鼠固定于底径10 cm的敞口密闭器具内,照射距离20 cm,分别于每周一、二、三、五、六5 d进行,起始剂量为0.5 J/cm2,逐次递增,每周增加0.1 J/cm2,至第20周照射剂量为2.2 J/cm2时停止,累计剂量为119 J/cm2。C组小鼠在实验的第1、5、10天,分别将200 μL DMBA丙酮液涂抹于背部脱去毛发处,每次涂药前1 d进行皮肤脱毛处理,从第3周开始每周四和周日涂抹200 μL巴豆油丙酮液,每周脱毛一次,每周其余5 d进行NB-UVB照射,照射条件、起始剂量、累计剂量等与B组相同。
1.3.3肿瘤计数: 采用数码相机拍摄小鼠背部皮肤的变化,记录直径≥1 mm且持续时间≥2周的新生物,每周观察各组小鼠荷瘤数和直径的变化。
1.3.4病理学检查:第20周末肉眼观察小鼠成瘤情况,并统计成瘤率及存活率,局部固定小鼠,在利多卡因局麻下切取瘤体。置于4%中性甲醛液中固定,进行石蜡包埋、切片,HE染色,针对病理学结果进行分析。
1.3.5统计学方法: 应用统计学软件SPSS 17.0进行数据处理。小鼠荷瘤率及皮肤鳞癌发生率使用卡方检验。P<0.05为差异有统计学意义。
2结果
2.1各组荷瘤小鼠和荷瘤率
从第5周末开始,C组部分小鼠皮肤开始出现直径≥l mm的丘疹,且新生物随着时间逐渐增大,数量渐增多,且部分皮损相互融合。每组小鼠的荷瘤比例及各组小鼠荷瘤的瘤体数逐渐增多,分别见于表1、2。每组小鼠荷瘤比例=每组荷瘤小鼠只数/每组小鼠存活只数,成瘤率 = 各组成瘤小鼠数/该组存活小鼠数 × 100%,SCC发生率=各组小鼠SCC发生总数/该组存活小鼠数 × 100%。各组成瘤率分别为86.67%、7.14%、94.12%;SCC发生率分别为:13.34%、0%、70.59%。

表1 各组小鼠荷瘤比例
注:第10周时A组、C组荷瘤率比较,P<0.05;第15周、20周P>0.05
Note. Compared the group A with group C,P<0.05;P>0.05 at 15 weeks and 20 weeks.

表2 各组小鼠荷瘤总个数
2.2小鼠肿瘤生长情况
C组于第5周后皮肤开始出现直径≥l mm的丘疹,A组、B组分别于第6周、第12周后部分小鼠才出现类似新生物,随着实验的进行,新生物表面逐渐形成斑块、结节、疣状增生、溃疡或基底浸润,表面糜烂或有坏死组织。实验期间,由于对环境不耐受死亡1只,脱毛手法错误死亡1只,脱毛膏配置不合格引起小鼠死亡2只,诱癌中后期小鼠出现明显消瘦、体重下降等恶病质体质,暂无死亡。
2.3小鼠肿瘤组织病理学改变
根据小鼠瘤组织病理学表现,将其划分为正常、良性、异型增生、SCC,见表3。正常小鼠皮肤组织结构完整,表皮、真皮及皮下组织层次清晰,随着实验周期的延长,小鼠皮肤组织逐渐出现角化过度,棘层肥厚,表皮呈簇状向下延伸,鳞状细胞侵入真皮,见图1、2;高倍镜下呈现非典型角质形成细胞增生,细胞核大小不等,染色质丰富等表现,见图3,部分高分化鳞癌可见角珠形成,见图4。
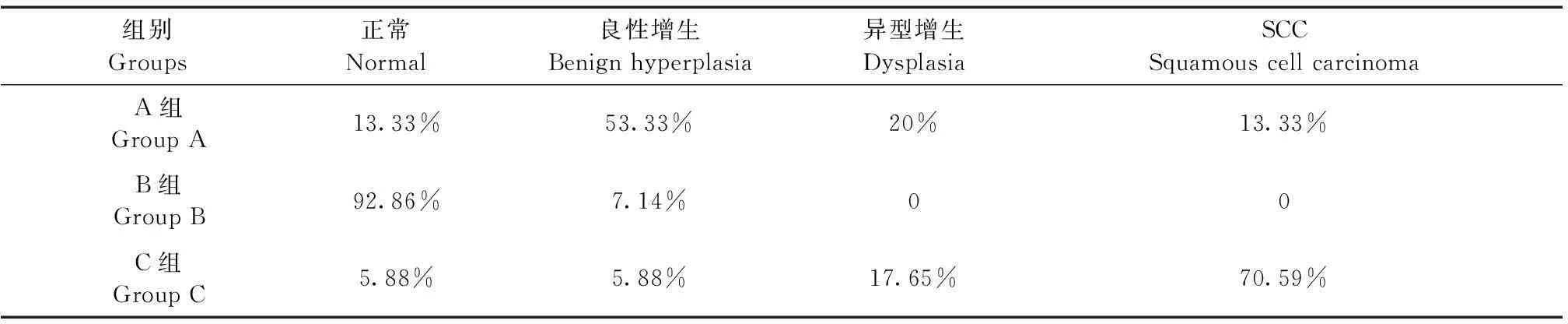
表3 各组小鼠瘤组织病理改变
注:第20周时A组、C组SCC发生率比较,P<0.05
Note. Compared the group A with group C at 20 weeks,P<0.05.
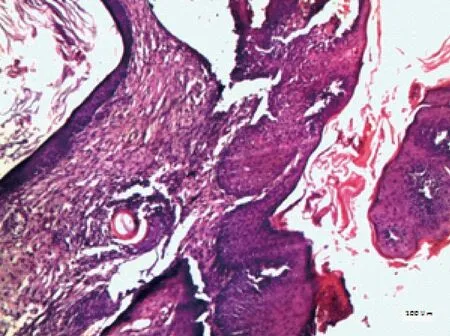
图1 鳞状细胞侵入真皮,角化过度(HE,×100),标尺=100 μm)Fig.1 Squamous cell invasion of the dermis and hyperkeratosis.(Bar=100 μm)
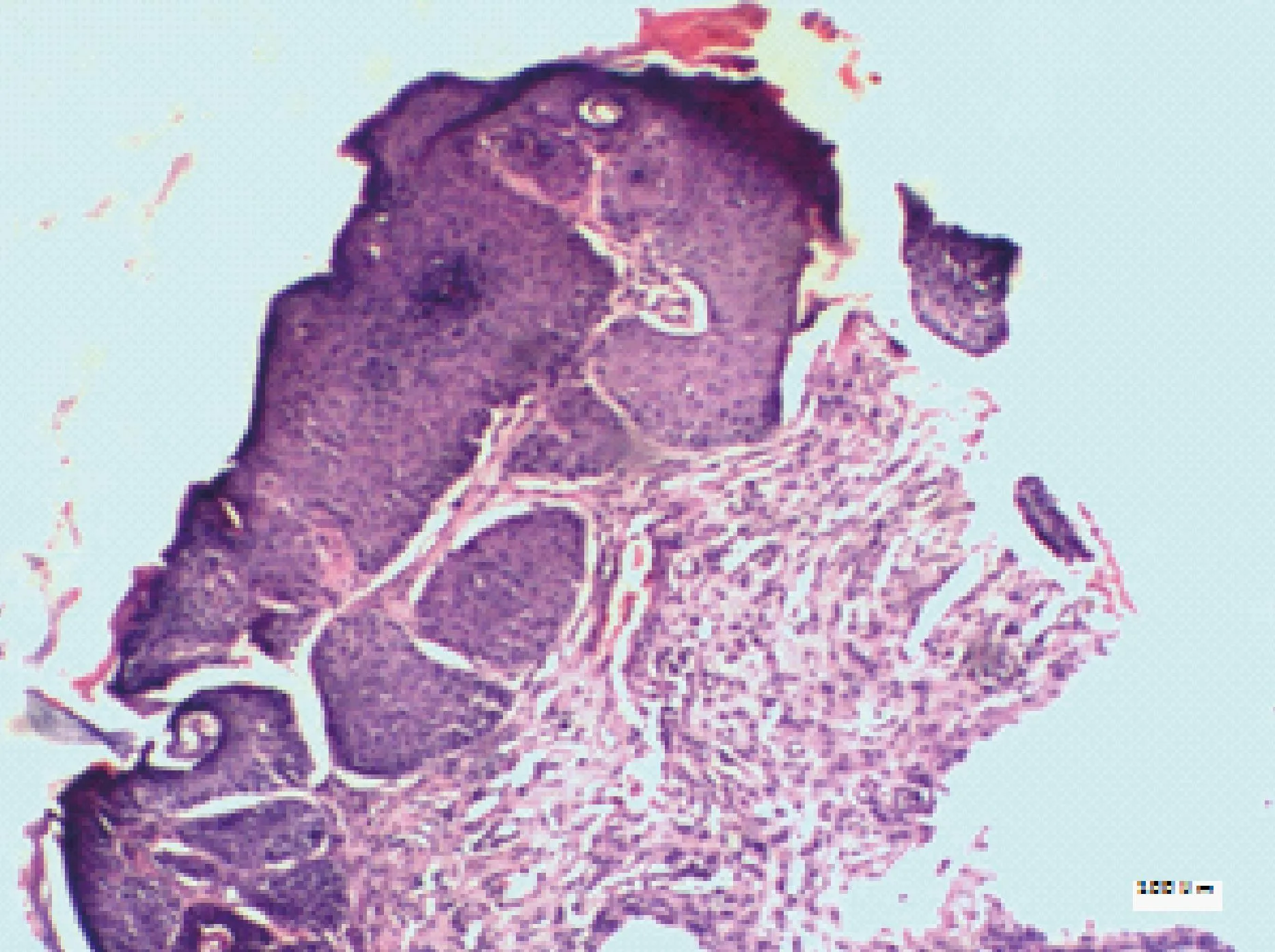
图2 棘层肥厚,表皮呈簇状向下延伸(HE,×100,标尺=100 μm)Fig.2 Epidermal acanthosis and the epidermis clustered with a downward extension.(Bar=100 μm)
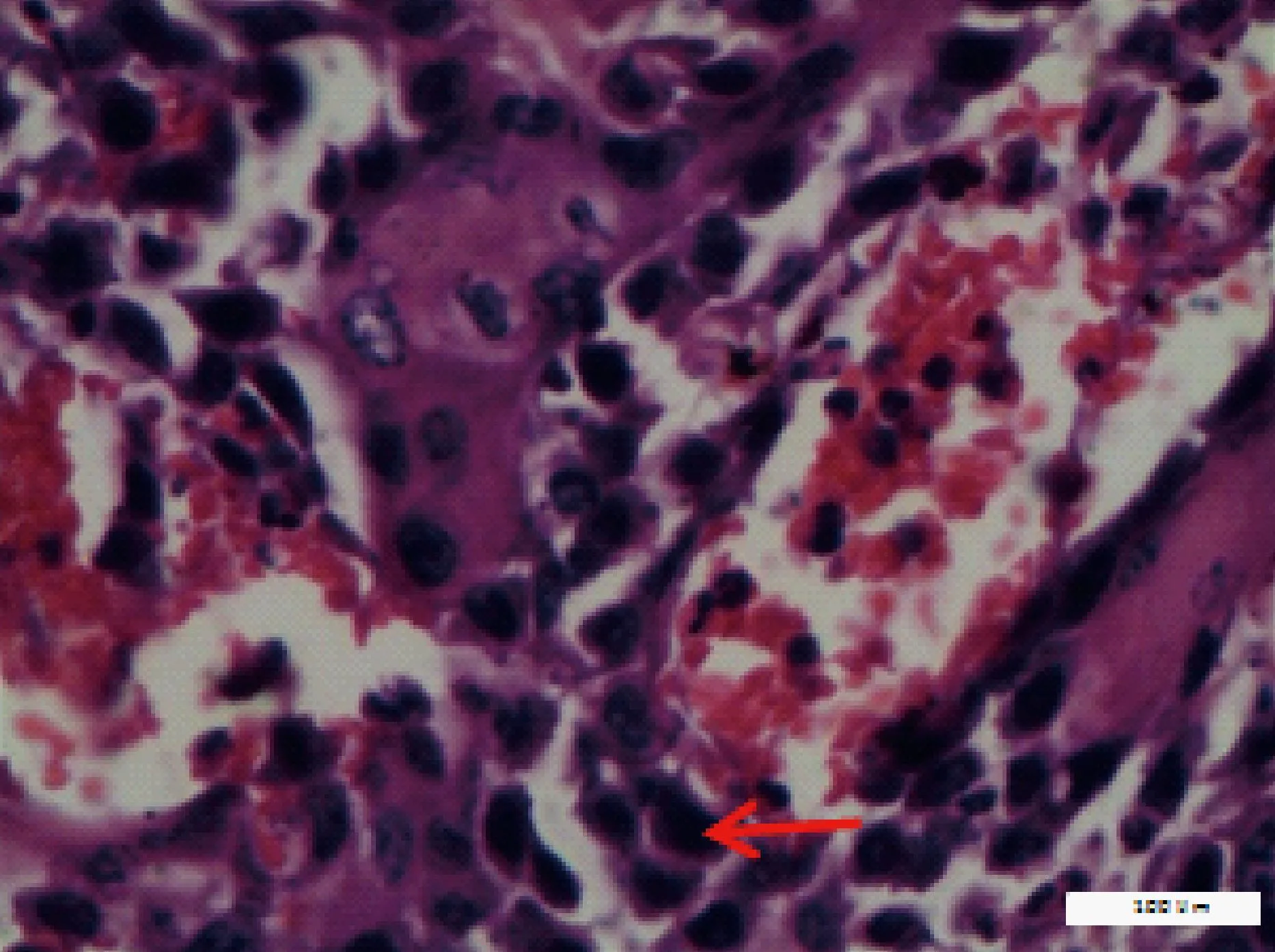
图3 非典型角质形成细胞增生,细胞核大小不等,染色质丰富(HE,×400,标尺=100 μm)Fig.3 Atypical keratinocytes proliferation, cell nucleus ranging in size and rich in chromatin(Bar=100 μm)
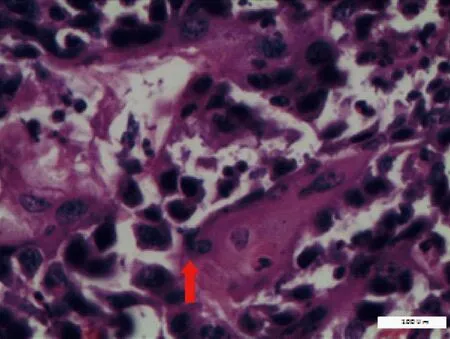
图4 瘤细胞异型性明显,有角珠形成(HE,×400,标尺=100 μm)Fig.4 Marked cytological atypia with keratin pearls(Bar=100 μm)
3讨论
皮肤是肿瘤好发部位,其发生与人们的生活方式、空气污染以及外界环境中所接触到的砷剂等化学物质等有关,目前我国恶性皮肤肿瘤的发病率呈上升趋势[2]。作为皮肤恶性肿瘤中较为常见的皮肤鳞癌,已得到越来越多学者的关注和研究。DMBA是存在于大气、空气、水、烟尘、土壤中的一种多环芳香烃,已广泛应用于国内胰腺癌、乳腺癌、颌下腺腺癌等动物模型的建立[3-5]。目前,DMBA/巴豆油作为国内构建小鼠皮肤癌的主要造模方法之一,在印度、马来西亚等国家皮肤肿瘤的研究中也得到广泛应用[6-7]。紫外线辐射能够导致DNA光损伤,从而引起基因突变、免疫抑制等一系列反应,导致皮肤鳞状细胞癌的发生和发展。王秀丽等人在应用日光模拟器模拟日光照射SKH-l无毛小鼠构建鳞癌小鼠模型的过程中发现紫外线照射能够诱导SKH-1无毛小鼠的皮肤组织增生,而且皮损严重程度随着照射剂量累积而逐渐加重[1]。Kunisada M等[8]通过研究日光导致皮肤肿瘤中最重要的成分,发现窄谱UVB更易导致皮肤癌。文献报道应用DMBA/巴豆油单独构建皮肤鳞癌模型需要24周的时间[9]。单独用NB-UVB作为光源,每周照射5次,构建模型也需要28周的时间[10],应用日光模拟器造模到20周时成瘤率为39.3%,鳞癌发生率为60%[1]。本模型在早期采用DMBA外涂,促癌期使用巴豆油以及窄谱UVB共同作用,20周荷瘤率达到了94.12%,鳞癌发生率达到了70.59%,成功的缩短了造模周期。尽管A、C两组小鼠荷瘤率无明显差异,但组织病理学显示A组诱发的鳞癌数与C组相比有差异显著性,P<0.05,这可能与DMBA、巴豆油和窄谱UVB的联合作用有关,即与物理、化学因素的协同作用机制有关。这与皮肤鳞癌高危人群所接触到的致病因素,如长期、高强度照射紫外光,DMBA、砷剂等环境污染因素共同作用的机制相似。这提示我们在预防皮肤鳞癌的过程中,要尽量避免长期、高强度的暴露于紫外光下,尤其是起重要作用的窄谱UVB,同时还要防止和减少促癌因素,如环境中存在的DMBA、巴豆油等致癌剂。
本次试验通过比较DMBA/巴豆油二阶段法、紫外光、NB-UVB等常见的构建皮肤肿瘤模型的方法,发现DMBA/巴豆油二阶法联合NB-UVB构建皮肤鳞癌模型的优越性,为进一步研究人类皮肤鳞状细胞癌的发生机制、发展规律、防治措施提供了更好的模型构建方法。
参考文献:
[1]吕婷, 王秀丽, 周文江, 等. 紫外线所致皮肤鳞状细胞癌小鼠模型的建立 [J]. 中华皮肤科杂志, 2011, 44(3): 174-177.
[2]张淑娟, 刘宁, 代晓明, 等. 皮肤鳞癌动物模型构建 [J]. 昆明医学院学报, 2009, S2: 75-79.
[3]Zhao JA, Chen JJ, Ju YC, et al.The effect of childbirth on carcinogenesis of DMBA-induced breast cancer in female SD rats [J]. 癌症, 2011, 11: 779-785.
[4]李静蔚, 宋爱莉, 刘晓菲.DMBA诱导大鼠乳腺癌癌前病变动物模型研究概况 [J]. 中华肿瘤防治杂志, 2009, 03: 234-237.
[5]陈玲, 武和明, 万飞. 二甲基苯丙蒽诱发大鼠颌下腺腺癌的实验研究 [J]. 口腔医学研究,2009, 03: 267-270.
[6]Subramanian V, Vellaichamy E.Atrial natriuretic peptide (ANP) inhibits DMBA/croton oil induced skin tumor growth by modulating NF-κB, MMPs, and infiltrating mast cells in swiss albino mice. Eur J Pharmacol. 2014, 740: 388-397.
[7]Roslida A, Fezah O, Yeong LT.Suppression of DMBA/croton oil-induced mouse skin tumor promotion by Ardisia Crispa root hexane extract [J]. Asian Pac J Cancer Prev. 2011, 12(3): 665-669.
[8]Kunisada M1, Kumimoto H, Ishizaki K, et al. Narrow-band UVB induces more carcinogenic skin tumors than broad-band UVB through the formation of cyclobutane pyrimidine dimer [J]. J Invest Dermatol. 2007, 127(12):2865-2871.
[9]Bhattacharyya SS, Paul S, Dutta S, et al. 东莨菪亭(7-羟基-6-甲氧基香豆素)对7,12-二甲基苯并蒽诱导的皮肤乳头状瘤小鼠相关关键信号蛋白的影响 [J]. 中西医结合学报. 2010, 08(07): 645-654.
[10]Aoi J, Endo M, Kadomatsu T, et al. Angiopoietin-like protein 2 is an important facilitator of inflammatory carcinogenesis and metastasis [J]. Cancer Res. 2011, 71(24): 7502-7512.
〔修回日期〕2015-12-25
Establishment of a mouse model of cutaneous squamous cell carcinoma induced by 7,12-DMBA, croton oil and narrow-band ultraviolet B irradiation
LV Chao1, LIU Bao-guo2, ZHENG hai-ping2, LIU Qing2, LI Zhi-feng2, GU Jing1, ZHOU Meng1
(1. Postgraduate Department of Chengde Medical College, Chengde 067000, China;2. Affiliated Hospital of Hebei University of Engineering,Handan, Hebei 056000)
【Abstract】ObjectiveTo establish a mouse model of cutaneous squamous cell carcinoma induced by 7,12-dimethylbenz(a)anthracene (7,12-DMBA)/croton oil and narrow-band ultraviolet B (NB-UVB) irradiation. Methods A total of fifty 6-8-week old BALB/c mice (male:female 1:1) were randomly divided into three experimental groups. The group A was treated with chemical carcinogens alone, group B was treated with NB-UVB alone, and group C was treated with chemical carcinogens plus NB-UVB. The general status and skin appearance of mice were observed during the experiment.The survival rate and tumor formation rate of each group was calculated at weeks 5, 10, 15, and 20. Pathological examination was carried out to observe the histological changes of skin lesions. ResultsPapules measuring ≥l mm in diameter began to develop in some mice of the group C at 5 weeks after the first treatment with chemical carcinogens. The tumor formation rates at 20 weeks after treatment were 86.67%, 7.14%, 94.12% in the groups A, B, C, respectively. Pathological examination revealed characteristic changes of squamous cell carcinoma in 13.34%, 0%, 70.59% of the mice in the group A, B, C, respectively. ConclusionsEstablishment of a mouse model of cutaneous squamous cell carcinoma induced by 7,12-DMBA/croton oil and NB-UVB is a better method than treated with chemical carcinogens alone or NB-UVB alone. This method can increase the tumor formation rate and incidence rate of SCC, and within a shorter period.
【Key words】Squamous cell carcinoma; 7,12-dimethylbenz(a)anthracene, 7,12-DMBA; Croton oil; Narrow-band ultraviolet B irradiation; Mouse models
doi:10.3969.j.issn.1671-7856. 2016.02.011
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016) 02-0051-04
[作者简介]吕超(1989-),女,研究方向:光与皮肤病研究。E-mail: nokky1@163.com。[通讯作者]刘保国(1966-),男,研究方向:光与皮肤病研究。E-mail: lbg66@163.com。
[基金项目]河北省卫计委2015年度医学科学研究重点课题(编号:20150074);河北省政府资助临床医学优秀人才培养项目(编号:361037)。

