例谈如何巧解与硝酸相关的计算题
安徽 汤 伟(特级教师) 张茹英
例谈如何巧解与硝酸相关的计算题
安徽 汤 伟(特级教师) 张茹英
硝酸属于化工生产中常见的三大强酸之一,也是中学化学中重点学习的强酸之一。其中涉及硝酸的相关计算问题,一直是众多学生学习化学的一个难点,下面我们通过建模思想并借助典型试题,引导学生分析硝酸涉及相关的氧化还原反应问题时的一些经典的计算和思维模式,特别是电子守恒法、元素守恒法的具体应用。通过建模思想,借助具体的思维模型,帮助大家巧解硝酸的相关计算问题。
一、建立固定的思维网络模型
一般情况下,硝酸与金属或含有金属元素的物质发生氧化还原反应时,我们要具体分析在该反应过程中硝酸所体现的具体性质,其具体模型如下:

二、建立“守恒”模型思想的模型
1.原子守恒法
HNO3与金属反应时,一部分HNO3起酸的作用,以NO-3的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
2.电子守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
3.电荷守恒法
HNO3过量时反应后溶液中(不考虑OH-)则有:
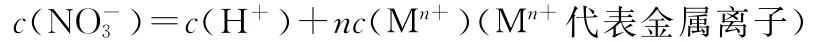
4.离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO-3在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先判断过量物,然后根据完全反应的物质,如金属、H+、NO-3进行相关计算,且溶液中要符合电荷守恒。
三、经典例题探析
例题1 1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1 B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL
【解析】通过上述建模思想,我们可以充分利用守恒思想来解决该问题。
A项,向反应后溶液中加入NaOH,生成Mg(OH)2和Cu(OH)2沉淀,固体质量增加的是OH-的质量,且有n(OH-)=n(e-),设合金中镁、铜的物质的量分别为x、y,则有

【答案】D
例题2 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO2-4)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为( )
A.9.0B.13.5
C.15.7D.16.8
【解析】该试题同样可以采用上述建模思想,借助守恒思维解答该试题。
首先我们针对该试题,采用极端假设。若混合物全是CuS,其物质的量为电子转移数0.15×(6+2)=1.2mol,混合气体中NO与NO2体积相等,设NO为x mol,NO2为x mol,3x+x=1.2,计算得x=0.3,气体体积V=0.6mol×22.4L·mol-1=13.44L。
若混合物全是Cu2S,其物质的量为0.075mol,转移电子数0.075×10=0.75mol,3x+x=0.75,计算得x=0.187 5,气体体积V=0.375mol×22.4L·mol-1=8.4L,因此8.4L<V<13.44L,故A项正确。
【答案】A
例题3 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol·L-1和2mol·L-1,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)( )
A.0.448LB.0.672L
C.0.896L D.0.224L
【解析】根据上述建模思维,我们可以通过离子方程式计算,3Fe+8H++===3Fe2++2NO↑+4H2O(铁过量,产物为Fe2+),反应中Fe和H+过量,生成的NO的量以NO3-为准来计算,共得NO为0.448L,若只考虑到这一步反应,会误选A项。但过量的铁还可以和溶液中过量的H+反应产生H2,即有Fe+2H+===Fe2++H2↑,生成的H2为0.224L,所以气体体积共计0.672L,应选B。
【答案】B
【跟踪训练】
在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12L,则反应消耗HNO3的物质的量为( )
A.0.8mol B.0.6mol
C.0.11mol D.无法计算
【答案与提示】根据上面提供的建模,可以得出:
①被还原的硝酸物质的量即为气体NO2与NO物质的量的总和,
②未被还原的HNO3的物质的量等于Cu(NO3)2中的物质的量,所以n[Cu(NO3)2]=0.03mol。
③消耗的HNO3的物质的量为0.03mol×2+0.05mol=0.11mol。故C项正确。
(作者单位:安徽省灵璧中学)
孙悟空是怎么炼成的?(二)
玄机3:为何孙悟空可以在八卦炉中练就火眼金睛?
原来二氧化硅在高温下会发生玻璃化,变成透明的晶体,因此两眼通透,具备了类似照妖镜的作用,可以看穿世界万物的本质,神奇吧!
玄机4:为何八卦炉最后会爆炸,以及为何孙悟空从八卦炉中跑出来会脾气暴躁?
那么八卦炉又为什么会坏掉呢?原来孙悟空的组成远非二氧化硅那么简单,还有一部分碳酸钙,在八卦炉1200℃作用下,碳酸钙就会分解为生石灰和二氧化碳。大量二氧化碳聚集,就会使八卦炉内气压剧烈增大,从而发生爆炸。而生石灰具有很强的腐蚀性,是一种很火爆的物质,所以使得孙悟空脾气暴躁。
玄机5:为何孙悟空跟随唐僧后会变得脾气温顺呢?
原来孙悟空被困在五行山下五百年,受到风吹雨打,生石灰和水反应生成了熟石灰,熟石灰比生石灰温顺得多了。
玄机6:为何孙悟空可以得道成佛,修炼金刚不坏之身?
孙悟空和唐三藏历经九九八十一难,千辛万苦,历时十几年取得真经。这个过程中熟石灰会与空气中的二氧化碳反应生成坚硬的碳酸钙,从而重新练就了金刚不坏之身。(看来吴承恩也是一个化学高手啊!)
(摘自网络,有删改)

