把握解题策略 突破陌生方程式书写
湖北 文丽娟 杨恩健
把握解题策略 突破陌生方程式书写
湖北 文丽娟 杨恩健
陌生方程式的书写是近年高考题中的一个重点和难点,这类题目对考查学生对中学化学基础知识的融会贯通及接受、吸收、整合化学信息的能力。是令大多数学生头疼的问题且失分较多的一类题型。若能对解决此类问题进行系统归纳总结,学生在高考复习时有意按照此方法训练,对提高此类型题目的得分有很大的帮助。
高考试题的命题源于教材却高于教材,命题往往不会单独考查陌生方程式的题目,而是将陌生方程式的题目融合在工业流程图题或实验题中,本文将从以下几种常见陌生方程式的书写方法上进行介绍:
一、复分解反应类陌生方程式的书写
【例1】(2015新课标Ⅰ,27节选)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
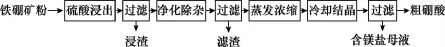
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式:______________________________________________________。
【答案】Mg2B2O5·H2O+2H2SO42MgSO4+ 2H3BO3
【解析】该陌生方程式可以仿照碱式碳酸盐和酸的反应,但是要先分析Mg2B2O5·H2O中硼元素的化合价为+3价,联系流程图最终产物可推知,硼元素变成H3BO3(H3BO3为弱酸,易溶于水),这不是氧化还原反应故镁元素转化为硫酸镁。
【例2】(2015浙江,27节选)化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。请推测并回答:
(2)甲与AlCl3反应得到NaAlH4的化学方程式:_____
________________________________________。
【答案】4NaH+AlCl3===NaAlH4+3NaCl
【解析】先由题目推出甲为NaH,根据原子守恒,NaH与AlCl3反应还生成NaCl,先写出反应物、生成物、最后配平即可。
【解题策略】主要利用原子守恒和元素化合物的基础知识。
二、氧化还原反应类陌生方程式的书写
这类题型通常有从题目所给信息中直接书写型,从工业流程图获取信息型。
【例3】(2015新课标Ⅰ,36节选)氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
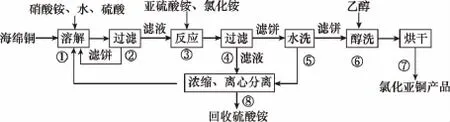
回答下列问题:
(2)写出步骤③中主要反应的离子方程式:__________。
【答案】
【解析】步骤③反应后过滤,说明反应中有CuCl沉淀产生,结合硫酸铵的回收。
第一步,先确定氧化剂为Cu2+,还原剂为,在一般氧化还原反应中被氧化为,Cu2+被还原为Cu+,又由于Cu+与Cl-不共存,因此会结合生成CuCl。
第二步,再根据得失电子相等,配平氧化剂Cu2+、还原剂、氧化产物与还原产物
第三步,再根据质量守恒、电荷守恒及所给介质环境补充Cl-和H+和补齐其对应的系数。
【例4】(2015重庆,9节选)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为________。
【答案】4H++===Cl-+4ClO2↑+2H2O
【解析】在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,再根据化合价升降相等和电荷守恒以及原子守恒配平方程式,该反应的离子方程式为4H++=== Cl-+4ClO2↑+2H2O;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成。
【解题策略】①首先根据材料中信息提炼题目所给信息,写出部分反应物与生成物化学式。
②分析元素化合价的变化得出氧化剂、还原剂、氧化产物和还原产物(不属于“氧化剂”“还原剂”“氧化产物”“还原产物”的这一步暂时不写)。
③利用得失电子相等配平氧化剂、还原剂、氧化产物与还原产物的系数。
④再根据质量守恒、电荷守恒及所给介质环境配平方程式。
注意:所给环境通常指比如在书写反应物中没有出现酸或碱时,不要在等号左边写H+或OH-,但可以根据质量守恒和电荷守恒的需要在等号右边写H+或OH-。在酸性环境下的离子反应最后可以用H2O和H+来成配平方程式,在碱性环境下最后可以用H2O和OH-来配平方程式。
三、电极反应方程式类陌生方程式的书写
【例5】(2015新课标Ⅱ,26节选)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,回答下列问题:
(1)该电池的正极反应式为_________________,电池反应的离子方程式为____________。
【答案】MnO2+e-+H+===MnOOH Zn+2MnO2+2H+===Zn2++2MnOOH
【解析】酸性锌锰干电池是一种一次电池,外壳为金属锌,锌是活泼金属,锌是负极,电解质溶液为酸性,则负极电极反应方程式为Zn—2e-===Zn2+。中间是碳棒,碳棒是正极,其中二氧化锰得到电子转化为MnOOH,则正极电极反应方程式为MnO2+e-+H+===MnOOH,所以电池总反应式为Zn+2MnO2+2H+===Zn2++2MnOOH。
【例6】(2015广东,32节选)七铝十二钙(12CaO· 7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

【答案】
【解析】根据题意,充电和放电时和两种离子在Al电极上相互转化,放电时负极Al失去电子变为Al3+,与溶液中的AlCl4-结合,发生反应产生,电极反应式为
【解题策略】①根据元素化合价的升降判断氧化剂、还原剂、氧化产物、还原产物。
②原电池负极或电解池阳极的电极反应方程式,按照“还原剂-ne-===氧化产物”来书写;原电池正极或电解池阴极的电极反应方程式,按照“氧化剂+ne-===还原产物”来书写。
③再根据原子守恒和电荷守恒补充该有的微粒,配平电极反应方程式。
四、有机反应类陌生方程式的书写
【例7】(2015四川,10节选)化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略):
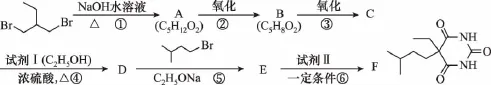

请回答下列问题:
(3)第⑤步反应的化学方程式是________。

【解题策略】①熟记各官能团的反应特点及官能团之间的转换,对照原型,直接替换。有机物种类繁多,考试中出现的看似新颖的外表,实际发生反应的还是某些特定官能团。这时,只需要将对应官能团参加反应即可,其他框架保持原型。
②对于多种官能团的化合物,要仔细观察细节,抓住问题本质,例如酯基的水解就需要辨别是醇酯还是酚酯、反应的条件、缩聚反应生成小分子的个数等。
③信息处理能力的考查也是一热点,某些有机反应考试时以提供新信息的形式,给出某个新的反应原理,然后要求学生现学现用。这时学生应冷静思考对比题给信息与设问信息,找出关键点,如成键、断键位置,参考反应条件做突破口等信息进行模仿,合理迁移推写出新的生成物结构。
④有些有机反应在中学阶段并未涉及,题目信息也未明确指出时,只给出主要反应物和生成物,解题时不必纠结探究其反应原理,淡化原理,按照信息写出反应物和生成物,根据原子守恒推出其他产物。
无论是熟悉的方程式还是陌生方程式,有机反应还是无机反应方程式的书写,都是建立在元素化合物和官能团的知识上,因此打好元素化合物知识和有机反应知识的基础是我们解决陌生方程式的一个必要条件。然后再按照上面提供的解题策略,采用类比、迁移、推理等方法将所学知识融会贯通,平时加以训练,方能在高考中快速解决此类问题。
(作者单位:湖北省襄阳市一中 湖北省襄阳市四中)

