猪圆环病毒2型LAMP可视化快速检测方法的研究
胡瑞丽,倪建平,赵 笑,赵 庆,史 斌,赵桓震,赵斌安,赵 凯
(1上海师范大学,上海200234;2上海市农业科学院生物技术研究所,上海201106;3上海佳牧生物制品有限公司,上海201106;4宁夏大学,银川750021;5上海斯高勒生物科技有限公司,上海200233;6上海珺珏生物科技有限公司,上海201501;7上海博满生物科技有限公司,上海201106;8上海市农业遗传育种重点实验室,上海201106)
猪圆环病毒2型LAMP可视化快速检测方法的研究
胡瑞丽1,倪建平2,3*,赵 笑4,赵 庆5,史 斌5,赵桓震6,赵斌安7,赵 凯2,8**
(1上海师范大学,上海200234;2上海市农业科学院生物技术研究所,上海201106;3上海佳牧生物制品有限公司,上海201106;4宁夏大学,银川750021;5上海斯高勒生物科技有限公司,上海200233;6上海珺珏生物科技有限公司,上海201501;7上海博满生物科技有限公司,上海201106;
8上海市农业遗传育种重点实验室,上海201106)
摘 要:本研究旨在建立有效的针对猪圆环病毒2型(PCV2)的诊断技术及开发试剂盒。采用环介导等温扩增方法(LAMP)检测猪圆环病毒2型(PCV2),对PCV2的ORF2基因设计出3对特异性引物,扩增PCV2基因的最佳温度和时间优化到59℃孵育55 min。用该方法对临床样品进行检测,LAMP检测对PCV2的检测限为10拷贝/μL,而常规PCR检测法的检测限为1 000拷贝/μL,表明LAMP检测法灵敏度高。该检测法不会与猪圆环病毒Ⅰ型、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒、传染性胃肠炎的猪病毒和轮状病毒发生交叉反应。用建立起的LAMP检测法对1 100个临床样品进行检测,950个样品被检测出为阳性样品。稳定性试验表明该试剂盒可以耐受至少40次的反复冻融。结果显示,该方法建立的猪圆环病毒2型诊断方法灵敏度高,特异性强,稳定性好。
关键词:猪圆环病毒2型;环介导等温扩增;检测;诊断试剂盒
**通信作者,E-mail:kzhao118@163" com
断奶仔猪多系统衰竭综合症(Post-weaning multisystemic wasting syndrome,PMWS)是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)引起的一种重要疾病,严重发病地区死亡率高达40%以上,残存下来的病猪也极少康复。由于PCV2严重破坏猪的免疫系统,导致各种疫苗接种应答效果差,免疫失败,并且诱发其他疾病暴发[1-3],例如,PCV2还与猪的传染性先天性震颤、肉芽肿性肠炎、皮炎与肾病综合征、猪呼吸综合征、猪繁殖障碍、渗出性表皮炎和坏死性淋巴结炎等疾病有相关性[4];因此,PCV2感染的早期诊断成为PMWS防治的新的策略,有必要开发出一种猪PCV2的定性、定量快速检测方法用于PMWS的防控。
目前,PCV2的诊断主要依靠免疫学检测技术和分子生物学检测技术。由于免疫学技术自身敏感性和特异性较差,因此分子生物学检测技术得到了迅速的发展。1)PCR技术是一种常规的分子生物学检测技术,其中常规PCR方法是常用的[5],然而,在用PCR对生物样品进行检测分析中,由于存在PCR抑制剂,这使PCR的有效性受到了抑制[6-7];2)ELISA检测:由于抗原抗体反应的专一性,每种基因产品都要开发和建立专门的检测试剂和方法,要建立所有基因产品的蛋白质检测法工作量很大[8-9];3)基因芯片检测不仅需要昂贵的芯片制作系统,操作复杂、费时,对操作人员的专业素质要求比较高,容易造成样品污染。此外,实时定量PCR是定性和定量分析PCV2[10-13]较好的检测方法,然而,这种检测方法对实验人员的要求很高而且需要昂贵的专业仪器;因此,快速、灵敏并且易于操作的现场检测PCV2方法成为兽医临床的迫切需求。
环介导等温扩增方法(Loop-mediated isothermal amplification,LAMP)是Notomi等[14]发明的一种新型的等温核酸扩增技术。它具有快速高效、灵敏度高、特异性强、操作简便、无需昂贵的扩增设备、结果鉴定直观等特点,非常适合临床检测和大规模检疫工作。环介导等温扩增较其他核酸扩增方法具有特异性,选择性,快速的特点[15]。通过使用前部环形引物[16]改进环介导等温扩增方法,该方法在医院实验室中快速诊断和在食源性病原微生物[17]的快速检测中是较效的工具。已有报道Chen等[18]使用环介导等温扩增方法来检测猪圆环病毒2型。在他们的研究中,只有4个引物且没有添加甜菜碱。本研究中,包含1对环形引物在内的6个引物对PCV2的不同区域进行扩增,补充和扩展了以前的PCV2 LAMP检测方法;本研究的目的是用于PCV2的LAMP检测,方法要具有高特异性,高灵敏度,快速且简单易行的特点。
1 材料与方法
1.1 病毒来源
猪圆环病毒2型(PCV2)、猪圆环病毒Ⅰ型(PCV1)、猪细小毒病毒(PPV)、伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、轮状病毒(RV)、猪传染性胃肠炎病毒(TGEV)及猪繁殖与呼吸综合征病毒(PRRSV)毒株均由上海市农业科学院畜牧兽医研究所提供,所有的这些毒株用于LAMP检测。
1.2 引物
基于PCV2(BJ0804株)ORF2基因(GenBank登录号:EU921257" 1),按照环介导等温扩增引物设计说明书PrimerExplorer V3,利用网页软件(http://primerexplorer" jp/elamp3" 0" 0/index" html)设计出6个LAMP引物,分别是FIP、BIP、F3、B3,此外还添加了1对环形引物LF和LB。其中的引物F3和B3还可以用于常规PCR反应中,其靶序列长度为233 bp。设计的引物如表1。
1.3 主要试剂
Bst DNA PoLymerase、MgSO4为纽英伦(NEB)生物技术(北京)有限公司产品,Betaine(B2629)为Sigma公司产品,SYBR GreenⅠ为晶美生物工程有限公司产品。
1.4 病毒核酸的提取及鉴定
利用天根生化科技(北京)有限公司的DNA/RNA病毒基因组提取试剂盒(离心柱法)对DNA和RNA病毒基因组进行了提取和纯化。最后加入20—35 μL DEPC水到吸附柱中,12 000 r/min离心1 min。将纯化得到的DNA/RNA保存在-20℃。纯化得到的RNA进行反转录。在20 μL反转录体系加入Template RNA(poly(A)+RNA)、5×1st Strand Synthesis Buffer、dNTP Mixture、RNase Inhibitor、Oligo(dT)18或Random Primer、Reverse Transcriptase(M-MLV)(200 U/μL)和RNase-free H2O,室温放置10 min后,放至42℃恒温水浴锅内反应1 h,反应结束后置于冰中冷却2 min。
1.5 病毒标准阳性质粒模板的制备
以猪圆环病毒2型BJ0804株为标准模板,F3和B3为上下游引物,按照PCR体系进行扩增,PCR反应体系为25 μL体积包含:ddH2O 16" 5 μL,10×PCR buffer 2" 5 μL,dNTP 2" 0 μL,F3 1" 0 μL,B3 1" 0 μL,Taq ploymerase(Takara Corp")1" 0 μL,1" 0 μL提取的DNA。反应程序:95℃预变性5 min,进入PCR反应循环:95℃变性30 s,55℃退火30 s,72℃延伸30 s,共进行35个循环,最后72℃总延伸5 min。
PCR产物的回收与纯化按照Omega公司E" Z" N" A" GelExtractionKit说明书进行。回收产物与载体连接反应参照pMD18-T vector的使用说明进行。连接产物转化感受态细胞。采用菌落PCR法筛选阳性重组质粒。参照3S Spin Plasmid Miniprep Kit V3" 1的说明书小量制备质粒,并测其浓度,按照病毒学方法计算对应的拷贝数浓度,-20℃保存备用。
1.6 PCV2 LAMP检测方法的建立
根据引物Tm值,对LAMP反应温度(55—60℃)进行优化,从多次重复试验中确定最佳退火温度。反应时间按30 min、45 min、60 min、90 min、120 min优化,多次重复试验确定最佳反应时间。
据反应体系优化策略,对MgSO4、Betaine、Bst DNA PoLymerase、dNTP、3对引物等成分分别进行了优化。MgSO4(100 nmol/μL)的体积按0"6 μL、0"8 μL、1"0 μL、1" 2 μL依次递增。Betaine(5 μmol/μL)的体积按3 μL、4 μL、5 μL、6 μL依次递增。Bst DNA PoLymerase(8 U/μL)体积按0"6 μL、0"8 μL、1"0 μL、1"2 μL依次递增。dNTP(25 mmol/μL)体积按3 μL、4 μL、5 μL、6 μL依次递增。3对引物(FIP/BIP∶F3/B3∶LF/LB)按1∶2∶2、1∶4∶4、2∶1∶2、1∶1∶2、4∶1∶4、4∶2∶1、4∶4∶1通过正交试验进行优化,确定最佳反应体系。
1.7 PCV2 LAMP可视化试验
LAMP反应结束后,加入1 μL荧光染料SYBR Green I荧光染料,观察阴性和阳性反应体系颜色的变化情况。
1.8 LAMP检测猪圆环病毒2型灵敏度的试验
取猪圆环病毒2型质粒倍比稀释,采用优化的反应体系和反应条件,检测所建立LAMP方法的灵敏度,可视化观察反应情况:反应结束后,加入1 μL荧光染料SYBR Green I,观察阴性和阳性反应体系颜色的变化情况。
1.9 LAMP检测猪圆环病毒2型特异性试验
检测猪圆环病毒2型特异性试验分别以CSFV病毒、PRRSV病毒、PRV病毒作为样品,同时设立阴性对照,采用上面优化的反应体系和反应条件,检测所建立LAMP方法的特异性。
1.10 LAMP检测猪圆环病毒2型稳定性试验
将上述试剂盒贮存于-20℃,在该温度和室温下反复冻融10次、20次、30次和40次后,观察结果。
1.11 PCV2 LAMP可视化快速检测试剂盒的应用
委托上海博满生物科技有限公司、上海斯高勒生物科技有限公司、上海珺珏生物科技有限公司在江苏省、浙江省、上海市畜牧养殖场进行了推广应用。
2 结果与分析
2.1 ORF2基因的PCR扩增
PCR扩增产物经1%琼脂糖凝胶电泳分析表明,扩增出了与ORF2相应的约223 bp大小的特异片段,与预期结果相符。
2.2 重组质粒的筛选
PCR扩增产物经回收纯化后,与克隆载体pMD18-2T连接转化,然后挑取单个的菌落做扩大培养,以扩大培养的菌液为模板,F3和B3为引物分别做菌液PCR鉴定,扩增出约为223 bp大小的特异性条带,结果和预期扩增的片段大小相符。
2.3 优化的LAMP反应体系和反应条件
经过对LAMP反应时间和反应温度分别进行调整,反应条件为59℃45 min。
利用上述优化出的最佳反应温度和反应时间先对MgSO4、Betaine、Bst DNA PoLymerase、dNTP成分进行优化,确定最佳反应体系为MgSO41" 2 μL、Betaine 4" 0 μL、Bst DNA PoLymerase 1" 0 μL、dNTP 3" 0 μL。最后用优化好的体系和反应温度,反应时间对引物进行优化,确定出最佳引物比例组合FIP/BIP∶F3/B3∶LF/LB为4∶1∶4。
2.4 PCV2 LAMP反应可视化结果的判定
反应结束后,加入1 μL SYBR GreenⅠ荧光染料,阳性反应管颜色变为绿色,阴性反应管不发生颜色变化,为橘红色,由此可见LAMP反应结果易判定(图1),易于临床推广。
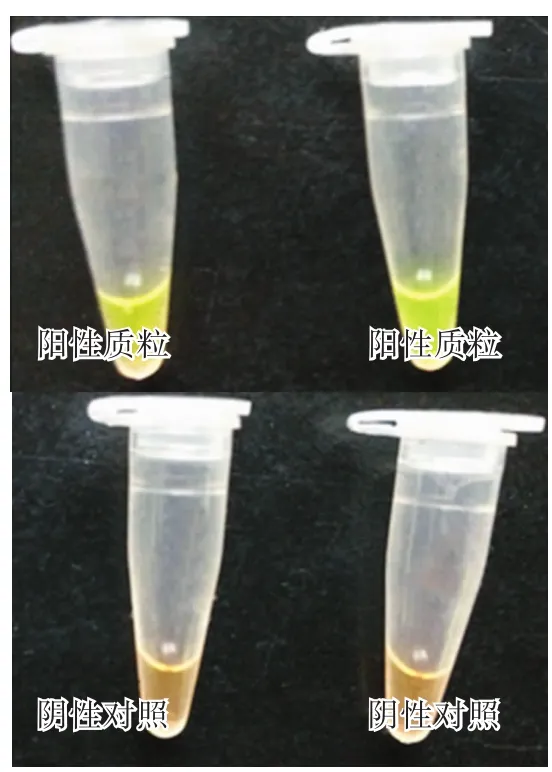
图1 PCV2 LAMP反应可视化结果Fig.1 Visual result of LAMP reaction for detection of PCV2
2.5 LAMP反应的灵敏度
对PCV2质粒按10倍梯度稀释成以下6组浓度的样品(拷贝/μL):100,101,102,103,104,105,106。进行3次重复性试验,结果在101—106拷贝样品均有明显绿色,最低DNA浓度为PCV2质粒101拷贝,即建立的PCV2的LAMP检测下限为101拷贝。该方法能在1 h内报告样品的检测结果。PCV2的LAMP检测方法灵敏度检测结果图2。
2.6 LAMP特异性试验
PCV2的LAMP检测方法特异性检测结果见图3。所有供试PCV2样品和阳性对照中颜色反应均为绿色,而在CSFV、PRRSV、PRV样品中颜色反应均为橘色,说明引物特异于PCV2样品检测。该方法能在1 h内报告样品的检测结果。
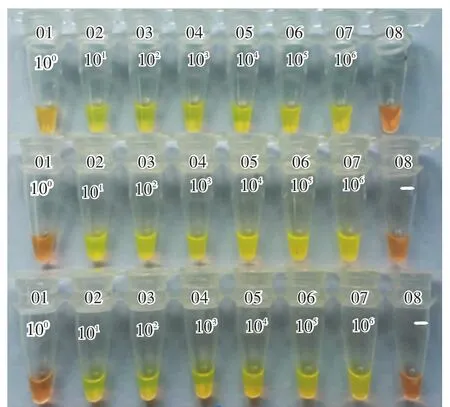
注:3次重复性试验;01—07:梯度稀释的PCV2 DNA质粒1拷贝/μL,101拷贝/μL,102拷贝/μL,103拷贝/μL,104拷贝/μL,105拷贝/μL和106拷贝/μL;08:阴性对照图2 PCV2 LAMP检测法灵敏度Fig.2 Sensitiveness of LAMP detection of PCV2

注:3次重复性试验;第1列:PCV2质粒;第2列:PCV2病毒样品;第3列:CSFV病毒样品;第4列:PRRSV病毒样品;第5列:PRV病毒样品;第6列:阴性对照图3 PCV2基因LAMP法检测的特异性Fig.3 Specificity of LAMP reaction for detection of PCV2 gene
2.7 LAMP稳定性试验
该试剂盒可以耐受至少40次的反复冻融,拥有较好的稳定性。
2.8 猪圆环病毒2型临床样品检测
用该LAMP试剂盒检测1 100个血清样品,看是否感染PCV2。结果检出其中有950个临床样品感染PCV2。
3 结论与讨论
目前已有关于PCV2 LAMP检测方法的报道,何逸民等[19]、史利军等[20]均做了PCV2的LAMP检测方法的研究。成熟的LAMP检测法对PCV2检测是特异性的,其他的病毒没有扩增产物。根据PCR和LAMP引物设计的结果得知PCV2的ORF2基因具有较高的特异性。LAMP检测法对靶序列具有高特异性是因为在起始阶段,6个独立序列(F1c,F2,F3,B1c,B2和B3)能识别靶序列[21],之前显示4个独立序列(F1c,F2,B1c和B2)在稍后阶段扩增靶序列,而常规PCR检测法只有1对引物去识别靶序列。与之前的研究最大的不同在于本研究中加入了1对环形引物,可使反应速度提高1/3到1/2。
优化后的PCV2 LAMP检测方法的检测限为10个拷贝,比常规的PCR检测方法灵敏很多。LAMP检测的灵敏度与之前报道的检测其他病毒的灵敏度是一样的,例如猪传染性胃肠炎冠状病毒,H5禽流感病毒,黄头病毒[22-24]。当LAMP检测开始时,需要一些措施来防止假阳性的出现。尽管LAMP检测方法对检测PCV2临床样品是一个有效的方法,但是在LAMP检测方法中实验室污染是一个容易出现的问题。对于临床样品检测,DNA提取步骤可以省略,血清样品也可直接用于LAMP反应中。与常规PCR检测法相比,LAMP检测法的灵敏度受到临床样品中的各种物质影响较小。在LAMP检测法中,这减少了时间、降低了试验成本并简化了很多繁琐的步骤。最重要的是LAMP检测法对各种物质的超强耐受性使得该方法在小型医院,实验室,私人诊所和养殖场普及成为可能。
在基于LAMP技术的猪PCV2现场可视化定性快速检测方法中,优化之后的LAMP检测法能对PCV2进行可视化、现场快速检测。与常规的PCR检测方法相比,LAMP检测法具有省时、低成本和易于操作等优点。与他人建立的PCV2 LAMP检测方法相比,LAMP反应体系中添加了甜菜碱,可以加快解链速度。在引物中增加了环形引物,可使LAMP反应时间减少一半。另外,不用提取样品中的PCV2病毒DNA,可直接将猪血清作为模板进行LAMP反应,因为LAMP检测法对生物样品的耐受性要优于其他检测方法,故在LAMP中可以省去DNA提取步骤[25]。仪器设备简单,只需1台水浴锅,两把移液器、1台掌式离心机、1台漩涡振荡器,不需要PCR仪、电泳仪和凝胶成像仪,养殖户只需花费1000多元钱就可以添置进行LAMP操作的所有设备,耗材便宜,不需提取样品中的PCV2病毒DNA,直接将猪血清作为模板进行LAMP反应,避免了DNA抽提试剂盒的使用,降低了成本;易于操作,一般人员只需稍加训练就可操作,所需时间少,于1 h内就可完成试验。因此养殖户自己可以进行现场可视化快速检测PCV2。
参 考 文 献
[1]余波,冉懋韬,徐景峨,等"猪圆环病毒2型LAMP诊断方法的建立及初步应用[J]"广东农业科学,2014,41(11):163-166"
[2]Neumann E J,Dobbinson S S A,Welch E B M,et al" Descriptive summary of an outbreak of porcine post-weaning multisystemic wasting syndrome(PMWS)in New Zealand[J]" New Zeal and Veterinary Journal,2007,55:346-352"
[3]游一,许保疆,王克领,等"规模化猪场猪圆环病毒病的诊断及综合防制[J]"中国畜牧兽医,2009,36(9):152-154"
[4]Bolin S R,Stoffregen W C,Nayar G P,et al" Postweaning multisystemic wasting syndrome induced after experimental inoculation of cesareanderived,colostrum-deprived piglets with type 2 porcine circovirus[J]" J Vet Diagn Invest,2001,13:185-194"
[5]Caprioli A,McNeilly F,McNair I,et al" PCR detection of porcine circovirus type 2(PCV2)DNA in blood,tonsillar and faecal swabs from experimentally infected pigs[J]" Veterinary Science,2006,81:287-292"
[6]Wilson I G" Inhibition and facilitation of nucleic acid amplification[J]" Appl Environ Microbiol,1997,63:3741-3751"
[7]Al-soud W A,Radstrom P" Capacity of nine thermostable DNA polymerases to mediate DNA amplification in the presence of PCR inhibiting samples[J]" Appl Environ Microbiol,1998,64:3748-3753"
[8]Ishibashi K,Hanadal S,Uozumi K,et al" An enzyme-linked immunosorbent assay for immune complex of HTLV-I[J]" Journal of Immunological Methods,1988,119:217-221"
[9]Miyakawa H,Kawaguchi N,Kikuchi K,et al" False positive reaction in ELISA for IgM class anti-M2 antibody and its prevention[J]" Hepatology Research,2001,20:279-287"
[10]Lee C W,Suarez D L" Application of real-time RT-PCR for the quantitation and competitive replication study of H5 and H7 subtype avian influenza virus[J]" Journal of Virological Methods,2004,119:151-158"
[11]Brunborg I M,Moldal T,Jonassen C M" Quantitation of porcine circovirus type 2 isolated from serum/plasma and tissue samples of healthy pigs and pigs with postweaning multisystemic wasting syndrome using a TaqMan-based real-time PCR[J]" J Virol Methods,2004,122:171-178"
[12]Chung W B,Chan W H,Chaung H C,et al" Real-time PCR for quantitation of porcine reproductive and respiratory syndrome virus and porcine circovirus type 2 in naturally infected and challenged pigs[J]" J Virol Methods,2005,124:11-19"
[13]Olvera A,Sibila M,Calsamiglia M,et al" Comparison of porcine circovirus type 2 load in serum quantified by a real time PCR in postweaning multisystemic wasting syndrome and porcine dermatitis and nephropathy syndrome naturally affected pigs[J]" J Virol Methods,2004,117:75-80"
[14]Notomi T,Okayama H,Masubuchi H,et al" Loop-mediated isothermal amplification of DNA[J]" Nucleic Acid Res,2000,28:63"
[15]Mori Y,Nagamine K,Tomita N,et al" Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]" Biochem" Biophys" Res Commun,2001,289:150-154"
[16]Nagamine K,Kuzahara Y,Notomi T" Isolation of single stranded DNA from loop-mediated isothermal amplification products[J]" Biochem Biophys Res Commun,2002,290:1195-1198"
[17]Yano A,Ishimaru R,Hujikata R" Rapid and sensitive detection of heatlabile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]" J Microbiol Methods,2007,68:414-420"
[18]Chen H T,Zhang J,Sun D H,et al" Rapid detection of porcine circovirus type 2 by loop-mediated isothermal amplification[J]" Journal of Virological Methods,2008,149:264-268"
[19]何逸民,邹国秋,张得玉,等"猪圆环病毒2型环介导等温扩增(LAMP)检测方法的研究[J]"中国兽医杂志,2009,45(12):7-10"
[20]史利军,张锦秀,章金刚,等"猪圆环病毒2型LAMP检测方法的建立与评价[J]"中国兽医学报,2010,30(2):174-176"
[21]Nagamine K,Hase T,Notomi T" Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]" Mol Cell Probes,2002,16:223-229"
[22]Chen Q,Li J,Fang X E,et al" Detection of swine transmissible gastroenteritis coronavirus using loop-mediated isothermal amplification[J]" Virology Journal,2010,7:206"
[23]Imai M,Ninomiya A,Minekawa H,et al" Development of H5-RT-LAMP(loop-mediated isothermal amplification)system for rapid diagnosis of H5 avian influenza virus infection[J]" Vaccine,2006,24:6679-6682"
[24]Mekata T,Kono T,Savan R,et al" Detection of yellow head virus in shrimp by loop-mediated isothermal amplification(LAMP)[J]" Journal of Virological Methods,2006,135:151-156"
[25]Kaneko H,Kawana T,Fukushima E,et al" Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances [J]" Journal of Biochem and Biophys Methods,2007,70:499-501"
(责任编辑:程智强)
Visual rapid detection of porcine circovirus type 2 by a loop-mediated isothermal amplification assay
HU Rui-li1,NI Jian-ping2,3*,ZHAO Xiao4,ZHAO Qing5,SHI Bin5,ZHAO Huan-zhen6,ZHAO Bin-an7,ZHAO Kai2,8**(1Shanghai Normal University,Shanghai 200234,China;2Biotech Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China;3Shanghai Jiamu Biological Products Company Limited,Shanghai 201106,China;4Ningxia University,Yinchuan 750021,China;5Shanghai Scholar Biotech Company Limited,Shanghai 200233,China;6Shanghai Junjue Biotech Company Limited,Shanghai 201501,China;7Shanghai Bio-Full Biotech Company Limited,Shanghai 201106,China;8Shanghai Key Laboratory of Agricultural Genetics and Breeding,Shanghai 201106,China)
Abstract:In order to establish effective diagnostic technique and diagnostic kit for porcine circovirus type 2 (PCV2),a loop-mediated isothermal amplification(LAMP)assay was used to detect PCV2,three pairs of specific primers were designed for PCV2’s ORF2 gene,and the time and temperature conditions for amplification of PCV2 gene were optimized to be 55 min at 59℃" Testing clinical samples by this method showed that the detection limit for PCV2 was 10 copies/μL,whereas the conventional PCR detection limit was 1 000 copies/μL,indicating that the LAMP method was highly sensitive" The detection did not cross-react with PCV1,porcine reproductive and respiratory syndrome virus,porcine epidemic diarrhea virus,transmissible gastroenteritis’pig virus and rotavirus" When 1 100 samples were tested by the established LAMP method,950 samples were detected to be positive" The stability test showed that this kit could endure at least 40-time reiterative freeze-thaw" The above results indicated that thebook=24,ebook=29established method and diagnostic kit had high sensitiveness,strong specificity and good stability"
Key words:Porcine circovirus type 2;Loop-mediated isothermal amplification;Detection;Diagnostic kit
作者简介:胡瑞丽(1989—),女,在读硕士,研究方向:基因工程。E-mail:hrly524@163" com;Tel:021-62203047
基金项目:上海市闵行区重大产业化专项(2014MH076)
收稿日期:2015-12-28
文章编号:1000-3924(2016)01-023-06
中图分类号:S852" 65
文献标识码:A
*并列第一作者:倪建平(1963—),男,研究员,研究方向:畜牧兽医。E-mail:nijianping@126" com;Tel:021-37195863

