毕赤酵母异源表达β-葡聚糖酶酶学特性的研究
王苑螈,王 波,王秀英,申 强,薛 永,李大伟,彭日荷,姚泉洪*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院生物技术研究所,上海201106;3上海师范大学生命与环境科学学院,上海200234;4无锡市农业技术推广总站,无锡214023)
毕赤酵母异源表达β-葡聚糖酶酶学特性的研究
王苑螈1,2,王 波2*,王秀英2,3,申 强4,薛 永2,李大伟1,2,彭日荷2,姚泉洪2**
(1上海海洋大学食品学院,上海201306;2上海市农业科学院生物技术研究所,上海201106;3上海师范大学生命与环境科学学院,上海200234;4无锡市农业技术推广总站,无锡214023)
摘 要:根据酵母密码子的偏好性对来自某异源菌种的葡聚糖酶基因进行化学合成改造,用电转化方法整合到毕赤酵母基因组中进行表达,并对表达出的内切β-葡聚糖酶进行相关酶学特性研究。结果表明:酶的最适pH为4" 5,最适温度为40℃;酶的pH稳定性范围与缓冲溶液类型有关,为4" 0—6" 0;Al3+对酶有激活作用,但Mn2+和Cu2+则会抑制酶的活性;此酶对羧甲基纤维素钠(CMC-Na)有较强的分解能力;胃蛋白酶对该酶有抑制作用。
关键词:β-葡聚糖酶;毕赤酵母;酶学特性;DNS法
β-葡聚糖是一种自然合成多糖,在细胞壁中属于非淀粉性结构多糖,是一种由β-1,3和β-1,4糖苷键链接的D-葡萄糖聚合物[1]。β-葡聚糖酶是一类能够降解葡萄糖聚合物的酶系,大部分由微生物产生,如细菌(芽孢杆菌属)、真菌(曲霉属、毛霉属、木霉属等)和瘤胃微生物,同时也存在于谷物中[2-4]。β-葡聚糖酶属于糖基水解酶,根据其作用方式可分为内切-β-1,3-1,4-葡聚糖酶(E" C" 3" 2" 1" 73)、内切-β-1,3-葡聚糖酶(E" C" 3" 2" 1" 39)、外切-β-1,3-葡聚糖酶(E" C" 3" 2" 1" 58)和外切-β-1,4-葡聚糖酶(E" C" 3" 2" 1" 74),随机水解β-1,3或β-1,4糖苷键,生成葡萄糖和寡糖[5-6]。
植物种子可以产生β-葡聚糖酶,在萌发过程中分解胚乳细胞壁中的β-葡聚糖,解除其对营养成分的抑制作用,促进种子正常萌发[7]。β-葡聚糖酶还是一种绿色饲料添加剂,它可以降低肠胃内容物的黏度,改善单胃动物对营养物质的吸收,提高饲料利用率[8-9]。在酿造工业中,啤酒过滤、啤酒非生物沉淀等问题都可以通过添加β-葡聚糖酶得到解决[10-11]。另外,β-葡聚糖酶在植物抗真菌基因工程中也有所研究。β-葡聚糖酶广泛应用在医药、纺织、日化、废水处理等行业,前景可观[12-13]。
玉蜀黍赤霉菌无性型又称为禾谷镰刀菌,是一种植物病原体,能够引起小麦、大麦的赤霉病和玉米的穗腐病,造成农作物品质降低和产量严重减少,引起粮食问题[14]。目前国内外对来自玉蜀黍赤霉菌的葡聚糖酶研究甚少,本试验重新改造合成来自玉蜀黍赤霉菌的葡聚糖酶基因,并利用电转化法将其导入到毕赤酵母细胞中,对表达出的β-葡聚糖酶进行相关酶学特性研究。
1 材料与方法
1.1 材料与仪器
所用药品均为分析纯,购自上海生工生物工程有限公司。
电转仪购自Bio-Rad公司;多功能酶标仪购自TECAN infinite M200瑞士帝肯公司;DK-8D型电热恒温水槽购自上海医用恒温设备厂。
1.2 方法
1" 2" 1 酶促反应体系
酶促反应的基本体系为280 μL,包括70 μL粗酶液、70 μL Na2HPO4-柠檬酸缓冲(pH 5" 0)、140 μL 1%的CMC-Na(溶于100 mmol/L Na2HPO4-柠檬酸缓冲液,pH 4" 5),40℃反应60 min;反应结束后,加入等体积(280 μL)DNS试剂,100℃反应10 min显色,冷却后在550 nm下测定OD值;每组设1个空白对照和3个平行,在允许误差内数据用平均值呈现。
1" 2" 2 葡萄糖标准曲线的绘制
配制质量分数为2%的葡萄糖母液(称取2 g葡萄糖溶于100 mL蒸馏水),分别稀释成0" 01%、0" 02%、0" 04%、0" 06%、0" 08%、0" 1%、0" 12%、0" 14%8个梯度。每个梯度做1个对照和3个平行(以失活酶作为空白对照),依次加入70 μL葡萄糖溶液、70 μL粗酶液、140 μL缓冲液(Na2HPO4-柠檬酸缓冲液,pH 4"5),直接加入等体积(280 μL)DNS试剂反应显色,冷却后于550 nm下测定OD值,绘制标准曲线。
1.3 玉蜀黍赤霉菌β-1,4-葡聚糖酶纯化后的酶学特性研究
1" 3" 1 反应的最适温度和最适pH
调节恒温水浴锅,在不同温度(20℃、30℃、40℃、50℃、60℃、70℃、80℃)、pH 5" 0下反应60 min,根据DNS法测定其550 nm吸光值。
配制不同pH(2" 2、3" 0、4" 0、5" 0、6" 0、7" 0、8" 0)的Na2HPO4-柠檬酸缓冲液,用来溶解反应底物羧甲基纤维素钠(CMC-Na),于最适温度(40℃)下反应。
1" 3" 2 热稳定性的研究
将酶液分为7组,分别于20℃、30℃、40℃、50℃、60℃、70℃和80℃预处理60 min;每隔10 min取样一次,置于4℃冰箱中,待样品完全处理后加入CMC-Na于最适条件下(40℃,pH 4" 5)进行酶活反应,以未处理组(0 min,40℃)活力值为100。
1" 3" 3 pH稳定性的研究
将酶液与不同pH的缓冲液混合,于4℃条件下放置24 h,取出后进行正常的酶活反应;对照组则不经过低温、缓冲液处理,直接于不同pH下反应。
1" 3" 4 不同金属离子对酶活力的影响
分别配置不同浓度的金属离子(Na+、Al3+、Li+、Ca2+、Cr3+、K+、Mg2+、Cu2+、Zn2+、Mn2+、Pb2+和Fe3+)溶液,使其在反应体系中的最终浓度为1 mmol/L和10 mmol/L,加入等体积(70 μL)酶液于40℃下处理30 min;对照组不添加任何金属离子,以其活力值为100,在最适条件下反应。
1" 3" 5 消化酶对酶活力的影响
分别将胃蛋白酶(用pH 2" 2的Na2HPO4-柠檬酸缓冲液配置,终浓度为50 U/mL)和胰蛋白酶(用pH 7" 0的Na2HPO4-柠檬酸缓冲液,终浓度为50 U/mL)与酶液混合,在最适条件下分别反应1 h和2 h,测定酶活力。
1" 3" 6 底物专一性
另选取3种不同的反应底物微晶纤维素、滤纸、脱脂棉,分别称取8 mg(±0" 1 mg),溶于pH 4" 5的Na2HPO4-柠檬酸缓冲液中,与酶液在40℃下分别反应1 h、2 h、3 h,观察其分解结果,测定550 nm吸光值。
2 结果与分析
2.1 最适温度和热稳定性
由图1可以看出,β-葡聚糖酶适合反应的温度范围为30—50℃,最大酶活力在40℃左右,反应曲线呈抛物线型;以未处理的酶样为对照(40℃),计算不同温度下的相对酶活力。由图2可知,酶在最适温度40℃以下活力稳定,在很小范围内波动;当温度不断升高时,活力开始缓慢下降(50℃);当温度达到60℃、70℃或更高时,处理10 min后酶即快速失活为0,说明此酶不是耐高温酶。

图1 β-葡聚糖酶的最适反应温度Fig.1 The optimal temperature of β-1,4-glucanase
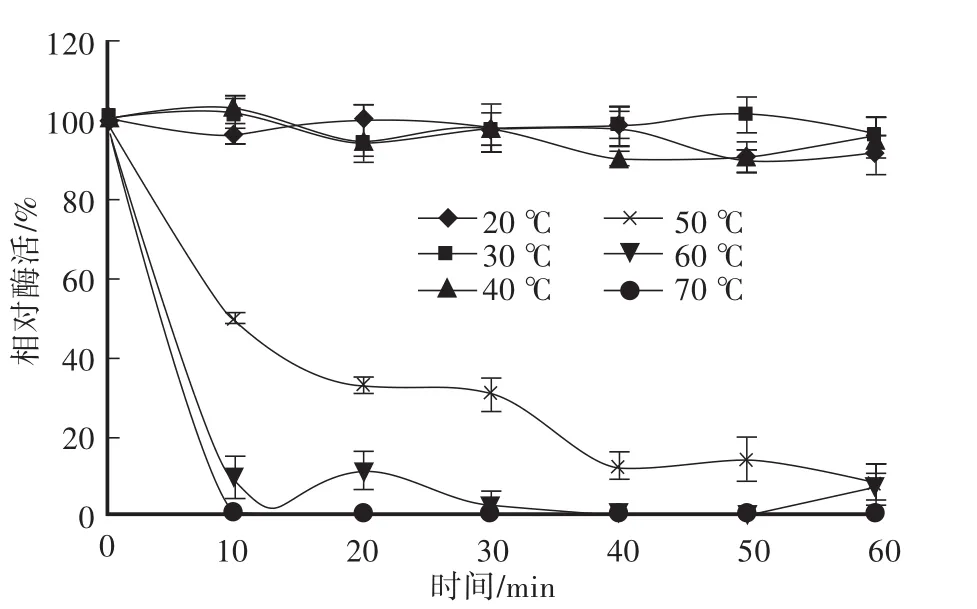
图2 β-葡聚糖酶的热稳定性Fig.2 The thermostability of β-1,4-glucanase
2.2 最适pH和pH稳定性
在不同pH下测定的酶活力显示,β-葡聚糖酶的最适pH在4" 5左右,在pH 3" 0—7" 0时,酶活相对值高于70%。经过24 h、4℃处理后,此酶的稳定性较好,稳定值在pH 4" 0—6" 0;当pH<2" 5或>7" 5时,酶活力较低(图3)。

图3 β-葡聚糖酶的最适pH和pH稳定性Fig.3 The optimal pH and pH stability of β-1,4-glucanase
2.3 金属离子对酶活力的影响
研究了高浓度(10 mmol/L)和低浓度(1 mmol/L)金属离子对酶活的影响,结果表明:不管是在高浓度还是低浓度下,Mn2+对酶活力均有一定的抑制作用,相对酶活低浓度为69" 4%,高浓度为79" 1%;高浓度的Cu2+对酶活力有相当强的抑制作用,相对酶活为49" 5%;高浓度的Al3+对酶活力有一定的促进作用,相对酶活为142" 8%(图4)。

图4 不同浓度金属离子对β-葡聚糖酶的影响Fig.4 Effects of different concentrations of mental ions on β-1,4-glucanase
2.4 消化酶对酶活的影响
从表1可以看出,胃蛋白酶对此酶有一定程度的抑制作用;而胰蛋白酶则对酶活无明显影响;生产中作为动物饲料添加剂时,需考虑消化酶的相互作用。

表1 胃蛋白酶和胰蛋白酶对β-葡聚糖酶活性的影响Table 1 Effects of pepsin and trypsin on β-1,4-glucanase
2.5 酶的底物专一性
由表2可以看出,此酶的底物专一性较好,只对羧甲基纤维素钠(CMC-Na)等纤维素类物质有较强的分解作用,对微晶纤维素、滤纸、脱脂棉等的分解能力微弱。

表2 β-葡聚糖酶的底物专一性Table 2 The substrate specificity of β-1,4-glucanase
3 讨论
本研究表明,β-1,4-葡聚糖酶的最适pH为4" 5,最适温度为40℃,是一种常规酶[15-17],偏酸性;其最适温度与动物肠道内环境温度十分相似,可以更好地促进葡聚糖分解为寡糖,利于消化和吸收,是绿色动物饲料添加剂的新选择。在工业应用中,酶与各种金属离子的相互作用应予以考虑。鉴于Al3+对该酶具有一定的促进作用,可以考虑适当添加;而Mn2+和Cu2+则需避免或少量添加,并且考虑到生化反应中Mn2+和Cu2+的出现及其相互作用,应做到抑制作用最小化。不同的金属离子对不同的葡聚糖酶的影响也不尽相同,也许是因为酶的基因来源不同导致金属离子与葡聚糖酶内电子转运系统的相互作用能力不同。目前,其具体的作用机制还不是非常清楚,有待于进一步探究[18-19]。该酶对羧甲基纤维素钠具有很强的分解作用,且该酶的专一性较强。羧甲基纤维素钠为当今世界上使用范围最广、用量最大的纤维素种类,本研究所得到的玉蜀黍赤霉菌β-1,4-葡聚糖酶的相关酶学特性数据,将为其实际应用提供重要借鉴和参考。
参 考 文 献
[1]Pitson S M,Seviour R J,McDougall B M" Noncellulolytic fungal beta-glucanases:their physiology and regulation[J]" Enzyme Microb Technol,1993,15:178-192"
[2]王在贵,莫宏波,杨普"饲用木聚糖酶、β-葡聚糖酶的研究与应用进展[J]"饲料工业,2003(1):16-18"
[3]Ekinci M S,McCrae S I,Flint H J" Isolation and overexpression of a gene encoding an extracellular-beta-(1,3-1,4)-glucanase from Streptococcus bovis JB1[J]" Applied and environmental microbiology,1997,63:3752-3756"
[4]Flin H J,McPherson C A,Bisset J" Molecular cloning of genes from Ruminococcus flavefaciens encoding xylanase and beta(1-3,1-4)glucanase activities[J]" Applied and environmental microbiology,1989,55:1230-1233"
[5]Chang M M,Culley D E,Hadwiger L A" Nucleotide sequence of a pea(Pisum sativum L")beta-1,3-glucanase gene[J]" Plant physiology,1993,101:1121-1122"
[6]李春磊,任海霞,王瑞明,等"产β-葡聚糖酶高产菌株的驯化及筛选[J]"现代食品科技,2005,22(1):23-25"
[7]Bird A R,Croom W J,Fan Y K,et al" Jejunal glucose absorption is enhanced by epidermal growth factor in mice[J]" The Journal of nutrition,1994,124:231-240"
[8]邹东恢,江洁"β-葡聚糖酶的开发与应用[J]"农产品加工,2005(8):7-9"
[9]Takashi A,Hanae K,Naoto S" Purification and partial characterization of an endo-β-1,3-1,4-glucanase from rice,Oryza sativa L[J]" Biosci Biotech Biochem,1996,60(12):2078-2080"
[10]易华西,徐德昌"β-葡聚糖酶的应用及研究现状[J]"中外食品,2005(5):38-39"
[11]符辉"耐温β-葡聚糖酶的特点及用途[J]"啤酒科技,2002(7):46-47"
[12]魏晓飞,王在贵,陈键"β-葡聚糖酶的酶学性质研究[J]"中国饲料,2007(9):17-23"
[13]李希珍,李一勤,周薇,等"β-D-葡聚糖酶对植物生长的调节作用[J]"植物科学,2001,12(3):20-23"
[14]Nora A F,Syama C,Lana M R,et al" Fusarium Diseases of Canadian Grain Crops:Impact and Disease Management Strategies[M]//Future Challenges in Crop Protection Against Fungal Pathogens" New York:Springer Publisher,2014:267-316"
[15]Kim C H" Characterization and substrate specificity of an endo-beta-1,4-D-glucanase I(Avicelase I)from an extracellular multienzyme complex of Bacillus circulans[J]" Applied and environmental microbiology,1995,61:959-965"
[16]Xu B,Hellman U,Ersson B,et al" Purification,characterization and amino-acid sequence analysis of a thermostable,low molecular mass endo-β-1,4-glucanase from blue mussel,Mytilus edulis[J]" European Journal of Biochemistry,2000,267:4970-4977"
[17]Kono H,Waelchli M R,Fujiwara M,et al" Transglycosylation of cellobiose by partially purified Trichoderma viride cellulose[J]" Carbohydr Res,1999,319:29-37"
[18]Nagai M,Sato T,Watanabe H,et al" Purification and characterization of an extracellular laccase from the edible mushroom Lentinula edodes,and decolorization of chemically different dyes[J]" Applied microbiology and biotechnology,2002,60:327-335"
[19]Lin Y Q,Zhang Z,Tian Y S,et al" Purification and characterization of a novel laccase from Coprinus cinereus and decolorization of different chemically dyes[J]" Molecular biology reports,2013,40:1487-1494"
(责任编辑:闫其涛)
Characterization of endo-β-1,4-glucanase heterologously expressed in Pichia pastoris
WANG Yuan-yuan1,2,WANG Bo2*,WANG Xiu-ying2,3,SHEN Qiang4,XUE Yong2,LI Da-wei1,2,PENG Ri-he2,YAO Quan-hong2**
(1College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2Agro-Biotechnology Research Center,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China;3College of Life and Environmental Sciences,Shanghai Normal University Shanghai 200234,China;4Wuxi City Agricultural Technology Extension Station,Wuxi 214023,China)
Abstract:The β-1,4-glucanase gene from Gibberella zeae was re-synthesized chemically according to the yeast bias condon and tansformed into Pichia pastoris by electroporation" The expressed endo-β-glucanase was characterized,and the results showed that the optimal pH is 4" 5 and the optimal temperature is 45℃" The pH stability of the enzyme was 4" 0—6" 0,which was related to the type of buffer solution" Al3+had activation on the enzyme,but Mn2+and Cu2+inhibited the enzyme activity" The substrate specificity on carboxylmethyl cellulose sodium salt(CMC-Na)was strong" Pepsin had an inhibiting effect on the enzyme"
Key words:β-glucanase;Pichia pastosis;Enzymatic characteristics;DNS method
作者简介:王苑螈(1989—),女,在读硕士,研究方向:生物化学与分子生物学。E-mail:yuanyuanw29@163" com;Tel:18674383752*共同第一作者
基金项目:上海市农委重大项目(沪农科种字2013-8、沪农科种字2014-2)
收稿日期:2015-01-04
文章编号:1000-3924(2016)01-010-05
中图分类号:S816" 3
文献标识码:A
**通信作者:姚泉洪(1965—),男,博士,研究员,研究方向:植物和微生物基因工程。E-mail:yao" quanhong65@yahoo" com

