心力衰竭合并恶病质大鼠瘦素及Janus蛋白酪氨酸激酶2/信号传导与转录激活因子3信号转导通路的变化
张昕 ,石翠翠
作者单位:014010 内蒙古自治区包头市,包头医学院第一附属医院 心血管内科
心力衰竭合并恶病质大鼠瘦素及Janus蛋白酪氨酸激酶2/信号传导与转录激活因子3信号转导通路的变化
张昕 ,石翠翠
作者单位:014010 内蒙古自治区包头市,包头医学院第一附属医院 心血管内科
摘要
关键词心力衰竭;瘦素;受体;信号转导
Changes of Leptin and Janus Protein Tyrosine Kinase 2/Activating Transcriptor 3 Signal Transduction Pathways in Experimental Rats of Heart Failure With Cachexia
ZHANG Xin, SHI Cui-cui.
Department of Cardiology, First Affiliated Hospital of Baotou Medical College, Baotou (014010), Inner Mongolia, China
Corresponding Author: SHI Cui-cui, Email: 243821336@qq.com
Abstract
Objective: To investigate the changes of serum levels of leptin in chronic heart failure (CHF) rats with cachexia and to study its mechanism via leptin receptor expression and leptin signal transduction pathways.
Methods: There were 15/60 male SD rats were randomly used as Control group. CHF model was established in rest 45 rats by isoproterenol hydrochloride (ISO) injection as CHF group, n=36; 9 rats died. According to body weight changes and echocardiography examination, CHF rats were further divided into 2 groups: cCHF group, the rats with cachexia, n=16 and ncCHF group, the rats with non-cachexia, n=20. Serum levels of leptin and protein levels of janus activating kinase 2 (JAK2), signal transducer and activator of transcription 3 (STAT3), suppressor of cytokine signaling 3 (SOCS3) were examined by ELISA; the expressions of leptin receptor in the myocardial and adipose tissues were observed by immunohistochemistry; mRNA expressions of JAK2, STAT3 and SOCS3 in adipose tissue were detected by RT-PCR.
Results: Serum levels of leptin, JAK2, STAT3 and the expressions of JAK2, STAT3 in adipose tissue were higher in both ncCHF and cCHF groups than Control group, P<0.05; protein levels and mRNA expressions of JAK2 and STAT3 were similarbetween cCHF group and ncCHF group, P>0.05. Serum levels of leptin, SOCS3 and mRNA expression of SOCS3 in cCHF group were lower than ncCHF group, P<0.05. The expressions of leptin receptor in myocardial and adipose tissue were higher in cCHF group than ncCHF group, P<0.05, while the expressions in ncCHF group were higher than Control group, P<0.05.
Conclusions: Increased serum level of leptin was involved in HF occurrence, leptin receptor expression and JAK2/ STAT3 signal transduction pathways might be related to CHF combining cachexia in experimental rats.
Key words Heart failure; Leptin; Recptors; Signal transduction pathway
(Chinese Circulation Journal, 2016,31:82.)
慢性心力衰竭(CHF)是各种心脏疾病发展到终末期共同的临床表现,据人群流行病学调查,其发病率约为3‰~20‰[1]。除心功能减低、心脏结构异常等表现外,往往出现不同程度的机体消耗。随着脂肪组织和骨组织减少到一定程度就会出现心力衰竭恶病质(cCHF),以体重下降、低营养状态为特征,表现为厌食、消瘦、乏力等。研究发现这与患者的脂肪组织分解、肌肉萎缩等相关[2],瘦素(LEP)在此过程中发挥重要作用。瘦素与特异受体-瘦素受体(Ob-R)结合,主要作用于下丘脑[3],通过信号转导途径发挥其生物学效应[4]。Janus蛋白酪氨酸激酶2/信号传导与转录激活因子3(JAK2/STAT3)途径目前被认为是瘦素信号转导的主要途径[5]。本研究探讨cCHF大鼠血清瘦素变化的原因,并从Ob-R表达情况及瘦素信号转导通路探讨其变化的原因,初步阐明心力衰竭恶病质的发生机制。
1 材料与方法
建立大鼠心力衰竭模型: 2014-04选用10~12周龄雄性SD大鼠60只,体重280~300 g,随机抽取45只腹股沟皮下注射异丙肾上腺素(大连美仑生物有限公司提供)建立心力衰竭模型(ISO组,n=36,死亡9只)。具体方法:ISO的配制终浓度为20 mg/ml,按180 mg/(kg·d),隔日一次,共2次注射到大鼠腹股沟皮下,所有大鼠用药后正常进食和活动,饲养4周。其余15只大鼠,注射等体积9 g/(L·d)生理盐水,作为对照组(n=15)。4周后根据体重变化及超声心动图结果将ISO组分为两亚组,较对照组体重下降大于6%者划分为心力衰竭恶病质亚组(cCHF亚组,n=16),其余为心力衰竭非恶病质亚组(ncCHF亚组,n=20)[6]。采血2 ml,4℃低温离心,3000 g/ 5 min,分离出上层血清,置于-80℃冰箱下保存;取大鼠腹股沟处脂肪组织,其中一块置于AF液(即95%乙醇:40%甲醛原液=9:1的混合固定液)中,室温保存24小时后石蜡包埋;另一块立刻置于冻存管中,于液氮中保存;取大鼠心肌组织,立刻置于AF液中,室温保存24小时后石蜡包埋。
酶联免疫吸附试验(ELISA)检测大鼠血清瘦素水平及JAK2、STAT3、细胞因子信号转导抑制因子3(SOCS3)蛋白水平[7]:取大鼠血清样本各10 μl,按酶联免疫分析说明书进行(北京博奥森生物技术有限公司)。结果判断:绘制标准曲线。在ELISA Calc软件中,以标准品浓度作横坐标,对应OD值做纵坐标,绘制出标准品线性回归曲线,以曲线方程计算各样本浓度值。
免疫组化法检测大鼠脂肪及心肌组织中Ob-R表达情况:首先石蜡切片常规脱水,高温修复,PBS液(5.93 g 次亚硝酸钠·2H2O2+58.02 g 磷酸氢二钠·12H2O2加入1000 ml双蒸水中,pH=7.4)冲洗3×3 min,每张切片滴加3% H2O2去离子水50 μl,室温静置15 min后,滴加50 μl正常非免疫动物血清,室温静置15 min,倾去,加50 μl一抗,4℃冰箱过夜。PBS液冲洗3×3 min,滴加50 μl生物素标记的二抗,室温静置15 min,PBS液冲洗3×3 min。滴加50 μl过氧化物酶溶液,室温静置15 min,PBS液冲洗3×3 min。滴加100 μl DAB液(新鲜配制),室温下静置6 min,复染,封片。结果判定:瘦素受体阳性细胞染色均位于胞浆,呈棕黄色细颗粒。每张切片选取5个不同的高倍镜视野,各视野计数100个细胞,半定量法计算各视野阳性细胞的平均百分率。
逆转录聚合酶链反应(RT-PCR)法检测大鼠脂肪组织中JAK2、STAT3、SOCS3表达情况:(1)Trizol法提取大鼠脂肪组织RNA。(2)合成cDNA[宝生物工程(大连)有限公司提供]:取无核酸酶的0.1 ml EP管,依次加入5×M-MLV 缓冲液 2 μl,dNTP 混合物、Oligo dT引物、Random 6 mers各0.5 μl,总RNA 6.5 μl,共10 μl。置于PCR仪中37℃15 min,85℃ 5 s进行反应。cDNA产物保存于4℃冰箱。(3)PCR扩增:①引物序列设计及合成:通过查找外文文献查找明确引物,并由上海生工生物工程技术服务有限公司合成。引物序列如下:JAK2正向引物5’-TTCAAA TGAGATTGTGGGAAAATTGCT-3’的和反向引物5’-AGATCATCTCTGCCTGAGTATCTT-3’;STAT3正向引物5’-ACCTCCAGGACGACTTTGAT-3’的和反向引物5’-TGTCTTCTGCACGTACTCCA-3’;SOCS3正向引物5’-CCATGGTCACCCACAGCAAG-3’的和反向引物5’-CTCTGACCCTTTCTTTGCTC-3’;β-肌动蛋白:F TCAGGTCATCACTATCGGCAAT, R AAAGAAAGGGTGTAAAACGCA。②RT-PCR[宝生物工程(大连)有限公司提供]:用得到的DNA样品进行PCR。PCR体系(总体积25 μl):预混物Ex TaqⅡ12.5 μl,PCR 正向引物、PCR 反向引物各1 μl,RT 反应液(cDNA溶液)2 μl,DEPC 水8.5 μl。反应条件:94℃10 min,94℃40 s, 55℃ 30 s,72℃1 min,72℃ 5 min,34个循环。取PCR扩增产物10 μl,置于含有溴乙锭的2%琼脂糖凝胶中进行电泳,电泳条件:150 V,15 min。电泳结束后,在紫外灯下观察结果,并经凝胶成像仪获取图像。
统计学方法:所有统计分析过程均使用SPSS 18.0软件完成,大鼠cCHF亚组与ncCHF亚组计数资料组间构成比、率的比较采用卡方检验,计量资料两组间均数比较采用t检验,两组以上均数比较采用单因素方差分析,数据的表达以均数±标准差表示,P<0.05代表差异有统计学意义。
2 结果
动物模型的评价:(1)体重变化:注射药物前ISO组体重(291.25±3.77)g,与对照组(292.37±4.40)g比较差异无统计学意义(P>0.05),注射药物4周后cCHF亚组[体重:(268.41±6.12)g]低于ncCHF亚组[体重:(314.78±4.13)g]和对照组(346.32±3.99)g,差异有统计学意义(P<0.05),且ncCHF亚组低于对照组,差异有统计学意义(P<0.05)。(2)超声心动图结果(表1): ISO组与对照组相比,左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)显著增大(P<0.05),左心室射血分数(LVEF)、左心室短缩指数(LVFS)显著降低,差异均有统计学意义(P<0.05)。

表1 对照组与ISO组大鼠超声心动图结果比较(?±s)
三组大鼠血清瘦素、JAK2、STAT3、SOCS3水平比较(表2):瘦素水平 cCHF亚组、ncCHF亚组均高于对照组,差异有统计学意义(P<0.05),且ncCHF亚组高于cCHF亚组,差异有统计学意义(P<0.05)。JAK2水平及STAT3水平ncCHF亚组和cCHF亚组均高于对照组,差异有统计学意义(P<0.05),cCHF亚组与ncCHF亚组间差异无统计学意义(P>0.05)。SOCS3水平cCHF亚组低于ncCHF亚组,差异有统计学意义(P<0.05);两亚组与对照组比较差异均无统计学意义(P>0.05)。
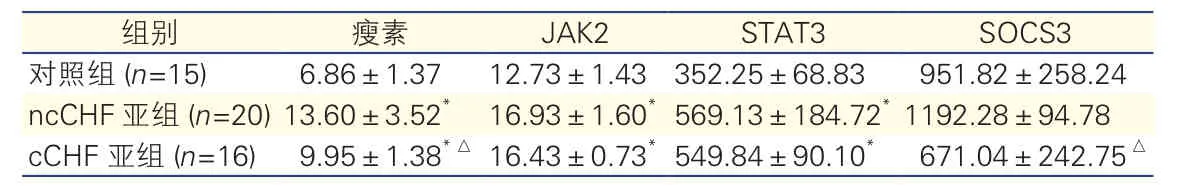
表2 三组大鼠?血清瘦素、JAK2、STAT3、SOCS3水平比较(ng/ml,±s)
三组大鼠免疫组化心肌组织中Ob-R表达(图1):Ob-R阳性细胞染色主要表达于胞浆,呈棕黄色。心肌中的Ob-R表达,cCHF亚组(72.8%)高于ncCHF亚组(67.4%)和对照组(57.3%),ncCHF亚组高于对照组,差异均有统计学意义(P<0.05)。
三组大鼠免疫组化脂肪组织中Ob-R表达(图2):Ob-R阳性细胞染色位于胞浆,呈棕黄色。脂肪组织中的Ob-R的表达,cCHF亚组(58.0%)高于ncCHF亚组(30.2%)和对照组(26.8%),P<0.05,ncCHF亚组高于对照组(P<0.05),差异均有统计学意义。
三组大鼠脂肪组织中JAK2、STAT3、SOCS3 信使核糖核酸(mRNA)的表达情况(表3):脂肪组织中JAK2 mRNA的表达量及STAT3 mRNA的表达量在ncCHF亚组和cCHF亚组均显著高于对照组(P<0.05),差异有统计学意义,cCHF亚组低于ncCHF亚组,但差异无统计学意义(P>0.05)。SOCS3 mRNA的表达量在cCHF亚组显著低于ncCHF亚组和对照组,差异有统计学意义(P<0.05),对照组低于ncCHF亚组,但差异无统计学意义(P>0.05)。
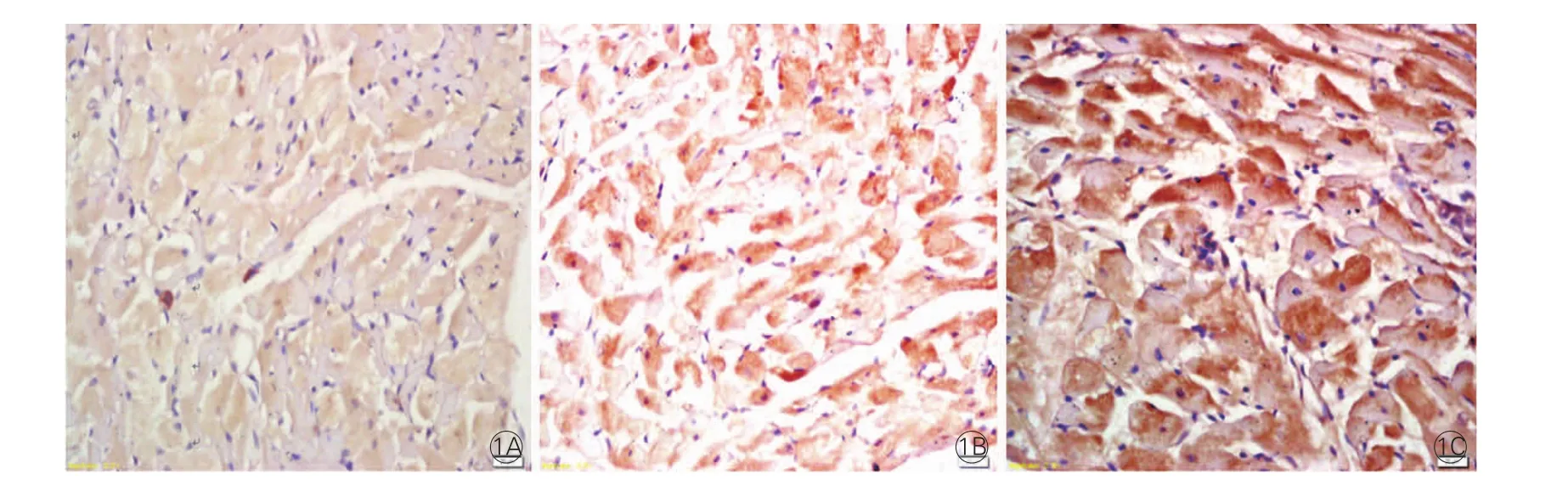
图1 瘦素受体在三组大鼠心肌组织免疫组化染色中的表达(×200)(标尺:20μm)
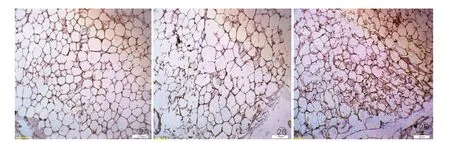
图2 瘦素受体在三组大鼠脂肪组织免疫组化染色中的表达(×200)(标尺:100μm)
表3 三组大鼠脂肪组织中JAK2、STAT3、SOCS3 mRNA相对表达量比较(±s)
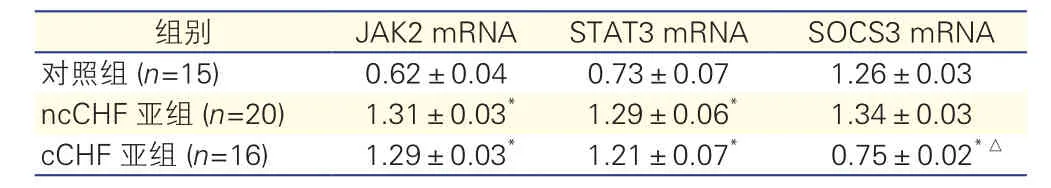
注: JAK2:Janus蛋白酪氨酸激酶2;STAT3:信号传导与转录激活因子3;SOCS3:细胞因子信号转导抑制因子3;ncCHF:心力衰竭非恶病质;cCHF:心力衰竭恶病质。与对照组比较*P<0.05;与ncCHF亚组比较△P<0.05
3 讨论
心力衰竭合并恶病质是患者死亡的独立预测因素之一。目前心力衰竭恶病质的病理生理机制还没有完全明确,其中炎性细胞因子增加、神经介质活动增强导致机体代谢失衡,可出现脂肪与骨组织减少导致恶病质发生。恶病质患者存在低营养状态,这与调整食欲和新陈代谢的激素变化有关,瘦素为此过程的关键因子。瘦素通过与其受体Ob-R结合作用于靶细胞发挥生物学作用。
目前发现Ob-R至少有6种拼接异构体,包括Ob-Ra-f。Ob-R按照结构可分为:胞外区、跨膜区和胞浆区3个区(除Ob-Re)。Ob-Rb是单跨膜受体,胞内无激酶活性的催化区,与胞质中JAK2结合而使其磷酸化及JAK2磷酸化、活化,为STAT3提供结合位点并募集,进而活化[8],便与Ob-Rb解离并形成二聚体,然后进入细胞核将信号传至细胞核,作为转录因子与特异的DNA序列结合,参与靶基因表达调控[9]。通路中STAT3的激活可诱导SOCS3表达,SOCS3以负反馈的形式抑制JAK2/ STAT3信号通路的活化,构成了完整的瘦素信号转导通路。
我们的研究结果显示,CHF组血清瘦素水平明显高于对照组,说明高瘦素血症确有可能是CHF患者的病理生理学特征之一,瘦素可能参与了CHF的能量代谢,与武琦等[10]研究一致。有人认为CHF患者高瘦素水平的一个可能原因是瘦素抵抗,可溶性Ob-R增加是瘦素抵抗可能的原因之一,升高的可溶性Ob-R与功能性细胞膜Ob-R竞争结合瘦素,抑制瘦素发挥作用,使人体对瘦素敏感性下降。然而血清瘦素水平在cCHF亚组较ncCHF亚组降低,因脂肪组织是瘦素的主要来源,在恶病质状态下大鼠白色脂肪组织是减少的。但瘦素水平在cCHF亚组仍高于对照组,所以可以推测cCHF亚组大鼠的剩余脂肪组织合成瘦素的能力增强,与Doehner等[11]研究是一致的。
我们的实验发现,Ob-R在cCHF亚组和ncCHF亚组中表达均高于对照组,cCHF亚组增高更为明显,这可能与脂肪组织减少有关,合成瘦素水平降低,瘦素信号缺失,导致Ob-R表达增强,说明恶病质状态下Ob-R表达增强,进一步增加对瘦素的利用度。因此,cCHF患者血清瘦素水平虽低于ncCHF患者,由于Ob-R表达增强,瘦素与其结合,利用率较高,高效率发挥其抑制食欲、增加能量消耗作用,导致体重下降、消瘦等表现。
为了明确瘦素信号通路是否参与了心力衰竭恶病质的发生,我们采用ELISA及RT-PCR法检测JAK2、STAT3、SOCS3水平及表达。我们发现ncCHF组和cCHF组血清瘦素水平明显高于对照组,这可能与JAK2、STAT3水平增高、表达增强、信号转导增强有关,在我们的研究中,即JAK2和STAT3水平在ncCHF组和cCHF组高于对照组,RT-PCR中JAK2和STAT3表达也高于对照组。ELISA及RT-PCR检测均发现JAK2和STAT3 在cCHF亚组中低于ncCHF亚组,但两组比较中无明显差别,说明该信号通路参与CHF发展过程;但SOCS3水平在cCHF亚组却明显低于ncCHF亚组,在RT-PCR中也发现一致的表现,这可能与低瘦素水平有关。刘莉等[12]发现瘦素可以通过激活JAK/ STAT信号通路,诱导脂肪细胞SOCS3的表达,高浓度瘦素可以诱导产生更多的SOCS3,而低浓度瘦素诱导产生的SOCS3相对较少;且瘦素水平降低,信号传导强度较前减弱,SOCS3激活减少,其浓度降低。SOCS3是瘦素信号转导通路的抑制因子,因此,SOCS3在cCHF亚组中对JAK2/STAT3抑制作用低于其他两组,促进瘦素发挥作用,导致患者出现消瘦、厌食、乏力等症状,说明瘦素的JAK2/STAT3通路可能参与心力衰竭恶病质的发生。
本实验存在一定的局限性,因瘦素还存在其他信号转导途径,如磷脂酰肌醇3激酶、促分裂素原活化蛋白激酶等信号通路,是否这些通路也同时或部分参与心力衰竭恶病质的发生发展;我们将进一步检测血液循环中可溶性Ob-R的表达,比较可溶性Ob-R与细胞膜Ob-R在心力衰竭恶病质患者中的表达有无差异;这些问题还有待进一步研究。
参考文献
[1] 朱文玲. 心力衰竭的进展. 中国循环杂志, 2006, 2: 1-3.
[2] Diana RE, Jose MG. Leptin in anorexia and cachexia syndrome. Int J Pept, 2012: 13-15.
[3] 武力勇, 王先梅, 杨丽霞, 等. 心室重塑患者瘦素抵抗与胰岛素抵抗及其相关性研究. 中国循环杂志, 2011, 26: 30-33.
[4] Okoshi MP, Romeiro FG, Paiva SA, et al. Heart failure-induced cachexia. Arq Bras Cardiol, 2013, 100: 476-482.
[5] 于月, 尤佳, 杨柳, 等. 瘦素信号转导通路在能量代谢平衡中的作用机制. 生命科学, 2013, 25: 169-175.
[6] Tanada Y, Shioi T, Kato T, et al. Branched-chain amino acids ameliorate heart failure with cardiac cachexia in rats. Life Sci, 2015, 137: 20-27.
[7] 付仲颖, 蒋蓝英, 郦旦明, 等. 参附注射液对慢性心力衰竭大鼠JAK-STAT细胞信号传导调节的研究. 中华危重症医学杂志, 2014, 7: 19-23.
[8] Donato J Jr, Frazão R, Elias CF. The PI3K signaling pathway mediates the biological effects of leptin. Arq Bras Endocrinol Metab, 2010, 54: 591-602.
[9] 王文正, 赵素梅, 高士争. Leptin介导的JAK/STAT信号通路对脂类代谢调节的研究进展. 中国细胞生物学报, 2011, 33: 584-589.
[10] 武琦, 徐彤彤, 覃泱, 等. 血清脂联素、瘦素与心力衰竭程度关系的研究. 安徽医科大学学报, 2013, 48: 182-184.
[11] Doehner W, Pflaum CD, Rauchhaus M, et al. Leptin, insulin sensitivity and growth hormone binding protein in chronic heart failure with and without cardiac cachexia. Eur J Endocrinol, 2001, 145: 727-735.
[12] 刘莉, 顾海伦. 瘦素对大鼠脂肪细胞SOCS-3表达的影响. 东南大学学报, 2011, 30: 710-713.
(编辑:汪碧蓉)
基础与实验研究
收稿日期:( 2015-04-18)
中图分类号:R541.6
文献标识码:A
文章编号:1000-3614(2016)01-0082-05
doi:10.3969/j.issn.1000-3614.2016.01.018
作者简介:张昕 主任医师 博士 主要研究方向:心力衰竭恶病质 Email:zhangxinwdq@sina.com 通讯作者:石翠翠 Email:243821336@qq.com
目的:探讨慢性心力衰竭合并恶病质大鼠血清瘦素水平的变化,并从瘦素受体表达及瘦素信号转导通路探讨其变化的原因,初步阐明心力衰竭恶病质的发生机制,为其治疗寻求新靶点。
方法:60只雄性SD大鼠随机挑选15只作为对照组,其余45只大鼠通过注射异丙肾上腺素制作大鼠心力衰竭模型(ISO组,n=36,死亡9只),根据体重变化及超声心动图结果将ISO组分为心力衰竭恶病质亚组(cCHF亚组,n=16)与心力衰竭非恶病质亚组(ncCHF亚组,n=20)。酶联免疫吸附法检测各组大鼠血清瘦素、Janus蛋白酪氨酸激酶2(JAK2)、信号传导与转录激活因子3(STAT3)、细胞因子信号转导抑制因子3(SOCS3)水平;免疫组化法检测大鼠心肌、脂肪组织中瘦素受体的表达情况;逆转录聚合酶链反应(RT-PCR)法检测大鼠脂肪组织中JAK2、STAT3、SOCS3信使核糖核酸(mRNA)表达情况。
结果:血清瘦素、JAK2、STAT3水平及脂肪组织JAK2、STAT3表达在ncCHF亚组和cCHF亚组明显高于对照组(P<0.05),差异有统计学意义;JAK2、STAT3水平及mRNA表达在cCHF亚组低于ncCHF亚组(P>0.05),差异无统计学意义;血清瘦素、SOCS3水平及SOCS3 mRNA表达在cCHF亚组低于ncCHF亚组(P<0.05),差异有统计学意义;瘦素受体在大鼠心肌、脂肪组织中的表达,cCHF亚组均高于ncCHF亚组和对照组(P<0.05),差异有统计学意义,ncCHF亚组高于对照组(P<0.05),差异有统计学意义。
结论:高瘦素水平参与心力衰竭的发生,且瘦素水平与受体表达及其JAK2/STAT3信号通路相关蛋白表达的变化相关;瘦素的JAK2/STAT3信号通路可能参与心力衰竭恶病质的发生。

