CBS基因过表达PC12 细胞株的建立及鉴定
尹蔚兰,廖志强,阳柏成,姜骆永,文芳,邬力祥
(1中南大学基础医学院,长沙410083; 2南华大学医学院)
CBS基因过表达PC12 细胞株的建立及鉴定
尹蔚兰1,2,廖志强2,阳柏成2,姜骆永2,文芳1,邬力祥1
(1中南大学基础医学院,长沙410083; 2南华大学医学院)
目的建立胱硫醚-β-合成酶(CBS)基因过表达PC12细胞株并进行鉴定。方法根据GenBank数据库中的CBS cDNA序列设计合成CBS基因引物,PCR扩增CBS基因,并将其克隆到慢病毒过表达载体GV341中,用慢病毒过表达载体连同两种包装病毒载体对293T细胞进行转染,收获含CBS慢病毒载体的上清液,用其感染正常的PC12细胞,用嘌呤霉素进行筛选得到CBS基因过表达PC12细胞株。用实时荧光定量PCR法检测所得PC12细胞(观察组)、空载体转染的PC12细胞(对照组)、正常PC12细胞(空白组)中的CBS mRNA。用Western blot法检测上述三组细胞中的CBS 蛋白。结果观察组、对照组、空白组PC12细胞CBS mRNA表达量分别为162.20±11.20、1.00±0.03、2.30±0.07,CBS蛋白表达量分别为1.53±0.09、1.00±0.10、0.96±0.10。观察组PC12细胞CBS mRNA、蛋白表达量均高于对照组和空白组(P均<0.05),对照组PC12细胞CBS mRNA、蛋白表达量与空白组相比差异均无统计学意义。结论成功构建CBS基因过表达PC12细胞株。
PC12细胞;胱硫醚-β-合成酶;慢病毒载体
H2S是一氧化碳和一氧化氮之后被发现的第三种气体信号分子,广泛参与人体的生理病理过程。研究表明,H2S与神经系统疾病关系密切,具有抗氧化、抗凋亡、抗炎等作用,被认为是一种新型的神经调质。但是H2S作为一种气体分子,性质活泼,容易挥发,不利于进行科学研究和临床应用。胱硫醚-β-合成酶(CBS)是脑内H2S的主要合成酶。通过改变CBS基因的表达来改变内源性H2S 的生成,对研究H2S 与神经细胞疾病的关系具有非常重要的作用。2014年10月~2015年3月,我们用CBS过表达慢病毒载体转染PC12细胞建立了CBS过表达PC12细胞株,为深入研究H2S与神经系统疾病关系提供稳定的细胞株。现报告如下。
1 材料与方法
1.1主要试剂、质粒与细胞大鼠肾上腺嗜铬细胞瘤细胞PC12、人胚肾细胞293T购自中科院上海细胞库。 GV341载体、辅助包装质粒均购自上海吉凯生物公司,培养基、胎牛血清购自Gbico公司,脂质体Lipofectamine 2000、TRIzol购自Invitrogen公司,感受态细胞购自Auragene公司,DNA ladder Marker均购自Fermentas公司,Taq polymerase购自SinoBio公司,限制性内切酶购自NEB公司,质粒抽提试剂盒购自Promega公司;CBS抗体、GAPDH抗体均购自Abcam公司。
1.2CBS cDNA的扩增及其慢病毒过表达载体的构建根据GenBank中的CBS基因序列(NM_012522)设计引物,序列如下:上游5′-CCAACTTTGTGCCAACCGGTCGCCACCATGCCTTCAGGGACAT-CCCAG-3′,下游5′-AATGCCAACTCTGAGCTTTTTCC-GGGTCTGCTCACGGGCT-3′。根据PCR反应试剂盒说明进行PCR反应。反应完成后行琼脂糖凝胶电泳,DNA胶回收试剂盒回收PCR产物。将回收后CBS片段酶切,用T4 DNA连接酶将已经用Age I /Nhe I酶双酶切成线性化的带有嘌呤霉素抗性标记的慢病毒GV341载体和双链DNA在缓冲液中进行连接,转化大肠杆菌DH5α。常规筛选鉴定,挑取小量培养的PCR 鉴定阳性克隆,上海生物工程有限公司测序确认。
1.3慢病毒载体构建与包装将测序正确的重组慢病毒载体和2种包装载体共转染到293T细胞中,37 ℃培养48 h后,收集上清培养基,用0.45 μm滤膜过滤,收集过滤后的含慢病毒载体上清,-80 ℃保存备用。用转染空载体的PC12细胞作为阴性对照。
1.4慢病毒转染PC12细胞将约5×104个生长良好的PC12细胞接种于6孔培养板中,待细胞密度达30%左右时,将含慢病毒载体上清用含10%胎牛血清的RPMI-1640完全培养基按 1∶ 1的比例稀释。弃原培养基,PBS洗2遍,加入上述含慢病毒载体的RPMI-1640完全培养基。转染24 h后,去除含有慢病毒载体的RPMI-1640的培养基,加入正常的RPMI-1640完全培养基继续培养24 h,加6 μg/mL嘌呤霉素筛选,2 d换液1次,持续换药3次,得到CBS过表达PC12细胞株。
1.5CBS过表达PC12细胞株的鉴定取转染CBS过表达慢病毒载体的PC12细胞(CBS过表达PC12细胞株细胞)、转染空载体的PC12细胞和正常的PC12细胞,分别为观察组、对照组和空白组。
1.5.1CBS mRNA检测采用实时荧光定量PCR法。取各组细胞各5×104个接种至6孔培养板,培养至细胞融合80%。按照RNA提取试剂盒说明书,提取细胞总RNA,并将总RNA反转录为cDNA。取3种细胞的cDNA 各1 μL 为模板进行实时荧光定量PCR。CBS基因的上游引物为5′-GCTATCGCTGCATTATCG-3′,下游引物为5′-CTGCGGTGTCATCGTAGT-3′,扩增片段长度228 bp;GAPDH的上游引物为5′-TTCAACGGCACAGTCAAGG-3′,下游引物为5′-CTCAGCACCAGCATCACC-3′,扩增片段长度114 bp。用2-ΔΔCt法计算各组CBS mRNA表达量。
1.5.2CBS蛋白检测方法用Western blot法。取各组细胞106个接种到25 cm2的细胞培养瓶中。培养至细胞融合90%后去原培养基,用预冷的PBS漂洗3次,加入细胞裂解液200 μL,在冰上继续孵育3 min,用细胞刮刮取细胞,收集全部细胞裂解液至500 μL EP管中,冰上继续裂解30 min,12 000 r/min、 4 ℃ 离 心 10 min,取上清,采用Western blot试剂盒进行蛋白定量,样品储存于-80 ℃低温冰箱保存备用。配制10%SDS-PAGE分离胶和5%积层胶,细胞样品加入5×SDS-PAGE 上样缓冲液后,在PCR仪中100 ℃变性5 min。每孔加30 μg细胞蛋白,置于电泳缓冲液中,20 mA电泳约30 min,待样品进入分离胶后,转用120 V继续电泳,当溴酚蓝指示剂离胶底线约1 cm时停止电泳,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭2 h。根据 Marker和分子量分别将膜上含CBS蛋白(63 kD)、GAPDH (37 kD)的部分分别切下,加入相应的一抗,室温孵育过夜,用TBST洗膜3次,每次10 min,加入二抗(效价为1∶ 2 000),37 ℃孵育1 h后TBST洗膜3次,每次10 min,将洗膜后的膜取出,用ECL化学发光法进行操作,在凝胶成像系统上曝光显影及灰度扫描,所得图像用Image J软件进行条带灰度值定量分析。
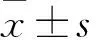
2 结果
观察组、对照组、空白组PC12细胞CBS mRNA表达量分别为162.20±11.20、1.00±0.03、2.3±0.07,CBS蛋白表达量分别为1.53±0.09、1.0±0.10、0.96±0.10。观察组PC12细胞CBS mRNA、蛋白表达量均高于对照组和空白组(P均<0.05),对照组PC12细胞CBS mRNA、蛋白表达量与空白组相比差异均无统计学意义。
3 讨论
过去对H2S进行的研究往往集中于其毒理作用,对其生理意义和药理作用的研究鲜见报道。1996年Abe等[1]首次证明内源性H2S可能是一种神经活性物质。脑内内源性H2S主要依赖于CBS合成[2, 3~5]。CBS活性直接关系到脑内H2S的水平。脑内内源性H2S可以选择性地提高N-甲基-D-天冬氨酸受体调节的神经系统反应,易化海马区长时程增强作用(LTP)的产生[6,7],其机制可能与H2S促进cAMP 生成有关[7]。另外,Zhao等[8]研究发现,H2S是一种重要的内源性血管舒张因子,可直接作用于血管平滑肌上K+-ATP通道或影响细胞外Ca2+内流[9],从而实现其调节血管舒缩的功能。现在,越来越多的资料表明,H2S是继一氧化氮和一氧化碳之后的又一气体信号分子[9~12],参与阿尔茨海默病、帕金森病、脑缺血再灌注等多种神经系统疾病的病理生理过程[13~15]。
目前研究H2S的生理和药理效应主要通过H2S饱和溶液和硫氢化钠。饱和H2S不稳定,易挥发,容易中毒;而硫氢化钠则容易分解氧化,在体内需要与H+反应才能释放与H2S,因此其生物学效应并不与H2S一致。近年来也有很多科研单位自行合成了一些可在体内产生H2S的物质,比如北京大学心血管病研究所合成的GYY4137,这种化合物稳定、低毒、缓释[16],但它不能透过血脑屏障,不能用于神经系统疾病研究。因此,通过基因干预H2S合成酶CBS的表达对研究内源性H2S与神经系统疾病的关系具有重要意义。
慢病毒载体是来源于HIV-1的一种病毒载体,它对分裂细胞和非分裂细胞均具有感染能力,能够将外源目的基因有效整合到宿主染色体上,并能持久稳定表达,因此适合用于构建稳定表达目的基因的细胞株。PC12细胞来源于大鼠肾上腺嗜铬细胞瘤,由于它的形态、结构和功能与多巴胺能神经元相似,因此,常被用来建立研究神经元的细胞模型。本研究通过构建过表达CBS基因的慢病毒载体,并转染PC12细胞,获得稳定过表达CBS的PC12细胞株,经鉴定过表达CBS的PC12细胞株CBS mRNA和蛋白表达量明显高于正常PC12细胞株和转染空载体的PC12细胞株,表明构建CBS过表达的PC12细胞株成功,这为后续研究H2S与神经系统疾病的关系提供了重要的研究工具。
[1] Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. Neurosci,1996,16(3):1066 -1071.
[2] Margaill I, Plotkine M, Lerouet D. Antioxidant strategies in the treatment of stroke [J]. Free Radic Biol Med,2005,39(4):429-443.
[3] Eto K, Kimura H. The production of hydrogen sulfide is regulated by testosterone and S-adenosyl-L-methionine in mouse brain [J]. Neurochem,2002,83(1):80- 86.
[4] Eto K, Kimura H. A novel enhancing mechanism for hydrogen sulfide-producing activity of cystathionine beta-synthase[J]. Biol Chem,2002,277(45):42680-42685.
[5] Yang G, Sun X, Wang R. Hydrogen sulfide-induced apoptosis of human aorta smooth muscle cells via the activation of mitogen-activated protein kinases and caspase-3[J]. FASEB J,2004,18(14):1782-1784.
[6] Eto K, Ogasawara M, Umemura K. Hydrogen sulfide is produced in response to neuronal excitation[J]. Neurosci,2002,22(9):3386-3391.
[7] Kimura H. Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor[J]. Biochem Biophys Res Commun, 2000,267 (1):129-133.
[8] Zhao W, Zhang J, Lu Y, et al. The vasorelaxant effect of H2S as a novel endogenous gaseous KATP channel opener [J]. EMBO J, 2001,20(21):6008-6016.
[9] Zhao W, Wang R. H2S-induced vasorelaxation and underlying cellular and molecular mechanisms [J]. Am J Physiol Heart Circ Physiol, 2002,283(2):474-480.
[10] Wang R. Can H2S be the third endogenous gaseous ransmitter [J]. FASEB J, 2002,16(13):1792-1798.
[11] 唐小卿, 冯鉴强. 第3种内源性气体信号分子 [J]. 中国药理学通报,2003, 19(9):961-964.
[12] Moore PK, Bhatia M, Moochhala S. Hydrogen sulfide: from the smell of the past to the mediator of the future[J]. Trends Pharmacol Sci,2003,24(12):609-611.
[13] He XL,Yan N, Zhang H, et al. Hydrogen sulfide improves spatial memory impairment and decreasesproduction of Ab in APP/PS1 transgenic mice [J]. Neurochem Int, 2014,33(67):1-8.
[14] Lu M, Zhao FF, Tang JJ, et al. The Neuroprotection of Hydrogen Sulfide againstMPTP-induced dopaminergic neuron degeneration involves Uncoupling Protein 2 rather than ATP-Sensitive Potassium Channels[J]. Antioxid Redox Signal, 2012,24(17):849-859.
[15] Wang JF, Li Y, Song JN, et al. Role of hydrogen sulfide in secondary neuronal injury [J]. Neurochem Int, 2014,11(64):37-47.
[16]Yu F, Zhao J, Tang CH, et al. EffectofsynthesizedGYY4137,aslowlyreleasinghydrogensulfidedonor, oncellviabilityanddistributionofhydrogensulfideinmice [J]. J Peking Uni (Heal Sci), 2010,42(5):493-497.
Construction and identification of PC12 cells with overexpressed CBS
YINWeilan1,LIAOZhiqiang,YANGBocheng,JIANGLuoyong,WENFang,WULixiang
(1DepartmentofPhysiology,XiangyaSchoolofMedicine,CentralSouthUniversity,Changsha410078,China)
Objective To establish stable PC12 cell line with overexpression of cystathionine-β-synthase (CBS) and to identify it. MethodsCBS primers were designed according to cDNA sequence of CBS gene from GenBank. The CBS gene was amplified using PCR and ligated into the lentiviral vector GV341. 293T cells were transfected with the recombinant vector and two kinds of packaging viral vector. Viral supernatant was collected and was used to transfect PC12 cells. After puromycin screening, PC12 cells with CBS gene transfection were constructed. The CBS mRNA and protein of the PC12 cells and the empty vector transfected PC12 cells was detected by real-time fluorescent quantitative PCR and Western blotting, respectively.ResultsThe CBS mRNA expression in the observation group, control group and empty vector group was 162.2±11.2, 1.0±0.03 and 2.3±0.07, respectively. The CBS protein expression in the observation group, control group and empty vector group was 1.53±0.09, 1.00±0.10 and 0.96±0.10, respectively. The CBS mRNA and protein expression levels of the observation group were higher than those of the control group and empty vector group (P<0.05). The difference of CBS mRNA and protein expression between the control group and empty vector group was not statistically significant. ConclusionThe PC12 cell line with overexpressed CBS is successfully constructed.
PC12 cells; cystathionine-β-synthase; lentiviral vector
国家自然科学基金资助项目(81200986);国家级大学生创新创业训练计划项目(201310555196)。
尹蔚兰(1973-),女,硕士,在读博士,副教授,主要研究方向为神经退行性疾病发病机制及防治。E-mail: nhuwayland@126.com
简介:邬力祥(1957-),男,博士,教授,主要研究方向为神经元保护和脑重大疾病。E-mail: ywlx@csu.edu.cn
10.3969/j.issn.1002-266X.2016.26.005
Q782
A
1002-266X(2016)26-0017-03
2016-04-18)

