代谢组学技术比较肝豆灵片与青霉胺的排铜机制
蒋怀周, 王 键, 董继扬, 刘 磊
(1.安徽中医药大学中医临床学院,安徽合肥230031;2.厦门大学电子科学系,福建省等离子体与磁共振研究重点实验室,福建厦门361005;3.亳州市人民医院神经内二科,安徽亳州236800)
代谢组学技术比较肝豆灵片与青霉胺的排铜机制
蒋怀周1, 王 键1, 董继扬2, 刘 磊3
(1.安徽中医药大学中医临床学院,安徽合肥230031;2.厦门大学电子科学系,福建省等离子体与磁共振研究重点实验室,福建厦门361005;3.亳州市人民医院神经内二科,安徽亳州236800)
摘要:目的 探讨肝豆灵片(大黄、黄芩、黄连、半枝莲等)和青霉胺对大鼠的代谢物,以比较两者排铜机制异同。方法 适应性饲养1周后,大鼠被随机分为对照组、模型组、肝豆灵组、青霉胺组。造模结束后,取各组大鼠血清样品分析其核磁共振谱峰。结果 模型组大鼠血清乳酸、糖蛋白、肌酸、肌酐、谷氨酰胺、精氨酸的量升高,葡萄糖、甜菜碱、胆碱、磷酸胆碱、脂质的量降低;青霉胺组大鼠血清葡萄糖、甜菜碱、胆碱、胆碱磷酸、脂质的量升高,糖蛋白、乳酸、肌酸、肌酐、谷氨酰胺的量降低;肝豆灵组大鼠血清3-羟基丁酸、亮氨酸、异亮氨酸、缬氨酸、胆碱、胆碱磷酸、葡萄糖、脂质的量升高,谷氨酰胺、乳酸、肌酸、肌酐、精氨酸的量降低。结论 青霉胺与肝豆灵均可明显调节铜负荷大鼠的葡萄糖、乳酸、肌酸、肌酐、胆碱、磷酸胆碱、谷氨酰胺和脂质向正常范围回归的趋势。而肝豆灵片还可调节鸟氨酸循环、支链氨基酸、3-羟基丁酸及氨的代谢。
关键词:肝豆灵片;青霉胺;代谢组学;血清;核磁共振谱(1H-NMR);排铜机制
Com parison ofmechanism for copper-excretion between Gandouling Tablets and penicillam ine by metabonom ics
JIANG Huai-zhou1, WANG Jian1, DONG Ji-yang2, LIU Lei3
(1.School of Traditional Chinese Medicine,Anhui University of ChineseMedicine,Hefei23OO31,China;2.Department of Electronic Science,Fujian Provincial Key Laboratory of Plasma and Magnetic Resonance;Xiamen University,Xiamen 361OO5,China;3.The 2ndNeurology Department,The People's Hospital of Bozhou City,Bozhou 2368OO,China)
ABSTRACT:AIM To app1y metabonomics to the exp1oration of differences in mechanism for copper-excretion between Gandou1ing Tab1ets(Rheum officinale Bai11.,Scutellaria baicalensis Georgi,Coptis chinensis Franch.,Scutellaria barbata D.Don,etc.)and penici11amine.METHODS After adaptive breeding for one week,the tested rats were random1y divided into four groups,inc1uding contro1,mode1,Gandou1ing Tab1ets and penici11amine group.Aftermode1ing,the sera of a11groupswere ana1yzed by1H-NMR spectroscopy.RESULTS The mode1 group showed increased 1eve1s of 1actate,g1utamine,g1ycoprotein,creatine,creatinine and arginine,together with decreased 1eve1s of g1ucose,betaine,cho1ine,phosphocho1ine and 1ipid.Penici11amine group had increased 1eve1s of g1ucose,betaine,cho1ine,phosphocho1ine and 1ipid,togetherwith decreased 1eve1s of g1utamine,g1ycoprotein,1actate,creatine and creatinine.Whi1e Gandou1ing Tab1ets increased 3-hydroxybutyrate,1eucine,iso1eucine,va1ine,cho1ine,phosphocho1ine,g1ucose and 1ipid,but decreased g1utamine,1actate,creatine,creatinine and arginine.CONCLUSION There is a simi1arity ofmechanism for copper excretion between Gandou1ing Tab1ets and penici11amine,main1y in the metabo1ic regu1ation of g1utamine,1actate,creatine,creatinine,g1ucose,cho1ine,phosphocho1ine and 1ipid returning to norma1.Moreover,Gandou1ing Tab1ets can regu1ate themetabo1isms of ornithine cyc1e,3-hydroxybutyric acid and branched chain amino acids.
KEY WORDS:Gandou1ing Tab1ets;penici11amine;metabonomics;serum;1H nuc1ear magnetic resonance (1H-NMR);copper-excretion mechanism
Wi1son病(Wi1son's disease,WD)于1912年被英国神经病学家Samue1A1exander Kinnier Wi1son首次报道,并因而得名。该病系铜代谢障碍疾病,过量的铜沉积于患者体内,累及多系统、多器官,引起一系列临床表现,如:肝硬化、肾损伤、肌张力障碍、肢体震颤、语言含糊、角膜K-F环等。如不积极治疗,可对患者的生活能力产生严重的影响,甚至导致死亡。西医治疗本病以排铜为主,重金属络合剂青霉胺(penici11amine,PA)是其首选口服药。中医从整体角度治疗本病,亦具一定优势。其中,肝豆灵片是安徽中医药大学第一附属医院院内制剂,多年的临床应用及科研证明,该方治疗WD不仅安全有效,还具有保护肝脏、改善该病患者神经功能的效果[1-2]。本实验以核磁共振(nuc1earmagnetic resonance,NMR)代谢组学为研究方法,初步探讨肝豆灵和青霉胺的排铜机制异同。
1 材料及方法
1.1 动物 44只无特定病原体级别(specified pathogen free,SPF)Wistar大鼠,3月龄,体质量160~200 g,购于安徽医科大学实验动物中心,实验动物许可证号:SCXK(皖)2011-002,饲养于安徽中医药大学省部共建新安医学教育部重点实验室,室温20~22℃,相对湿度40%~60%。
1.2 药物、主要试剂和仪器 肝豆灵片(安徽中医药大学第一附属医院院内制剂,0.3 g/片,批号:皖药制字Z20050071),由生大黄Rheum officinale Bai11.、黄芩Scutellaria baicalensis Georgi、黄连Coptis chinensis Franch.、半枝莲Scutellaria barbata D.Don、穿心莲Andrographis paniculata Nees、泽泻Alisma orientalis Juzep.、萆薢Dioscorea septem loba Thunb.、金钱草Lysimachia christinae Hance、石菖蒲Acorus tatarinowii Schott、丹参Salvia miltiorrhiza Bge、姜黄Curcuma longa L.、莪术Curcuma phaeocaulis Va1.、鸡血藤Spatholobus suberectus Dunn、郁金Curcuma weuyujin Y.H.Chen et C.Ling组成。制备工艺:按处方比例称取药材,以70%乙醇回流提取2次,第一次10倍量1.5 h,第二次8倍量1.0 h,药渣加8倍量水再提取1次,分别减压浓缩药液至一定浓度、混合、真空减压干燥,得干浸膏,再加入淀粉、单糖浆和硬脂酸镁等辅料,压片,规格0.3 g/片。质控标准为高效液相色谱(high performance 1iquid chromatography,HPLC)法测定盐酸小檗碱的量,以其含有量不低于0.5%为合格。青霉胺(上海信谊药厂有限公司,规格0.125 g/片,国药准字H31022286)。
氘代重水(deuterium oxide,D2O,美国CILantro公司);3-三甲基硅基-1-丙磺酸钠(3-trimethy1si1y1-1-propane su1fonic acid sodium sa1t,DSS,美国Sigma公司);硫酸铜(国药集团化学试剂有限公司);乙醚(上海苏懿化学试剂有限公司);GL-20A全自动冷冻高速离心机(湖南仪器仪表总厂);Varian 500 MHz超导NMR谱仪(美国安捷伦公司)。
1.3 模型制备 适应性饲养1周后,大鼠被随机分为四组:对照组、模型组、青霉胺组、肝豆灵组,每组11只。对照组始终自由进食、摄水,其余3组以铜负荷法[3]造模:连续12周喂饲含硫酸铜的饲料(1 g/kg)和水(0.185%)。自第7周开始,分别以肝豆灵(0.486 g.kg-1.d-1)和青霉胺(0.09 g.kg-1.d-1)灌胃肝豆灵组、青霉胺组大鼠,对照组和模型组以等容量生理盐水(0.9% NS)灌胃,直至造模结束。
1.4 取材及检测[4]第12周造模结束后,大鼠禁食12 h,乙醚吸入法麻醉,经腹主动脉采集新鲜血液,4℃低温离心10 min(3 000 r/min)取上清液,-80℃超低温冰箱储存血清,以备NMR代谢组学检测。核磁检测时,常温解冻血清,将400 μL血清与200 μL磷酸盐缓冲液(0.2 mo1/L Na2HPO4/NaH2PO4,99.9% D2O)混合,调整溶液酸碱度至7.4,以消除酸碱度变化对实验的影响,加入3-三甲基硅丙烷磺酸钠(DSS)作为化学位移零点的定标,震荡混合均匀后,4℃低温离心10min(10 000 r/min),取550 μL上清液移入5 mm NMR管,以采集样品的1H-NMR谱。实验采用5 mm HCN三共振探头,温度300 K,谱宽5 kHz,信号累加256次,采用NOEPR-CPMG脉冲序列进行数据采样。其中,预饱和模块、自旋回波模块分别抑制水峰信号和蛋白、脂蛋白所产生的宽峰。结果见图1。
1.5 谱图处理和统计学方法[4]采用MestreNova 9.0软件对所有谱图进行相位调整、校正基线和谱峰对齐。以0.02为等间隔对化学位移δ0.2~4.6区域进行分段积分,得到一个数据矩阵。矩阵的每一行和每一列分别代表一个样本和一个积分段,用面归一化方法对数据矩阵进行归一化,以主成分分析法(principa1 component ana1ysis,PCA)对所得数据进行分析,结果见图2~5。
2 实验结果
2.1 大鼠一般状况观察 正常组大鼠始终状态佳,作息规律,皮毛光滑润泽,食欲及二便正常。造模2周后,模型组、两给药组大鼠逐渐出现活动减少,饮食摄水减少,精神不振,体质量增加不明显,皮毛光泽差,大便不成形,小便减少表现。药物干预后,与模型组相比,肝豆灵和青霉胺组大鼠摄水饮食量增加,精神不振状况改善,大便稍成形,小便量增多。
2.2 大鼠血清典型1H-NMR谱 见图1。

图1 大鼠血清样品典型1 H-NMR谱Fig.1 Typical1H-NMR spectrum of serum sam ples in rats
2.3 血清1H-NMR谱图处理结果 对数据的PCA分析结果如图2~5所示。得分图(图2A~5A)中,每一个圆点和三角分别代表不同组别的每一个样品。对照组和模型组、模型组和肝豆灵组、模型组和青霉胺组,分布于两个不同的区域,能明显地区分开,说明这些两两对比的组间代谢物有差异,造模成功。负载图(图2B~5B)的每个点代表谱图上的一个谱峰段,偏离零点越远的点,对两组的分类贡献越大,越有可能是潜在的组间差异代谢物。其中,图2B中,169这个点代表的是乳酸峰,它离零点最远,对分类贡献最大,提示模型组血清乳酸水平升高显著,而且遮掩了其它谱峰。为寻找更多的血清差异代谢物,我们将乳酸峰去除后再做主成分分析,结果见图3。图3A可见,去除乳酸峰后,对照组和模型组样本仍分布于不同区域。
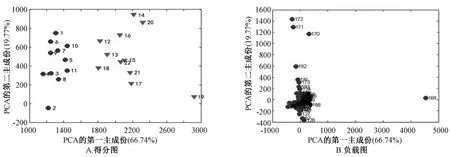
图2 对照组、模型组得分图和负载图Fig.2 PCA models of1H-NMR metabolom ics data for the control group and model group
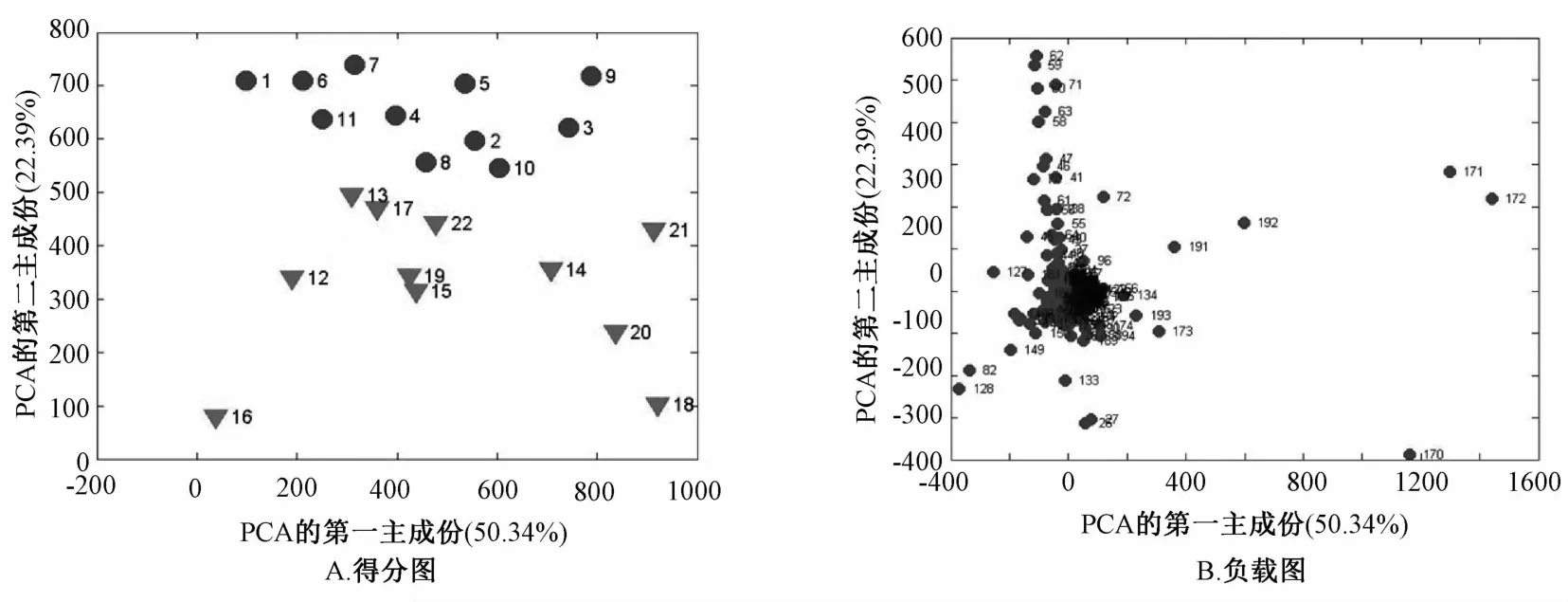
图3 去除乳酸峰后,对照组、模型组得分图和负载图Fig.3 PCA models of1H-NMR metabolom ics data for the control group and model group w ithout lactate peak
对比模型组与对照组、肝豆灵组与模型组、青霉胺组与模型组,我们找出3组对分类贡献比较大的代谢物,并将这些代谢物、化学位移及其相应变化列出(表1),包括3-羟基丁酸(δ1.20)、谷氨酰胺(δ2.12)、糖蛋白(δ2.04)、乳酸(δ1.32,δ4.10)、亮氨酸(δ0.94)、异亮氨酸(δ0.93,δ1.0)、缬氨酸(δ0.97,δ1.02)、肌酸(δ3.04)、肌氨酸酐(δ3.05)、葡萄糖(δ3.23~3.80)、甜菜碱(δ3.25)、胆碱(δ3.19)、磷酸胆碱(δ3.21)、精氨酸(δ1.71)、脂质(δ1.29~1.30)。表1中,“↑↑”和“↑”表示代谢物的量升高,且具有统计学意义(↑↑,P<0.01;↑,P<0.05);“↓↓”和“↓”表示代谢物的量降低,且具有统计学意义(↓↓,P<0.01;↓,P<0.05);“-”表示代谢物的量变化无统计学意义(P>0.05)。
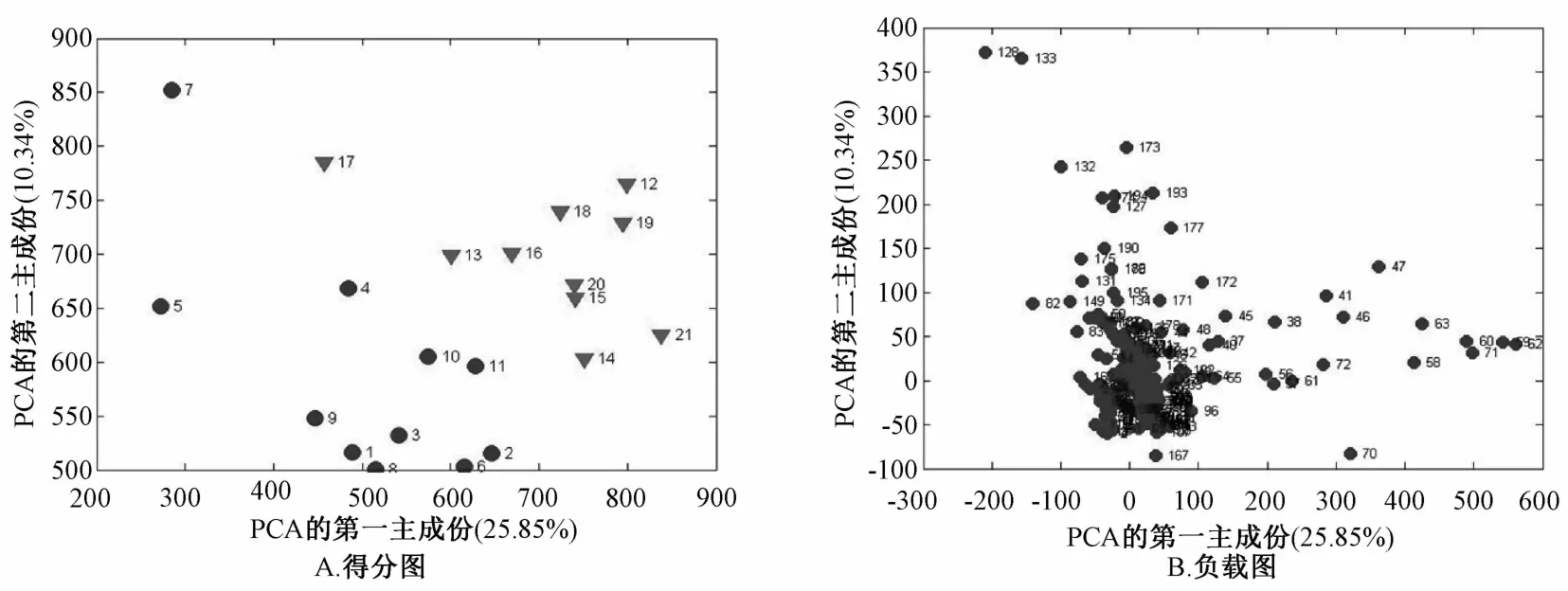
图4 模型组、肝豆灵组得分图和负载图Fig.4 PCA models of1H-NMR m etabolom ics data for them odel group and Gandouling Tablets group

图5 模型组、青霉胺组得分图和负载图Fig.5 PCA models of1H-NMR metabolom ics data for the penicillam ine group and model group

表1 大鼠血清特征代谢物Tab.1 Typical serum metabolites in rats
3 讨论
正常人自饮食摄入的铜约为2.5~5 mg/d。铜被肠道吸收后,先与白蛋白疏松结合并进入肝脏,在肝细胞中,铜与a-2球蛋白牢固结合形成铜蓝蛋白,后者具有氧化酶活性。目前,WD的发病机制尚未完全明确,但似乎涉及铜与前铜蓝蛋白结合形成转运蛋白铜蓝蛋白减少,未经结合的铜大量进入血循环,沉积在以肝、脑、肾和角膜组织为主的全身各脏器,引起一系列临床症状。自从John Wa1she于1956年提倡以青霉胺治疗WD以来,该药一直是WD的首选口服药。青霉胺含N、O、S配位原子,是铜的络合剂,可络合血液和组织中过多的游离铜,形成稳定的水溶性复合物经小便排出,从而阻止铜在体内继续沉积,恢复机体正常的生理功能。中医治疗本病,根据患者多具肢体震颤僵直、口渴烦热、口苦口臭、鼻衄、齿衄、黄疸、肝部癥积、小便短赤、舌质红、苔黄或者黄腻、脉弦滑或者弦数等表现,杨任民、张笑平综合分析认为本病病机要点为肝胆湿热、阻滞血络、瘀浊互结,治当以清热利湿通腑、行气化瘀散结之方,组方肝豆汤治疗本病,肝豆灵片是其优化组合片剂。其中,大黄清热通腑,荡涤热结;黄连、黄芩、半枝莲、穿心莲苦寒清热,泻火解毒;萆薢、泽泻、金钱草、石菖蒲泻热通淋、利湿祛浊;丹参、姜黄、莪术、鸡血藤、郁金活血行气、祛瘀散结。全方以祛邪为主,共奏清热利湿通腑、行气化瘀散结之功。本方虽不是铜的络合剂,但多年的临床及科研反复验证,确具排铜作用[5-7]。
本实验模型组大鼠血清乳酸、谷氨酰胺、糖蛋白、肌酸、肌酐、精氨酸水平升高,葡萄糖、甜菜碱、胆碱、磷酸胆碱、脂质水平降低,提示铜在机体过度沉积涉及胆碱、糖、氨基酸、脂质等代谢,对肝脏、肾脏和神经等多种组织器官产生影响,与临床报道相符合。
铜参与生物体诸多酶的合成,其中包括处于线粒体呼吸链末端的细胞色素C氧化酶。虽然机理尚未阐明,但铜过量沉积可影响呼吸链,使有氧呼吸发生障碍,无氧代谢增加,导致乳酸升高[8]。糖蛋白主要分布在细胞表面、细胞内分泌颗粒和细胞核内,也可被分泌出细胞构成细胞外基质成分,是重要的生物信息分子,在生理和病理过程中起到生物识别的作用。酶的水解作用可以使糖蛋白糖链次末端的半乳糖暴露,被肝细胞识别,通过胞饮作用进入肝细胞被分解。肝脏是铜沉积所损伤的重要器官,模型大鼠糖蛋白水平增高,可能与肝损伤、肝细胞无法正常分解糖蛋白有关。
铜过量可通过活性氧族介导的氧化应激,引起细胞膜性结构通透性增加,导致细胞凋亡。胆碱在胆碱激酶的催化下合成磷酸胆碱,二者参与磷脂代谢,是细胞膜性结构的重要组成部分,对维持正常的细胞周期、通透性和信息传递起着重要作用。以代谢组学对肝细胞凋亡进行研究,发现胆碱的量随肝细胞凋亡的严重程度而下降[9]。此外,胆碱是生物体重要的甲基供体,在提供甲基时,胆碱在胆碱脱氢酶、甜菜醛脱氢酶的作用下先氧化生成甜菜碱,再由甜菜碱提供甲基。由于甲基在神经、内分泌、泌尿和免疫等系统中具有十分重要的作用,所以稳定的甲基供体对于生物体来说非常重要。模型组胆碱、磷酸胆碱和甜菜碱的量降低,提示铜过量可能影响了大鼠的磷脂代谢和甲基代谢。
模型组血清精氨酸和谷氨酰胺的增高,可能与氨的代谢紊乱有关:肝脏是机体最大的氨代谢器官,肾脏是排泄氨的重要场所。氨在肝脏通过精氨酸参与的鸟氨酸循环,代谢为无毒的尿素经肾脏排出。肾脏不仅排出尿素,还以NH4+的形式排出大量的氨。铜沉积引起肝功能受损鸟氨酸循环障碍,或肾小管受损导致氨的排泄受阻,都有可能引起血氨增高。氨在ATP的供能条件下,结合a-酮戊二酸和谷氨酸,生成谷氨酰胺。在代谢组学中,谷氨酰胺是评估肝损伤和肝性脑病的一个指标[10]。同时,它与神经系统的功能密切相关,有学者经实验分析认为,它有可能成为中枢神经毒性检测的标志物[11]。
肌酸由甘氨酸、S-腺苷甲硫氨酸、精氨酸合成,其最终产物为肌酐并随尿排出。若肾功能发生障碍,肌酐排出受阻,则血中肌酐水平升高。临床上,血肌酐水平的测定有助于了解肾功能。本实验铜负荷大鼠血肌酐升高,符合传统生化检测结果,提示铜中毒对大鼠肾功能有所损害。
比较青霉胺和肝豆灵片,两者对于铜负荷大鼠的排铜机制具有异同点。相同点主要体现在调节乳酸、肌酸、肌酐、葡萄糖、胆碱、磷酸胆碱、谷氨酰胺和脂质的代谢,使其具有向正常范围回归的趋势。不同点是:1、青霉胺还可升高甜菜碱、降低糖蛋白水平。甜菜碱是机体重要的甲基供体,糖蛋白参与细胞信号识别,与诸多疾病的发病机理密切相关[12]。结合其它代谢物的变化,青霉胺的排铜机制除涉及胆碱、葡萄糖、脂、氨基酸等代谢之外,可能还与调节甲基代谢、调整某些细胞信号识别有关。2、肝豆灵所涉及的代谢物较多,这与中药方剂的多靶点调节或许有关。相对于青霉胺组,肝豆灵组的不同主要体现在精氨酸水平降低,3-羟基丁酸、亮氨酸、异亮氨酸、缬氨酸水平升高。综合肝豆灵对精氨酸、谷氨酰胺水平的调节,可能提示其对鸟氨酸循环的恢复起到一定的促进作用。3-羟基丁酸可促进神经干细胞分化为神经元[13],能不同程度的抑制神经胶质细胞凋亡、促进其生长,是神经胶质细胞的能量源之一[14]。神经胶质细胞对神经元具有支持、保护、营养和修复等作用,对神经系统的生理起着十分重要的作用。
异亮氨酸、亮氨酸和缬氨酸为支链氨基酸,它们可保护肝脏[15]、维持神经系统生化功能,促进受损神经再生[16],有助于恢复认知和记忆力障碍[17-18]。异亮氨酸可促进细胞生长,它和亮氨酸还是重要的营养剂,具有促进蛋白质合成、提高免疫力等生理功能[19]。模型组和青霉胺组均无支链氨基酸、3-羟基丁酸的变化,因此我们推测,肝豆灵有可能具有补充或者调节这四种氨基酸代谢的作用。综合以上分析,肝豆灵在恢复铜负荷大鼠小分子代谢的同时,可能还通过调节鸟氨酸循环、支链氨基酸、3-羟基丁酸的代谢,干预铜沉积所造成的大鼠肝脏和神经系统损伤。此结果与肝豆灵片可改善WD患者神经功能、保肝等临床研究结论[1-2]相吻合,或可初步解释此临床治疗机制。
本实验运用NMR代谢组学技术对青霉胺和肝豆灵片干预铜负荷大鼠进行了比较和分析,发现青霉胺和肝豆灵片的排铜机制具有异同点,可为以后对WD的研究和治疗提供一定的参考。
参考文献:
[1] 韩 辉,杨文明,张 娟,等.肝豆灵片对肝豆状核变性患者神经功能的影响[J].中医药临床杂志,2013,25 (11):1016-1017.
[2] 王艳昕,周 导,鲍远程,等.肝豆灵联合驱铜治疗对肝豆状核变性肝纤维化疗效及其血清指标的影响[J].中医药临床杂志,2013,25(8):694-697.
[3] 方 向,鲍远程,金 珊,等.铜对大鼠学习记忆和海马区p-ERK表达的影响[J].现代中西医结合杂志,2013,22(19):2064-2069.
[4] 沈桂平,戴晓侠,邓伶莉,等.家族性甲亢患者血清和尿液的核磁共振代谢组学研究[J].高等化学学报,2013,34(10):2290-2295.
[5] 汤其强,杨任民,韩咏竹,等.肝豆汤对肝豆状核变性皮肤成纤维细胞模型铜代谢的影响[J].中国中西医结合杂志,2000,20(1):37-39.
[6] 杨 波,鲍远程,谢道俊,等.肝豆状核变性65例5年疗效随访报告[J].中医药临床杂志,2010,22(11):965-966.
[7] 张 波,江婷战,王晓旸,等.肝豆灵及谷胱甘肽口服液治疗肝豆状核变性临床研究[J].中国中医急症,2010,19(5):760-763.
[8] Scheiber IF,Dringen R.Copper acce1erates g1yco1ytic f1ux in cu1tured astrocytes[J]. Neurochem Res,2011,36(5):894-903.
[9] Shen ZW,Cao Z,You K Z,et al.Quantification of cho1ine concentration fo11owing 1iver ce11 apoptosis using1H magnetic resonance spectroscopy[J].World JGastroenterol,2012,18 (10):1130-1136.
[10] 齐素文,戴 勇,欧阳昕,等.轻微肝性脑病患者血清中代谢组的研究[J].第三军医大学学报,2011,33(23):2503 -2507.
[11] 姚 欣.KCN慢性毒性及神经毒性机制研究[D].上海:第二军医大学,2012.
[12] 杨刚龙.肝细胞癌患者血清糖蛋白质组及其糖链结构研究[D].西安:西北大学,2013.
[13] 卢晓云,杨志倩,吕海侠,等.3-羟基丁酸对体外培养大鼠皮质神经干细胞增值分化的影响[J].西安交通大学学报:医学版,2012,33(6):689-692.
[14] Xiao X Q,Zhao Y,Chen GQ,et al.The effectof3-hydroxybutyrate and its derivativeson the growth of g1ia1ce11s[J].Biomaterials,2007,28(25):3608-3616.
[15] Tajiri K,Shimizu Y.Branched-chain aminoacids in 1iver diseases[J].World JGastroenterol,2013,19(43):7620-7629.
[16] 王 涛.嗅鞘细胞和支链氨基酸对视神经损伤的修复作用[D].西安:第四军医大学,2012.
[17] Co1e J T,Mita1a C M,Kundu S,et al.Dietary branched chain amino acids ame1iorate injury-induced cognitive impairment[J]. Proc Natl Acad Sci USA,2010,107(1):366-371.
[18] Aqui1ani R,Bose11i M,Boschi F,et al.Branched-chain amino acids may improve recovery from a vegetative or minima11y conscious state in patients with traumatic brain injury:a pi1ot study[J].Arch PhysMed Rehabil,2008,89(9):1642-1647.
[19] 吕子全,郭非凡.内源性代谢分子——亮氨酸调节机体生理功能[J].生理科学进展,2012,43(5):337-340.
作者简介:蒋怀周(1978—),女,博士,讲师,从事中医教学工作。Te1:(0551)65169165,E-mai1:jhz1inda@hotmai1.com
基金项目:国家自然科学基金青年基金资助(81202691);安徽省高校自然科学基金重点项目(KJ2012Z228);安徽省高校博士后岗位项目(2013年)
收稿日期:2015-06-11
doi:10.3969/j.issn.1001-1528.2016.01.003
中图分类号:R285.5
文献标志码:A
文章编号:1001-1528(2016)01-0012-07

