家蚕传染性软化病病毒荧光定量PCR检测技术及浙江省流行病学调查
董 强 鲁兴萌 吴 姗
(1浙江大学动物科学学院,浙江杭州 310058; 2浙江省检验检疫科学技术研究院,浙江杭州 310016)
家蚕传染性软化病病毒荧光定量PCR检测技术及浙江省流行病学调查
董 强1鲁兴萌1吴 姗2
(1浙江大学动物科学学院,浙江杭州 310058;2浙江省检验检疫科学技术研究院,浙江杭州 310016)
荧光定量PCR检测技术可实现对病原微生物的早期或快速检测,根据家蚕传染性软化病病毒(BmIFV)的RNA序列,设计了具有物种特异性的引物和探针,建立了荧光PCR检测BmIFV的方法。将设计的引物和探针同时对BmIFV、家蚕微孢子虫(Nb)、家蚕核型多角体病毒(BmNPV)、家蚕浓核病病毒(BmDNV)和桑叶进行特异性验证,结果显示只有BmIFV得到阳性结果。该方法对含BmIFV目标片段质粒的检测灵敏度达10-3ng/μL,对目标病毒的检测灵敏度为3.4 ng/μL。同时,对浙江省嘉兴市秀洲区、湖州市南浔区、嘉兴市桐乡市、嘉兴市海宁市、杭州市淳安县5个蚕区家蚕感染BmIFV情况进行了流行病学调查,结果显示这5个蚕区BmIFV感染率约为3.6%,为浙江省家蚕传染性软化病防治提供参考。
家蚕;家蚕传染性软化病病毒;荧光定量PCR;引物和探针;流行病学
家蚕传染性软化病(Bombyx mori infectious flacherie)是由家蚕传染性软化病病毒(Bombyx mori infectious flacherie virus,BmIFV)引起的一种传染性蚕病,病蚕一般表现为空头、体缩和迟眠等外部病症。该病是蚕业生产上一种主要的病毒病,在印度主产区卡纳塔克邦(Karnataka),约有47.9%的养蚕损失是由该病引起的[1];在日本,病毒性软化病亦被认为是日本养蚕生产中造成损失的一个主要因素[2]。1926年,法国学者PAILLOT最早提出家蚕的软化病由病毒所引起,链球菌属(Streptococcus)和杆菌属(Bacillus)细菌只是二次侵染菌[3]。1960年,日本学者山崎寿等从大量发生软化病的长野县农家收集病蚕,并通过添食试验认为该病是由病毒引起的病毒性软化病[4]。以后AIZAWA等[5]从蚕体对该病毒进行了分离纯化并作了超微形态的观察。进一步研究证明BmIFV属细小核糖核酸病毒科(Picornaviridae),为线性单链RNA病毒[2,6],是造成家蚕发生病毒性软化病的病原体。
显微镜已被广泛用于家蚕病原微生物的检测,但由于BmIFV是非包涵体病毒,在普通光学显微镜下无法看到病毒粒子,而且BmIFV对家蚕所引起的病症与家蚕浓核病病毒(Bombyx mori densonucleosis virus,BmDNV)及细菌引起的病症相似[7-8],因此用肉眼和普通光学显微镜无法对其确诊。应用血清学鉴别法鉴别家蚕传染性软化病虽具有特异性强、灵敏度高的特点,但也存在比较高的交叉反应与非特异性反应[9-10]。
本研究建立了1种荧光PCR对BmIFV的检测方法,并对该方法的特异性、灵敏度进行了验证。并应用该方法对浙江省的嘉兴市秀洲区、湖州市南浔区、嘉兴市桐乡市、嘉兴市海宁市、杭州市淳安县等5个蚕区生产上家蚕传染性软化病的感染现状进行了抽查。
1 材料和方法
1.1 试验材料
1.1.1 引物和探针设计 基于BmIFV的RNA序列(GenBank序列号:HM245295.1,HM569717.1,EU868609.1,EF422866.1,AB000906.1),根据引物设计原则,利用 PRIMER EXPRESS软件设计了BmIFV的“印度株”、“日本株”和“浙江株”3个株系的通用引物和探针1组(表1)。

表1 检测家蚕传染性软化病病毒(BmIFV)的引物和探针
1.1.2 试验样本 (1)供试病原体。BmIFV、家蚕微孢子虫(Nosema bombycis,Nb)、家蚕核型多角体病毒(Bombyx mori nuclear polyhedrosis virus,BmNPV)、BmDNV均为纯化的病原体,由浙江大学蚕蜂研究所保存和提供。(2)流行性病学调查样品。2015年5月至10月分别从浙江省嘉兴市秀洲区、湖州市南浔区、嘉兴市桐乡市、嘉兴市海宁市、杭州市淳安县等蚕区采集到发育相对较慢的3龄蚕样60个、5龄蚕样96个及蚕蛹样9个。
1.1.3 供试试剂 RNA抽提试剂盒UNIQ-10,为生工生物工程(上海)股份有限公司 (中国)产品。DNase I、反转录试剂盒(a First-Strand cDNA Synthesis Kit)、PCR ExBuff、dNTP(2.5 pmol/μL)、MgCl2(25 pmol/μL)、ExTaq(5 U/μL)、Premix Ex Taq、PMD18-T载体,均为宝生物工程(大连)有限公司(中国)产品。DNA抽提试剂盒FF3750,为Promega Corporation(美国)产品。液氮,为杭州今工特种气体有限公司(中国)产品。
1.1.4 仪器设备 PTC-200普通PCR仪,MJ Research Inc(美国)产品;PowerPac电泳仪,Bio-Rad Laboratories Inc(美国)产品;Lightcycle 480荧光定量PCR仪,Roche Group(美国)产品。
1.2 试验方法
1.2.1 流行性病学调查样品的采集及处理 将
1.1.2 项“(2)流行性病学调查样品”中的每个蚕样或蛹样分别取中肠组织和蛹中肠痕迹在液氮中充分研磨,取研磨粉碎后的样品0.2 g,使用RNA抽提试剂盒UNIQ-10进行RNA抽提,抽提后的RNA用DNase I处理。
1.2.2 BmIFV RNA的提取及BmIFV cDNA合成(1)纯BmIFV RNA的提取。取100 μL纯BmIFV,使用RNA抽提试剂盒UNIQ-10进行RNA抽提,抽提后得到的RNA用DNase I处理。(2)BmIFV cDNA的合成。取上述纯BmIFV抽提得到的RNA 10 μL,利用反转录试剂盒将BmIFV的RNA反转录成BmIFV cDNA,然后将BmIFV cDNA稀释5倍后用于Real-Time PCR检测。
综上所述,在初中数学课堂中要想实现学生自主探究能力培养这一目的,教师在教学过程中一定要意识到其重要性,然后在教学过程中积极为学生创设问题情境、展开小组讨论、巧设分层练习,以此来真正引导学生参与到探究课程之中,最终也就能够让学生在自主探究与思考中得到更为全面的发展和进步。
1.2.3 质粒的制备 应用表 1中的引物,对用BmIFV的RNA合成得到的BmIFV cDNA样本进行普通PCR扩增,反应体系如下:2.5 μL PCR ExBuff,2 μL dNTP(2.5 pmol/μL),2 μL MgCl2(25.0 pmol/ μL),0.5 μL正向引物(10.0 pmol/μL),0.5μL反向引物(10.0 pmol/μL),0.125 μL ExTaq(5 U/μL),1 μL BmIFV cDNA,加ddH2O补足至25.0 μL。普通PCR程序如下:94℃,5 min;94℃,30 sec; 60℃,60 sec;72℃,45 sec,40个循环;72℃延伸10 min。将PCR扩增产物进行凝胶电泳,并割胶回收,将PCR产物纯化后,将其克隆至PMD18-T载体上,获得含有目的DNA片段的质粒。
1.2.4 DNA提取 Nb、BmNPV和BmDNV的遗传物质都是DNA,因此对它们分别进行了DNA的提取,程序如下:分别取100 μL的 Nb、BmNPV和BmDNV样品,使用DNA抽提试剂盒FF3750,按照说明书进行抽提,抽提后得到的 Nb、BmNPV和BmDNV的DNA分别溶解在20 μL ddH2O中。
1.2.5 实时荧光定量PCR扩增检测 实时荧光定量PCR反应体系如下:10.0 μL Premix Ex Taq,上游引物(10 pmol/μL)0.4 μL,下游引物(10 pmol/μL) 0.4 μL,探针(10 pmol/μL)0.4 μL,1.2.2项“(2) BmIFV cDNA的合成”中稀释5倍后的BmIFV cDNA液1.0 μL,用ddH2O补足体积至20.0 μL。应用荧光定量PCR仪lightcycle 480进行反应,反应程序如下: 95℃,10 sec;95℃,5 sec;60℃,23 sec;40个循环。
1.2.6 标准曲线的绘制 为检测荧光定量PCR检测体系的检出限和线性范围,分别对BmIFV cDNA和含有BmIFV目标核酸片段的质粒进行5倍和10倍梯度稀释,并利用DNA浓度和Ct值之间的相关性绘制标准曲线。变量相关性公式[11]如下:Ct= blog(DNA浓度)+a,其中b是斜率,a是截距。
1.2.7 引物探针特异性验证 将设计得到的引物和探针在 NCBI上进行 BLAST验证(http://blast.ncbi.nlm.nih.gov/)。
2 结果与分析
2.1 引物探针特异性验证及实时荧光定量PCR法特异性验证结果
将设计得到的引物和探针进行BLAST验证,验证结果显示,不论引物还是探针,与之完全匹配的碱基序列都显示为“传染性软化病病毒”的序列,保证了引物探针的高特异性。

表2 实时荧光定量PCR法特异性验证
2.2 实时荧光定量PCR法灵敏度验证
将反转录得到的单链BmIFV cDNA进行5倍梯度稀释检测引物探针的灵敏度,结果显示,BmIFV cDNA浓度≥3.4 ng/μL时,得到的标准曲线的R2值大于0.99,理论上,该浓度以上的检测结果较为可靠(图1);当把BmIFV cDNA浓度为0.7 ng/μL的检测结果也统计在内时,R2值降至0.97左右(图2),其检测结果的可信度有所下降(表3,图1-2)。此外,我们构建了含BmIFV目标核酸片段的质粒,将构建的含BmIFV目标核酸片段的质粒进行10倍梯度稀释检测引物探针的灵敏度,结果显示,引物探针对构建的含BmIFV目标核酸片段的质粒的检测灵敏度可达到10-3ng/μL,当将构建的含BmIFV目标核酸片段的质粒稀释到10-4ng/μL时,Ct值大于35,结果不可靠(表4,图3)。
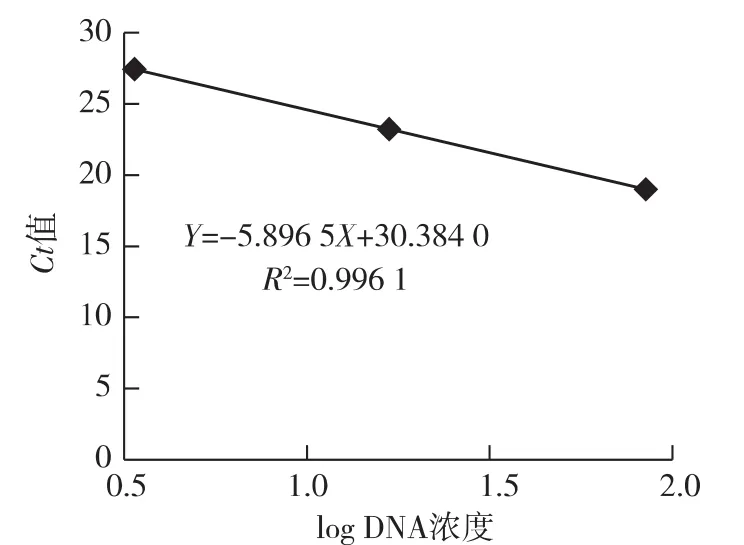
图1 BmIFV cDNA浓度(cDNA浓度≥3.4 ng/μL)和Ct值相关性曲线

图2 BmIFV cDNA浓度(cDNA浓度≥0.7 ng/μL)和Ct值相关性曲线

表3 实时荧光定量PCR法对BmIFV cDNA检测的灵敏度

表4 实时荧光定量PCR法对质粒检测的灵敏度
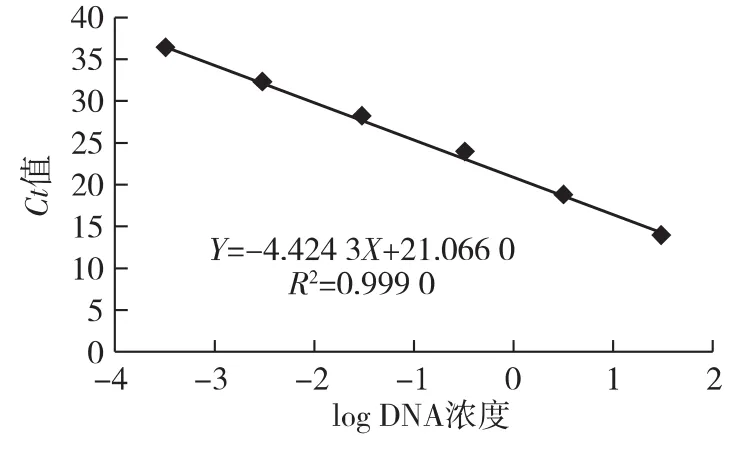
图3 含BmIFV目标核酸片段的质粒DNA浓度和Ct值相关性曲线
2.3 浙江省内5个蚕区的BmIFV流行病学调查结果
由表5可知,2015年春季和秋季,分别从浙江省的嘉兴市秀洲区、湖州市南浔区、嘉兴市桐乡市、嘉兴市海宁市、杭州市淳安县等5个蚕区抽取家蚕样本共165个(其中3龄和5龄家蚕样本156个,蚕蛹样本9个),用设计的特异性引物探针进行实时荧光定量PCR检测。家蚕幼虫样本检测结果全部为阴性,蚕蛹检测出阳性样本6个,综合检出率为3.6%。

表5 浙江省的5个蚕区BmlFV发病率调查
3 讨论
本试验建立的BmIFV实时荧光定量PCR方法,与Nb、BmNPV和BmDNV等家蚕易感染的微生物无交叉反应,与显微镜观察、血清学诊断、荧光抗体检测等方法比较,具有病原特异性好、检测灵敏度高、操作简便(无需制备病毒及抗体)等优点,可以实现对BmIFV的快速检测。
在20世纪70年代日本农林水产省对家蚕病害损失率的调查表明,日本农户养蚕的蚕病损失率为1.7%~3.7%,其中软化病(主要包括家蚕传染性软化病和细菌性肠道病)占66.5%~79.8%[13],从日本养蚕病害流行中可以发现家蚕传染性软化病是一个重要的病种。2004年和2005年,朱宏杰等[9]用从桐乡市抽取的家蚕样本中分离得到的BmIFV毒株制备BmIFV多抗血清,通过用血清学诊断法对浙江蚕区进行了较大规模的BmIFV流行病学调查,疑似病蚕的BmIFV检出率在29%~40%。本次试验调查结果显示,家蚕病毒性软化病的总检出率仅为3.6%,幼虫样本未检出,蚕蛹的检出率达到66.7%,可能与检测方法的特异性高、流行病学调查的样本数量不够多、家蚕传染性软化病的流行和养蚕户的消毒防病及饲养技术水平等有关。
[1]SAVANURMATH C J,BASAVARAJAPPA S,HINCHIGERI S B,et al.Relative incidence of the silkworm viral diseases in Agroclimatic zones of Northern Karnataka,India[J].Bull Sericult Res,1994(5):51-55.
[2]KAWASE S,HASHIMOTO Y,NAKAGAKI M.Characterization of flachere virus of the silkworm Bombyx mori[J].J SericultSci Japan,1980,49(6):477-484.
[3]吕鸿声.昆虫病毒与昆虫病毒病[M].北京:科学出版社,1982: 44-150.
[4]李荣琪,陆雪芳,马德河.家蚕病毒性软化病发生与细菌关系的研究[J].蚕业科学,1981,7(4):19-22.
[5]AIZAWA K,KURUTA Y.Infection under aseptic conditions with the virus of infecious flacherie in the silkworm Bombyx mori[J].Insect Pathology,1964,6(1):130-132.
[6]ISAWA H,ASANO K,SAHARA K,et al.Analysis of genetic information of an insect picorna-like virus,infectious flacherie virus of silkworm:evidence for evolutionary relationships among insect,mammalian and plant picorna(-like)viruses[J].Arch Virol,1998(143):127-143.
[7]WATANABE H.Virus flacherie disease in the silkworm,Bombyx mori[J].J Sericult Sci Japan,1976,45(2):95-106.
[8]鲁兴萌,汪方炜,石彦.对我国养蚕业中传染性软化病的思考[J].蚕桑通报,2002,33(3):6-8.
[9]朱宏杰,赵新华,戴建一,等.家蚕病毒性软化病病毒抗血清的研制及应用[J].蚕桑通报,2006,37(3):16-19.
[10]陆奇能.传染性软化病毒(桐乡株)的nested RT-PCR检测及其RNA聚合酶的克隆和表达[D].杭州:浙江大学,2007.
[11]PEGELS N,GONZLEZ I,LPEZ-CALLEJAI,et al.Evaluation of a TaqMan real-time PCR assay for detection of chicken,turkey,duck,and goose material in highly processed industrial feed samples[J].Poult Sci,2012,91(7):1 709-1 719.
[12]何永强,吴珊,帅江冰,等.家蚕微孢子虫、核型多角体病毒和浓核病毒的三重灾光PCR检测方法及试剂盒和引物、探针: 201210087285.8[P].2015-07-08.
[13]渡部仁.家蚕病毒病的流行病学[M].李奕仁,译.北京:农牧渔业部科技司,1986:12.
S884.5+3
B
1007-0982(2016)04-0045-05
10.16839/j.cnki.zgcy.2016.04.011
2016-07-05;接受日期:2016-09-06
现代农业产业技术体系建设专项(编号 CARS-22);浙江省重大科技专项(编号20lOCl2005-2);浙江出入境检验检疫局科技项目[编号Zl(2006lO)]。
第1作者信息:董强(1984—),男,浙江台州,本科,助理工程师。Tel:0571-81182608,E-mail:baisha122@163.com
信息:吴姗(1976—),女,浙江杭州,博士,高级工程师。Tel:0571-81100364,E-mail:wss_tea@hotmail.com

