GC法测定正电子类放射性药物中有机溶剂残留
郭莘 戴红峰 周硕 陈文新
【摘要】 目的 建立气相色谱(GC)法测定正电子类放射性药物注射剂中有机溶剂残留量的方法。方法 色谱柱为HP-INNOWAX毛细管柱(30 m×0.53 mm, 1μm ), FID检测器, 程序升温, 进样口温度200 ℃, 检测器温度270℃, 载气为氮气。结果 采用顶空内标法, 乙腈、丙酮和乙醇能较好分离, 线性关系良好(r=0.9999、0.9973、0.9988), 平均回收率为99.8%、101.0%、97.5%, RSD值<5%。所测样品中有机溶剂残留符合规定, 与顶空外标法结果基本一致。结论 该方法简便快速, 灵敏度高, 准确可靠, 适用于18F-FDG中残留有机溶剂测定。
【关键词】 气相色谱法;正电子类放射性药物注射剂;有机溶剂残留
DOI:10.14163/j.cnki.11-5547/r.2016.08.217
Determination of residual organic solvent in positron radiopharmaceuticals injection by GC GUO Shen, DAI Hong-feng, ZHOU Shuo, et al. Fujian Provincial Clinical College, Fuzhou 350001, China
【Abstract】 Objective To establish a method for determining residual organic solvent in positron radiopharmaceuticals injection by gas chromatography (GC). Methods HP-INNOWAX capillary column (30 m× 0.53 mm, 1μm) as chromatographic column with FID detector was applied, along with programmed warming of 200℃ in injection port and 270 ℃ in detector, and nitrogen as carrier gas. Results Headspace internal standard method provided good separation of acetonitrile, acetone and ethyl alcohol, with good linear relation (r=0.9999, 0.9973, 0.9988). Their average recovery rates were respectively 99.8%, 101.0%, and 97.5%, with RSD<5%. Residual organic solvent was qualified in detected sample, which was the same as outcome by headspace internal standard method. Conclusion This method is simple and quick, with high sensitivity and accuracy. It is feasible in determination of residual organic solvent in 18F-FDG.
【Key words】 Gas chromatography; Positron radiopharmaceuticals injection; Residual organic solvent
正电子类放射性药物是用于正电子发射计算机断层扫描(positron emission tomography, PET)的显像剂, 在分子水平上无创、动态、定量反映细胞代谢、受体或递质活性、基因表达、组织血流灌注情况等, 在肿瘤、心脑功能等诊疗中占据重要地位。2-氟-2-脱氧-D-葡萄糖(18F-fluorodeoxyglucose, 18F-FDG)主要反映体内细胞对葡萄糖的利用状况, 是临床应用最广泛的正电子类放射性药物[1, 2]。18F-FDG的清洁干燥程序及合成工艺中使用了乙腈、丙酮及乙醇等3种有机溶剂, 其中乙腈为二类溶剂, 应限制使用, 控制溶剂残留量对保证18F-FDG 质量具有重要意义。关于18F-FDG 的残留溶剂研究, 《中国药典》2010年版没有收录其质量标准, 但制定了“正电子类放射性药品质量控制指导原则”[3], 规定残留溶剂及其他项目要进行追溯性检验。《中国药典》2015年版要求采用GC顶空外标法测其有机溶剂残留, 但未见GC顶空内标法测定的报道。本实验根据《中国药典》2015年版及有关文献, 建立了GC顶空内标法, 测定18F-FDG 中3种残留溶剂量, 并与顶空外标法测定结果进行比较。
1 仪器与材料
1. 1 仪器 GC-6890N型气相色谱仪、氢火焰离子化(FID)检测器、安捷伦色谱工作站(美国Agilent公司);PL203电子精密天平(梅特勒-托利多上海有限公司)。
1. 2 药品与试剂 丙酮、正丙醇为色谱纯(国药集团化学试剂有限公司);乙醇、乙腈为色谱纯(德国Merck KGaA公司);18F-FDG(按照文献[4]自制, 批号:20141117、20141118、20141119、20141120、20141121)。
2 方法与结果
2. 1 色谱条件
2. 1. 1 顶空内标法色谱柱 HP-INNOWAX(30 m×0.53 mm, 1 μm);载气:高纯氮;流速:2.0 ml/min;分流比:30∶1;起始柱温为50℃, 保持12 min, 以50℃/min升温至220℃, 保持3 min;进样口温度200℃;检测器温度270℃;进样量:1 μl。
2. 1. 2 顶空外标法 色谱条件[5]
2. 2 溶液制备
2. 2. 1 顶空内标法 取正丙醇约0.5 g, 精密称定, 置100 ml量瓶中, 加水稀释至刻度, 摇匀, 作为内标溶液;分别精密称取丙酮585.64 mg、乙醇522.06 mg、乙腈44.11 mg于100 ml量瓶中, 用水稀释至刻度, 得混合对照品储备液;精密量取混合对照储备液1 ml, 置10 ml量瓶中, 精密加入内标溶液1 ml, 加水定容至刻度, 摇匀, 作为对照品溶液;精密量取18F-FDG 置10 ml量瓶中, 精密加入内标溶液1 ml, 加水定容至刻度, 摇匀, 作为供试品溶液。
2. 2. 2 顶空外标法 溶液制备[5]
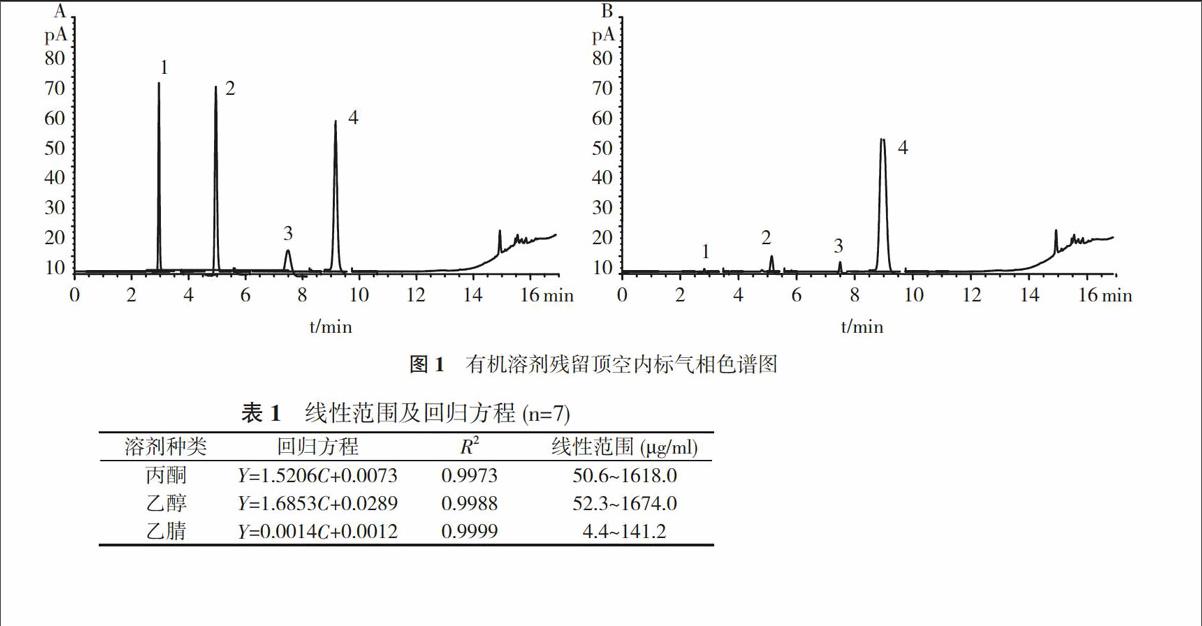
2. 3 系统适用性试验 精密量取对照品溶液和供试品溶液适量, 测定各有机溶剂的分离度及柱效。结果表明, 理论板数均≥5000, 相邻溶剂分离度符合要求, 色谱图见图1。
2. 4 线性关系考察 精密量取对照品储备液0.25、0.5、1.5、2.5、3.5、5.0、8.0 ml置25 ml容量瓶中, 再分别加入内标储备液2.5 ml, 加水定容, 摇匀, 各配制2份。按“2.1”项下色谱条件, 以浓度(μg/ml)为横坐标, 被测组分峰面积与内标峰面积比值为纵坐标, 计算待测组分线性回归方程, 结果见表1。
表1 线性范围及回归方程(n=7)
溶剂种类 回归方程 R2 线性范围(μg/ml)
丙酮 Y=1.5206C+0.0073 0.9973 50.6~1618.0
乙醇 Y=1.6853C+0.0289 0.9988 52.3~1674.0
乙腈 Y=0.0014C+0.0012 0.9999 4.4~141.2
2. 5 仪器精密度试验 精密量取同一对照品溶液适量, 按“2.1”项下色谱条件, 连续进样6 次, 以各组分峰面积对内标峰面积比值计算RSD值(RSD=5.0%、3.9%和3.3%)。
2. 6 检测限和定量限 取对照品溶液, 以逐级稀释法测定各对照品溶剂的检测限(S/N=3)和定量限(S/N=10), 结果表明, 乙腈、丙酮和乙醇对照品溶剂检测限为0.4411、0.2528、0.0523 μg/ml。定量限为4.411、2.528、2.616 μg/ml。
2. 7 回收率试验 量取对照品储备液20 ml, 置100 ml量瓶中, 分别精密量取上述溶液2.5、5.0、7.0 ml各3份置9个10 ml量瓶中, 各加样品溶液1 ml及内标储备液1 ml, 加水定容, 摇匀。依“2.1”项下色谱条件, 按内标法以峰面积计算各组分回收率, 丙酮、乙醇、乙腈平均回收率为101.0%, 97.5%, 99.8%, RSD值均<5%。
2. 8 样品测定 取各个批号18F-FDG 溶液, 依“2.1”项下色谱条件, 按内标法及外标法以峰面积计算各有机溶剂残留量。结果表明所测样品中有机溶剂残留符合中国药典2010年版二部附录[6]中对注射剂有机溶剂限度的要求。顶空内标法与外标法测定结果基本一致。
3 讨论
3. 1 色谱柱 18F-FDG中残留有机溶剂在极性上有一定差别, 可采用极性色谱柱进行分离。实验中选用1强极性HP-INNOWAX柱及中极性DB-624柱, 结果发现使用DB-624柱时乙醇峰脱尾较严重, 而HP-INNOWAX柱对各待测组分及内标液分离效果好, 故本研究选择该柱对待测组分进行分离。
3. 2 定量方法 外标法较简便, 但对操作条件控制较严格; 内标法测定结果较准确, 精密度较高。本研究中内标法与外标法测定结果基本一致, 说明所建立的顶空内标法可以满足测定需要。
3. 3 正电子类药物中有机溶剂残留分析 18F-FDG 中乙醇及丙酮残留主要从合成器清洗干燥过程引入, 延长产品传输管线吹干时间、定期更换管线、清洗干燥与合成隔天进行等措施可较大程度减少残留;乙醇及乙腈残留与其制备工艺密切相关。目前18F-FDG制备工艺包括:液相碱水解柱纯化法[7]、固相萃取纯化法[8]、酸水解柱纯化法[9]。本研究中18F-FDG合成采用液相碱水解柱纯化法, 其中溶剂残留主要与固相萃取柱性质、淋洗溶剂及用量、清洗固相萃取柱的水的体积有关。该制备工艺生产条件要求低, 过程稳定、产率较高。顶空内标及外标气相色谱法对使用该工艺制备出的18F-FDG进行溶剂残留分析表明, 有机溶剂残留量均符合要求, 且结果偏差小, 说明该制备工艺稳定可靠。
顶空毛细管气相色谱内标法测定正电子类放射性药物18F-FDG 中有机溶剂残留未见报道, 方法简便, 结果准确可靠, 可用于18F-FDG 中有机溶剂残留测定。
参考文献
[1] Basu S, Kwee TC, Surti S, et al. Fundamentals of PET and PET/CT imaging. Ann N Y Acad Sci, 2011(1228):1-18.
[2] Vallabhajosula S, Solnes L, Vallabhajosula B. A broad overview of positron emission tomography radiopharmaceuticals and clinical applications: what is new? Semin Nucl Med, 2011, 41(4):246-264.
[3] 李云钢, 张晓军, 刘健,等. 气相色谱法测量正电子放射性药物中有机溶剂残留及原因分析. 同位素, 2013, 26(3):152-157.
[4] 张锦明, 田嘉禾, 周丹, 等.快速自动化合成2- 18F-2-脱氧-β-D-葡萄糖.中华核医学杂志, 2003, 23(1):52-54.
[5] 刘磊, 李彦生, 陈秋松. 反相高效液相色谱法测定正电子药物标准品及其前体. 天津医科大学学报, 2008, 14(1):112-114.
[6] 国家药典委员会. 中国药典(二部).北京:中国医药科技出版社, 2010:附录61-65.
[7] 李琳, 孙华, 黄飞杰, 等.正电子显影剂18F-FDG快速自动化合成及其质量控制.昆明医学院学报, 2009, 30(12):56-58.
[8] 刘晓飞, 张锦明, 田嘉禾, 等.固相水解和ICH中和法制备18F-FDG及放射性损失分析.国际药学研究杂志, 2008, 35(1): 1-4.
[9] 王清, 汝琦, 丁伟, 等.利用Siemens Explora FDG4化学合成模块合成18F-FDG的方法及质量控制.现代医药卫生, 2011, 27(5):656-657.
[收稿日期:2015-11-09]

