大鼠下丘脑室旁核雌激素受体和一氧化氮合酶共存表达的年龄变化
赵 晨 王瑞峰 赵云鹤 杨桂姣▲.太原市公安局小店分局刑侦大队技术中队,山西太原 000;.西安交通大学医学院,陕西西安 7006;.山西医科大学解剖教研室,山西太原 0000
大鼠下丘脑室旁核雌激素受体和一氧化氮合酶共存表达的年龄变化
赵晨1王瑞峰2赵云鹤3杨桂姣3▲
1.太原市公安局小店分局刑侦大队技术中队,山西太原030032;2.西安交通大学医学院,陕西西安710061;3.山西医科大学解剖教研室,山西太原030001
[摘要]目的观察大鼠下丘脑室旁核(PVN)雌激素受体(ER)及一氧化氮合酶(NOS)阳性细胞共存表达的数量和分布趋势,探讨其随年龄而变化的规律。方法取生后10 d龄、20 d龄、30 d龄、60 d龄、90 d龄SD大鼠,每组5只,取下丘脑部位脑组织行冠状切片,采用免疫组织化学技术与还原型辅酶Ⅱ-黄递酶(NADPH-d)组织化学法,观察PVN内NOS/ER双标阳性细胞在各个年龄组的表达情况。结果生后10 d组SD鼠PVN内小细胞部腹内侧NOS及ER共表达细胞较密集,约(31.85±2.01)%,小细胞部后外侧区NOS及ER共表达细胞分布散在,突起不明显,随着年龄的增长双染细胞数目增多,突起延长。在生后20 d组约为(35.16±1.99)%,30 d组约为(43.83±3.13)%,60 d组约为(60.11±2.27)%,到生后90 d组SD鼠NOS及ER共表达细胞达(82.78±2.14)%(F=79.755,P<0.05)。结论①SD大鼠出生后各发育阶段下丘脑PVN内ER和NOS皆有共存表达,且分布逐渐向内侧部迁移;②SD大鼠雌激素水平对下丘脑PVN内NOS阳性细胞表达起正向调控。
[关键词]一氧化氮合酶;雌激素受体;室旁核;发育
机体维持内环境稳定的重要途径之一是神经内分泌调节,如下丘脑-垂体-性腺轴的调控,对于内环境稳定非常重要,而神经内分泌调节的高级中枢是下丘脑[1,2]。雌激素通过与其受体结合影响脑内神经元结构和功能,在促进神经元的增殖、分化、存活、以及维持神经元的正常功能等方面均起重要作用[3-7]。人类随着年龄增长,激素水平产生变化,可能影响机体的神经内分泌功能。一氧化氮(NO)是神经内分泌网络系统调节的重要信使分子,既可作为神经调质,促进释放神经递质[8];其本身又有神经递质的作用,可通过影响下丘脑-垂体-性腺轴,参与调节整个身体内环境的平衡[9]。NO合成的关键因素是一氧化氮合酶(nitric oxide synthase,NOS),NOS表达可间接反映NO的分布[10-13]。研究发现在下丘脑室旁核有NOS和雌激素受体(estrogen receptor,ER)共存表达[14,15],但ER和NOS相互作用的功能及机制尚不清楚,且随年龄变化大鼠室旁核ER/NOS共表达的趋势国内鲜有报道。因此,本课题采用双标法,观察SD大鼠下丘脑室旁核在生后不同年龄阶段ER和NOS阳性神经元的共存表达,并进一步研究一氧化氮与雌激素的相互作用,以期为预防和治疗年龄相关性退行性疾病提供新靶点和新思路。
1 材料与方法
1.1实验动物
健康成年SD大鼠,山西医科大学实验动物中心提供,动物许可证号:山医字第070101号,12只,雌雄各半,体重250~300 g,配对繁殖小鼠。小鼠出生日为生后第1天,取生后不同发育阶段10 d、20 d、30 d、60 d、90 d龄的SD大鼠,每组5只,共计25只。实验于2013年10月~2014年9月在山西医科大学人体解剖学科研实验室和山西医科大学科研实验中心完成。
1.2冰冻切片
1%戊巴比妥钠麻醉大鼠(40 mg/kg),生理盐水、4%多聚甲醛、灌注取脑,4%多聚甲醛后固定,15%、30%蔗糖溶液脱水。取下丘脑,冠状面冰冻切片,片厚40 μm。
1.3黄递酶(NADPH-d)与ER双标染色
(1)黄递酶(NADPH-d)组织化学染色切片在0.01 mol/L PBS液中漂洗5 min×3次后,正常山羊血清37℃恒温箱封闭1 h;(2)一抗(1∶50;兔抗鼠ER抗体),4℃过夜,0.01 mol/L PBS液漂洗5 min×3次;(3)生物化二抗溶液,37℃1 h,PBS洗5 min×3次;(4)辣根酶标记链酶卵白素工作液,37℃1 h,PBS漂洗,步骤同上;(5)DAB反应液显色;(6)常规梯度酒精脱水,二甲苯透明,中性树胶封片;(7)对照组用正常兔血清代替兔抗ER血清。
1.4结果分析
依照大鼠脑立体定位图谱[16],选各组切片中下丘脑室旁核部位,在明场下用Olympus BX51显微镜观察,拍照,捷达801图像分析系统计数,分析在单位面积内ER及NOS阳性神经元数目,计算双染阳性细胞百分率,并进行统计学分析。
1.5统计学方法
2 结果
2.1ER和NOS染色阳性细胞形态
ER阳性细胞呈棕黄色,卵圆形,胞浆不着色,胞核着色,大多数着色较浅,但细胞轮廓清晰,分布较密集,突起不明显,偶可见较短突起。NOS阳性细胞呈蓝黑色或蓝色,细胞核不着色,胞质着色,突起较短。见图1。

图1 大鼠生后NOS与ER双染细胞在下丘脑PVN的表达
表1 下丘脑PVN内ER和NOS的表达(±s)
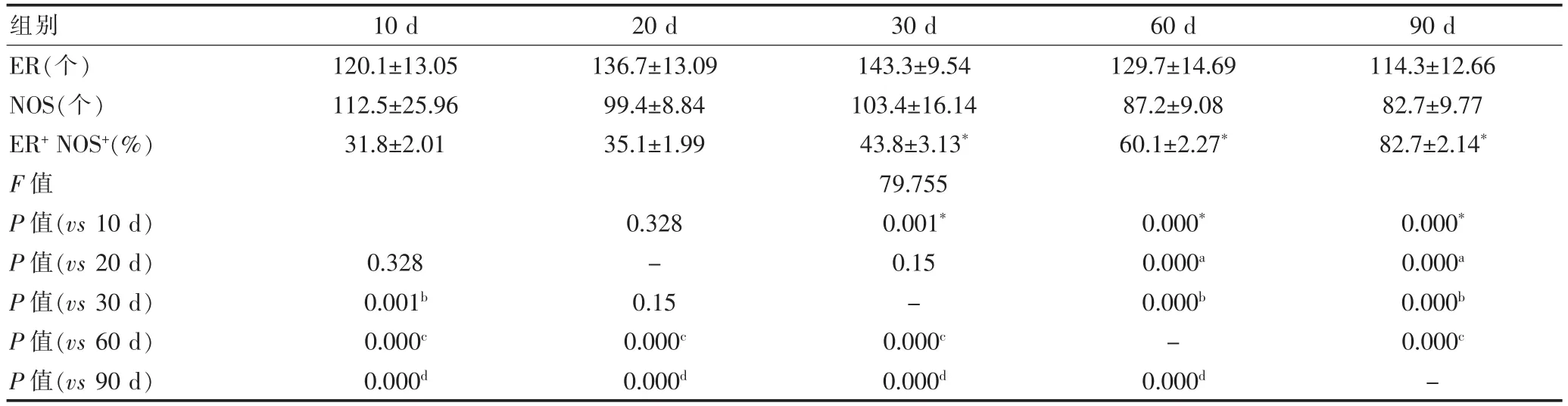
表1 下丘脑PVN内ER和NOS的表达(±s)
注:30 d组、60 d组、90 d组ER+NOS+与10 d组比较,t=3.216,9.298,17.332,*P<0.05;60 d组、90 d组ER+NOS+与20 d组比较,t=8.249,16.293,aP<0.05;10 d组、60 d组、90 d组ER+NOS+与30 d组比较,t=-3.216,4.202,10.261,bP<0.05;10 d组、20 d组、30 d组、90 d组ER+NOS+与60 d组比较,t=-9.298,-8.249,-4.202,7.253,cP<0.05;10 d组、20 d组、30 d组、60 d组ER+NOS+与90 d组比较,t=-17.332,-16.293,-10.261,-7.253,dP<0.05
ER(个)NOS(个)ER+NOS+(%)F值P值(vs 10 d)P值(vs 20 d)P值(vs 30 d)P值(vs 60 d)P值(vs 90 d)120.1±13.05 112.5±25.96 31.8±2.01 0.328 0.001b0.000c0.000d136.7±13.09 99.4±8.84 35.1±1.99 0.328 -0.15 0.000c0.000d143.3±9.54 103.4±16.14 43.8±3.13*79.755 0.001*0.15 -0.000c0.000d129.7±14.69 87.2±9.08 60.1±2.27*0.000*0.000a0.000b-0.000d114.3±12.66 82.7±9.77 82.7±2.14*0.000*0.000a0.000b0.000c-组别 10 d 20 d 30 d 60 d 90 d

图2 大鼠下丘脑室旁核ER和NOS变化直方图
2.2大鼠生后随年龄变化NOS与ER双染细胞在下丘脑PVN的表达情况
室旁核(Paraventricular nucleus,PVN)位于第三脑室下丘脑部的上端两侧,是下丘脑前区最显著的核团之一,可分为大细胞部、小细胞部和背侧帽部等部位。生后10 d组,双染细胞大多为深蓝色胞浆,棕黄色胞核,少量细胞的胞浆着色较浅,胞核较大,于小细胞部腹内侧区域双染细胞分布较为密集[占细胞总数(31.8±2.01)%;见表1、图2],于大细胞部后外侧区域呈散在分布(图1①,②)。生后20 d组,双染细胞形态与10 d组相似,细胞呈卵圆形或梭形,较低龄组(生后10 d组)神经元突起延长。小细胞部可见散在的椭圆形或卵圆形,无明显突起,轮廓较为清晰的ER阳性细胞,分布于密集的双染阳性细胞之间[约为总细胞数的(35.1±1.99)%](图1③,④;表1、图2)。生后30 d组,细胞突起较生后20 d增长,小细胞部部双染细胞增多,占细胞总数(43.8±3.13)%,NOS阳性细胞突起明显增长(图1⑤,⑥;表1、图2)。生后60 d组,双染阳性细胞较密集分布于小细胞部腹内侧区域,散在分布于大细胞部后外侧区。细胞的分支比较多,突起较短而粗,在一些区域交织成丛。双染阳性细胞的突起在小细胞部的腹内侧区域不容易辨别,多和附近的细胞突起交错混杂。双染细胞占小细胞部细胞总数的(60.10±2.27)%,少数双染阳性细胞,胞体较大,核仁浓染,椭圆形的细胞截面,不明显的突起,散在地分布在大细胞部的后外侧区(图1⑦,⑧;表1、图2)。生后90 d组,双染阳性细胞突起延长,细胞形态较成熟,双染细胞占小细胞部细胞总数的80%以上(图1⑨,⑩;表1、图2)。
3 讨论
已有文献报道,雌激素和一氧化氮共同作用可影响人体心血管功能[17]。而雌激素亦可通过血脑屏障,与受体结合,进而影响脑的功能,有报道表明,雌激素可调节脑内特定神经元的分化,亦可营养胆碱能神经元,发挥神经生长因子辅因子的作用[18,19]。哺乳动物出生后,雌激素水平随着年龄变化很大,老年动物雌激素水平大幅降低,而老年神经退行性疾病高发。下丘脑是神经内分泌系统的高级中枢,帮助维持机体的内环境平衡,具有调节体温、调控血浆渗透压、情绪、调节水摄取及血容量、调节摄食及代谢,调控生殖等功能,是间脑的一部分,为大脑基部相对较小的区域[20]。NOS阳性神经元参与和介导了下丘脑的功能,可促进释放神经递质,并作为第二信使介导兴奋性氨基酸的功能,参与长时程增强电位的形成,NOS还参与失活花生四烯酸的过程,以及在基因修饰和蛋白质修饰中发挥作用,与神经的发生,衰老和死亡等重要生物活性相关[21]。那么,阿尔茨海默病、帕金森症等年龄相关性疾病是否与雌激素以及一氧化氮表达水平相关呢?
本实验发现大鼠生后早期(第10天以前)PVN内有较为密集的ER免疫阳性细胞,生后30 d组ER免疫阳性细胞数目最多,而后逐步下降,在SD大鼠发育过程中,ER表达在出生后于PVN内呈先增多后减少的趋势(表1,图2)。生后各年龄阶段大鼠下丘脑PVN内ER和NOS均有共存表达(表1),且NOS的变化趋势与ER的变化趋势基本一致(图2),提示NO可能是雌激素与雌激素受体结合后所产生的第二信使,并帮助完成雌激素的促神经分化等作用,雌激素水平提高可能有助于NO水平升高,并帮助下丘脑发挥其神经内分泌功能,二者之间的作用机制尚待进一步研究探讨。
[参考文献]
[1] Pawlikowski M,Pisarek H,Fryczak J. Effects of nitric oxide synthase inhibition on diethylstilbestrol -induced hyperprolactinaemia and pituitary tumourigenesis in rats[J]. Endokrynol Pol,2012,63(2):115-118.
[2] Bellefontaine N,Hanchate NK,Parkash J,et al. Nitric oxide as key mediator of neuron-to-neuron and endotheliato -glia communication involved in the neuroendocrine control of reproduction[J]. Neuroendocrinology,2011,93(2):74-89.
[3] Brunton PJ,Donadio MV,Yao ST,et al. 5α-Reduced neurosteroids sex-dependently reverse central prenatal programming of neuroendocrine stress responses in rats[J]. J Neurosci,2015,35(2):666-677.
[4] Wei Q,Guo P,Mu K,et al. Estrogen suppresses hepatocellular carcinoma cells through ERβ-mediated upregulation of the NLRP3 inflammasome[J]. Lab Invest,2015,95 (7):804-816.
[5] Asl SZ,Khaksari M,Khachki AS,et al. Contribution of estrogen receptors alpha and beta in the brain response to traumatic brain injury[J]. J Neurosurg,2013,119(2):353-61.
[6] Luo D,Liu Y,Zhou Y,et al. Association between dietary phytoestrogen intake and bone mineral density varied with estrogen receptor alpha gene polymorphisms in southern Chinese postmenopausal women[J]. Food Funct,2015,6 (6):1977-1983.
[7] Wu J,Crowe DL. The histone methyltransferase EZH2 promotes mammary stem and luminal progenitor cell expansion,metastasis and inhibits estrogen receptor-positive cellular differentiation in a model of basal breast cancer[J]. Oncol Rep,2015,34(1):455-460.
[8]吴英,余艳红,陈敦金.母源性BDE-209暴露对仔鼠海马一氧化氮神经递质的影响[J].中国优生与遗传杂志,2012,20(10),18-20.
[9] Gadek-Michalska A,Tadeusz J,Rachwalska P,et al. Brain nitric oxide synthases in the interleukin-1β-induced activation of hypothalamic-pituitary-adrenal axis[J]. Pharmacol Rep,2012,64(6):1455-1465.
[10] Huang B,Chen CT,Chen CS. Laminar shear flow increases hydrogen sulfide and activates a nitric oxide produc ing signaling cascade in endothelial cells[J]. Biochem Biophys Res Commun,2015,464(4):1254-1259.
[11] Tyurenkov IN,Perfilova VN,Sadikova NV,et al. Effects of a new glutamic acid derivative on myocardial contractility of stressed animals under conditions of nitric oxide synthesis blockade[J]. Bull Exp Biol Med,2015,159(3):384-386.
[12] Cheng WH,Huang KY,Huang PJ,et al. Nitric oxide maintains cell survival of trichomonas vaginalis upon iron depletion[J]. Parasit Vectors,2015,25(8):393.
[13] Glass MJ,Wang G,Coleman CG,et al. NMDA receptor plasticity in the hypothalamic paraventricular nucleus contributes to the elevated blood pressure produced by Angiotensin II[J]. J Neurosci,2015,35(26):9558-9567.[14] Stefano GB,Cadet P,Mantione K,et al. Estrogen signaling at the cell surface coupled to nitric oxide release in Mytilus edulis nervous system[J]. Endocrinology,2003,144(4):1234-1240.
[15]曾俊峰,杨桂姣,皇甫平,等.大鼠下丘脑内的一氧化氮合酶与雌激素受体双标神经元[J].解剖学杂志,2008,31(2):217-221.
[16]诸葛启钏.大鼠脑立体定位图谱[M].北京:人民卫生出版社,2005:图26.
[17]穆军升,朱洪生.一氧化氮和雌激素的关系在心血管病中的研究进展[J].心血管病学进展,2002,23(2):113-115.
[18] Lim J,Choi HS,Choi HJ. Estrogen-related receptor gamma regulates dopaminergic neuronal phenotype by activating GSK3β/NFAT signaling in SH-SY5Y cells[J]. J Neurochem,2015,133(4):544-557.
[19]冯杰,主性,钟垒,等.贵州香猪睾丸发育中雌激素受体和一氧化氮合酶的表达[J].贵州农业科学,2015,43 (1):95-99.
[20] Goel N,Workman JL,Lee TT. Sex differences in the HPA axis[J]. Compr Physiol,2014,4(3):1121-1155.
[21] Gu YN,Kim HG,Jeon CJ. Localization of nitric oxide synthase-containing neurons in the bat visual cortex and co-localization with calcium-binding proteins[J]. Acta Histochem Cytochem,2015,48(4):125-133.
Expression variation of estrogen receptor and nitric oxide synthase in the paraventricular nucleus with rat development
ZHAO Chen1WANG Ruifeng2ZHAO Yunhe3YANG Guijiao3
1.Technology Squadron, Criminal Investigation Brigade, Xiaodian Branch, Taiyuan Public Security Bureau, Taiyuan 030032, China; 2.Medical School of Xi'an Jiaotong University, Xi'an 710061, China; 3.Department of Anatomy, Shanxi Medical University, Taiyuan 030001, China
[Abstract]Objective To observe the quantity and distribution of ER and NOS co-positive cells in hypothalamus with rat development, to explore the expression regulation of nitric oxide and estrogen in postnatal SD rats. Methods SD rats were divided into 5 groups according to the postnatal days 10, 20, 30, 60 and 90, n=5 for each group. The coronal sections in hypothalamus were collected to detect the shape, size and numbers of NOS/ER positive neurons in paraventricular nucleus using the immunohistochemical staining combined with NADPH-d histochemical. Results On the postnatal 10 days rats, NOS/ER double-labeled neurons were greatly detected in the medial parvicellular(31.85±2.01%), but in the lateral hypothalamic area they were scatted. With the development, the number of double-labeled neurons increased and neurites prolonged. On the postnatal 20 days rats, the proportion of NOS and ER double-positive neurons were(35.16±1.99)%, On the postnatal 30 days rats, it was(43.83±3.13)%, and it was(60.11±2.27)%on the postnatal 60 days rats, On the postnatal 90 days rats, the proportion of NOS and ER double-positive neurons got to(82.78±2.14)% (F=79.755,P<0.05). Conclusion①NOS and ER are co-expression in the hypothalamic paraventricular nucleus during each development stage in the postnatal SD rats.②In paraventricular nucleus, estrogen secretion may promote the NOS expression.
[Key words]Nitric oxide synthase; Estrogen receptor; Paraventricular nucleus; Development
收稿日期:(2015-09-15)
通讯作者▲
[中图分类号]R339.2
[文献标识码]A
[文章编号]1673-9701(2016)02-0023-04

