不同BR施用方式诱导黄瓜幼苗对Ca(NO3)2胁迫抗性的研究胁迫抗性的研究
李 悦,宋士清,王久兴
(河北科技师范学院 园艺科技学院,河北秦皇岛 066600)
不同BR施用方式诱导黄瓜幼苗对Ca(NO3)2胁迫抗性的研究胁迫抗性的研究
李悦,宋士清*,王久兴
(河北科技师范学院 园艺科技学院,河北秦皇岛 066600)
摘要:为探讨外源油菜素内酯(brassinosteroid,BR)诱导黄瓜幼苗对Ca(NO3)2胁迫抗性的效果,研究了3种外源BR施用方法(0.01 mg·L-1BR浸种、0.1 mg·L-1BR喷叶及其二者结合施用)对Ca(NO3)2胁迫(60 mmol·L-1)下黄瓜幼苗生长、生理活动以及光合作用的影响。结果表明:(1)3种外源BR方法处理后,Ca(NO3)2胁迫下的黄瓜幼苗株高、茎粗、展开叶片数、叶面积、干重含水量均显著提高,同时其叶片游离脯氨酸和可溶性糖含量上升,过氧化物酶活性提高,而其丙二醛(MDA)含量趋于无Ca(NO3)2胁迫对照的水平;(2)外源BR处理还提高了Ca(NO3)2胁迫下黄瓜幼苗的净光合速率、蒸腾速率和气孔导度,却抑制了Ca(NO3)2胁迫下胞间CO2浓度的升高。研究认为,适宜浓度的外源BR浸种和喷叶处理均可有效增强黄瓜幼苗渗透调节能力,降低细胞膜质过氧化伤害程度,提高抗氧化酶活性和光合效率,从而表现出对Ca(NO3)2胁迫的抗性,并以操作简便、用量极低的0.01 mg·L-1BR浸种方法效果最佳。
关键词:油菜素内酯;Ca(NO3)2胁迫;黄瓜;诱抗效果
黄瓜(CucumissativusL.)是中国设施栽培面积较大、种植范围较广的蔬菜之一。据农业部统计,中国的黄瓜栽培面积为1×106hm2,其中设施栽培面积占40%左右,栽培面积和总产量分别占世界的65%和59%[1],但因其根系脆弱、好气、分布浅,对土壤盐分较敏感[2]。近年来,随着国内设施园艺的快速发展,设施土壤次生盐渍化程度不断加重,已成为设施黄瓜生产的主要障碍之一。据报道,设施栽培土壤中累积的盐离子主要是NO3-、SO42-、Cl-、Ca2+、Mg2+、K+、Na+等,其中阴离子以NO3-为主,占阴离子总量的67%~76%;阳离子以Ca2+为主,占阳离子总量的55%~68%[3]。轻度硝酸盐积累可引起植物对各种营养元素吸收不均衡,酸性土壤还可引起Mn等重金属中毒,碱性土壤则可引起Zn、Fe、Cu等微量元素的缺失。
油菜素内酯(brassinosteroid,BR)是一种新型植物激素,能促进细胞分裂、伸长生长以及细胞骨架的合成[4-5]。多年来研究表明,植物经过极低浓度的BR处理便能表现出明显的生理效应,可提高植物的抗旱性[6]、抗寒性[7]、耐热性[8]、抗盐性[9],以及抗重金属胁迫[10]、抗低氧胁迫[11]等。目前,外源BR提高植物抗盐性的研究大多集中在NaCl胁迫上,在Ca(NO3)2胁迫方面的报道较少;且都是在BR施用方法相同的前提下来比较不同浓度BR提高植物抗逆性的效果,未见对BR不同施用方法诱导抗逆性效果进行比较的研究。因此,本试验选取设施盐渍化土壤中含量最高的阴、阳离子(NO3-、Ca2+)为胁迫条件,将外源BR以不同的方法施于黄瓜种子和幼苗,以期阐明BR诱导黄瓜幼苗Ca(NO3)2胁迫抗性的机理,为减轻设施土壤盐渍化的危害提供理论依据,以及相应生产措施的制定奠定基础。
1材料和方法
1.1供试材料
供试黄瓜品种为‘改良津春2号’,由天津科润农业科技股份有限公司黄瓜研究所选育。BR购于北实纵横科技发展有限公司,纯度为95%。配制时先用少量乙醇溶解,再用蒸馏水配成2 mg·L-1的浓缩液,在4 ℃下保存,使用时根据所需浓度稀释。
1.2试验方法
试验于2014年9~10月在河北科技师范学院华夏温室进行。共设清水对照(CK1)、Ca(NO3)2胁迫对照(CK2)以及Ca(NO3)2胁迫下浸种(JZ)、喷叶(PY)、浸种+喷叶(JP)5个处理(表1)。Ca(NO3)2胁迫浓度、BR浸种浓度、BR喷叶浓度均经前期预备试验确定:Ca(NO3)2胁迫浓度的选定过程中设置了大梯度和小梯度2批浓度筛选试验,60 mmol·L-1Ca(NO3)2胁迫下黄瓜幼苗各项形态指标与其他处理差异几乎都达到显著水平,对植株生长抑制程度在70%左右;BR处理预设了0.005、0.01、0.05、0.1、0.2 mg·L-15个浓度,0.01 mg·L-1BR浸种显著提高了黄瓜种子的发芽率、发芽指数、发芽势和活力指数,0.1 mg·L-1BR喷叶对黄瓜幼苗的各项形态指标均有显著提高。结合前人研究[12],最终在本研究中选择60 mmol·L-1Ca(NO3)2为胁迫浓度,0.01 mg·L-1BR为浸种浓度,0.1 mg·L-1BR为喷叶浓度。
黄瓜种子首先进行温汤浸种,水温55~60 ℃,时间5 min;随后于30 ℃水温下浸种,浸种时间4 h。其中,CK1、CK2、PY处理用清水浸种,JZ、JP处理用0.01 mg·L-1BR溶液浸种。然后分别将种子置于铺有2层滤纸(提前用去离子水浸润)的培养皿(Φ10 cm)内,每皿50粒,28 ℃下暗光催芽24 h。选发芽整齐一致的种子播于装有草炭:蛭石(体积比2∶1)基质的72孔穴盘中。
黄瓜一叶一心时,挑选整齐一致的幼苗定植于装有20 L营养液的泡沫培养箱内,进行预培养。调节营养液pH值为6.5±0.1,电导率(Ec)值为2.2~2.5 mS·cm-1,气泵间歇通气40 min·h-1[13]。
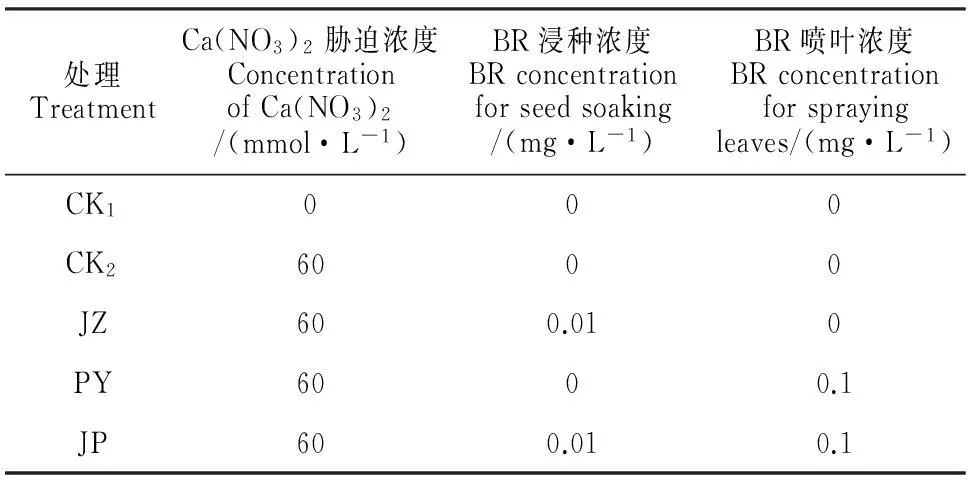
表1 不同BR施用方式诱导黄瓜幼苗
注:CK1.清水对照;CK2.60 mmol·L-1Ca(NO3)2胁迫对照;JZ.60 mmol·L-1Ca(NO3)2胁迫+0.01 mg·L-1BR浸种;PY.60 mmol·L-1Ca(NO3)2胁迫+0.1 mg·L-1BR喷叶;JP.60 mmol·L-1Ca(NO3)2胁迫+0.01 mg·L-1BR浸种+0.1 mg·L-1BR喷叶。下同。
Note:CK1.Water control;CK2.60 mmol·L-1Ca(NO3)2stress control;JZ.60 mmol·L-1Ca(NO3)2stress+0.01 mg·L-1BR soaking seeds;PY.60 mmol·L-1Ca(NO3)2stress+0.1 mg·L-1BR spraying leaves;JP.60 mmol·L-1Ca(NO3)2stress+0.01 mg·L-1BR soaking seeds+0.1 mg·L-1BR spraying leaves.The same as below.
营养液配方如下:Ca(NO3)2·4H2O 3.5 mmol·L-1,KNO37 mmol·L-1,KH2PO41 mmol·L-1,MgSO4·7H2O 2 mmol·L-1,H3BO346.3 μmol·L-1,MnSO4·H2O 10 μmol·L-1,ZnSO4·7H2O 1.0 μmol·L-1,(NH4)6Mo7O2·4H2O 0.38 μmol·L-1,CuSO4·5H2O 0.76 μmol·L-1,EDTA-FeNa 90 μmol·L-1。试验所用水均为去离子水,用梯度浓度的H2SO4或NaOH调节pH值。每7 d更换1次营养液。
黄瓜两叶一心时,早晨8:00用喷雾器对PY、JP处理进行0.1 mg·L-1外源BR喷叶,要求量足而不下滴(流)为宜,每株每次约3 mL。隔天再处理1次,共处理2次。第2次BR喷叶处理1 d后,进行60 mmol·L-1Ca(NO3)2胁迫。用分析纯固体Ca(NO3)2·4H2O配制成3 mol·L-1的浓缩液,将浓缩液添加至相应泡沫培养箱中,达到并保持各处理所需盐胁迫浓度。试验设3次重复,每个泡沫箱为一个小区,每小区18株,采用随机区组排列,保持各小区其他环境条件及苗期管理一致。
1.3测定指标
盐胁迫第9天(晴天),于9:00~11:00用GFS-3000光合仪测定生长点下数第2片完全展开叶(功能叶)的气体交换参数[12],包括净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。盐胁迫第12天,植株盐胁迫伤害开始恢复时,取生长点下数第3片完全展开叶,用TAB显色法测定丙二醛(MDA)含量、蒽酮法测定可溶性糖(Ss)含量、磺基水杨酸法测定游离脯氨酸(Pro)含量。盐胁迫第21天,植株达到成苗标准,测定形态指标。其中,株高为子叶节至黄瓜幼苗生长点的长度;茎粗为子叶节以下1 cm处、与两片子叶平行方向的茎部直径;第3真叶面积采用裴孝伯等[14]的方法测定;同时统计展开叶片数;称取全株鲜重、全株干重,并计算干重含水量。
干重含水量=(全株鲜重-全株干重)/全株干重×100%
1.4数据分析
采用Microsoft Excel 2007软件完成原始数据整理及图表制作;用SPSS软件进行统计分析,Duncan新复极差法进行差异显著性检验(P<0.05)。
2结果与分析
2.1外源BR对Ca(NO3)2胁迫下黄瓜幼苗Pro和Ss含量的影响
由图1可见,黄瓜幼苗叶片脯氨酸(Pro)和可溶性糖(Ss)含量在各种方式外源BR处理下呈现相同的变化趋势。其中,在Ca(NO3)2胁迫下(CK2),黄瓜幼苗叶片Pro和Ss含量比清水对照(CK1)分别显著升高了44.28%和23.01%;施用外源BR后,各处理幼苗叶片Pro和Ss含量继续升高,并以浸种处理(JZ)的Pro和Ss含量最高,且与CK2相比分别显著提高了47.47%和32.02%;同时,JZ处理叶片Pro和Ss含量也高于喷叶处理(PY)和喷叶+浸种处理(JP),且与PY处理的差异达到显著水平(P<0.05)。以上结果说明外源BR 3种施用方法均能显著提高Ca(NO3)2胁迫下Pro和Ss含量,且以浸种处理(JZ)效果最显著,增强了Ca(NO3)2胁迫下黄瓜幼苗的渗透调节能力。
2.2外源BR对Ca(NO3)2胁迫下黄瓜幼苗MDA含量的影响
图2显示,与CK1相比较,黄瓜幼苗叶片MDA含量在Ca(NO3)2胁迫(CK2)下显著升高了55.24%;施用外源BR后,显著抑制了Ca(NO3)2胁迫幼苗MDA含量升高的幅度,JZ、PY、JP处理的黄瓜幼苗叶片MDA含量比CK2分别显著降低了39.96%、38.49%、15.93%,而其中的JZ、PY处理的MDA含量又显著低于JP处理。以上结果说明外源BR 3种施用方法均能显著抑制Ca(NO3)2胁迫下黄瓜幼苗MDA含量升高,且以浸种处理(JZ)效果最显著,降低了Ca(NO3)2胁迫对黄瓜幼苗细胞膜的过氧化伤害程度。

同列不同小写字母表示不同处理间在0.05水平存在显著性差异;下同
2.3外源BR对Ca(NO3)2胁迫下黄瓜幼苗过氧化物酶活性的影响
由图3可见,与CK1相比,Ca(NO3)2胁迫(CK2)下黄瓜幼苗叶片POD活性显著升高了55.00%,施用外源BR后,各处理的POD活性继续升高。其中,JZ、PY、JP处理的黄瓜幼苗叶片POD活性比CK2分别显著提高了55.63%、24.71%、49.36%,且JZ处理提高的幅度最大。以上结果说明外源BR 3种施用方法均能显著提高Ca(NO3)2胁迫下黄瓜幼苗POD活性,增强黄瓜幼苗对Ca(NO3)2胁迫产生活性氧的清除能力,且以浸种处理(JZ)效果最显著。
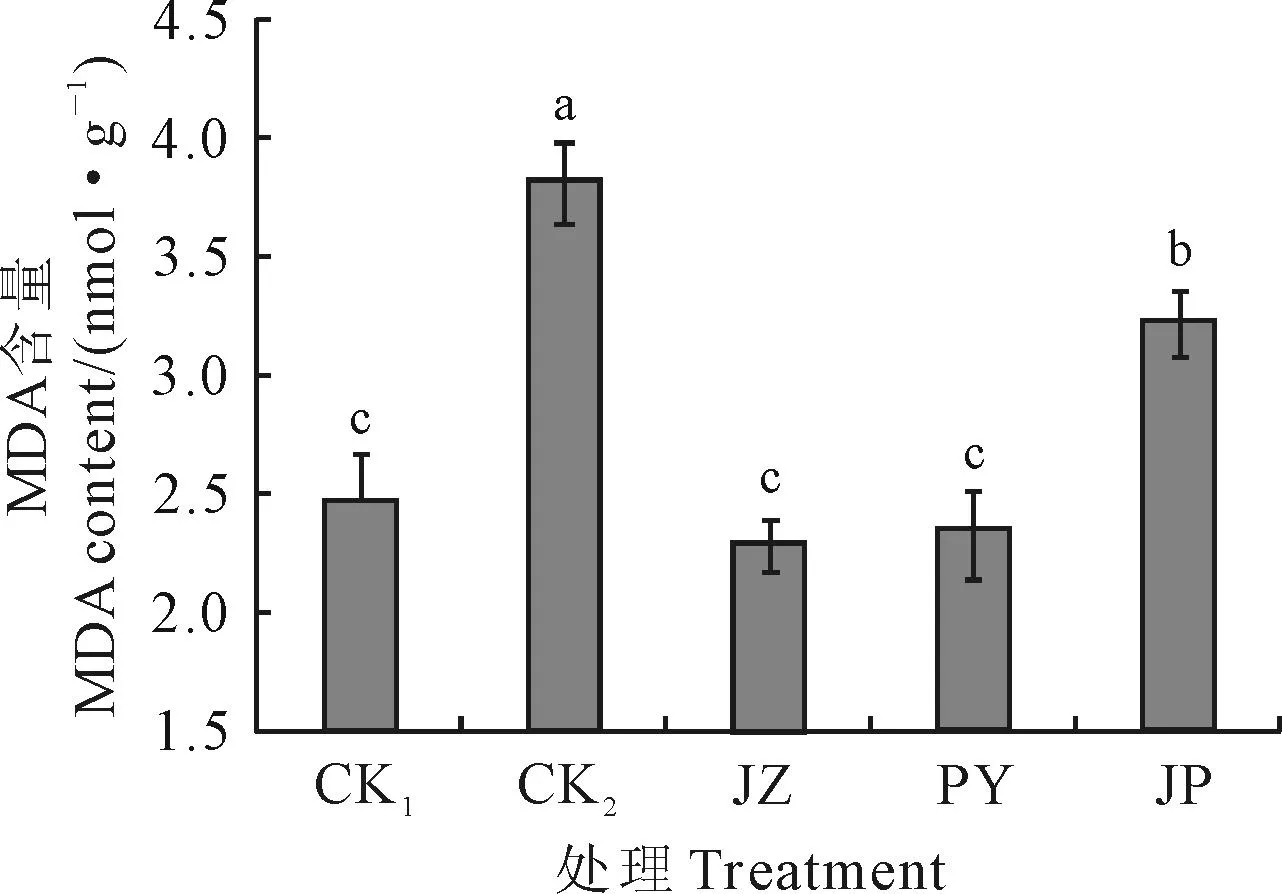
图2 外源BR对Ca(NO3)2胁迫下
2.4外源BR对Ca(NO3)2胁迫下黄瓜幼苗光合作用的影响
由图4可见,Ca(NO3)2胁迫(CK2)使黄瓜幼苗叶片的Pn、Tr、Gs分别比清水对照(CK1)显著降低了30.01%、63.56%、54.39%,而其胞间CO2浓度(Ci)则显著高于CK 19.32%。施用外源BR的各处理均抑制了Ca(NO3)2胁迫下Pn、Tr和Gs的降低趋势,但3种施用方法降幅存在显著差异,并以浸种处理(JZ)值最高。其中,JZ、JP处理黄瓜叶片Pn、Tr和Gs与CK2相比均显著提高,且它们的Pn几乎达到了CK1的水平;JZ处理Pn、Tr和Gs比CK2分别显著提高了42.22%、55.17%和68.97%。另外,外源BR的3种施用方法对黄瓜叶片Ci影响差异不显著,但它们较CK2均有不同程度降低,JP处理降幅还达到显著水平;JZ、PY、JP处理分别比CK2降低了1.98%、2.33%和3.31%。以上结果说明外源BR 3种施用方法不同程度地提高了Ca(NO3)2胁迫下黄瓜幼苗的净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs),且浸种处理(JZ)均达到了显著水平,减轻了Ca(NO3)2胁迫对黄瓜幼苗光合系统的伤害。
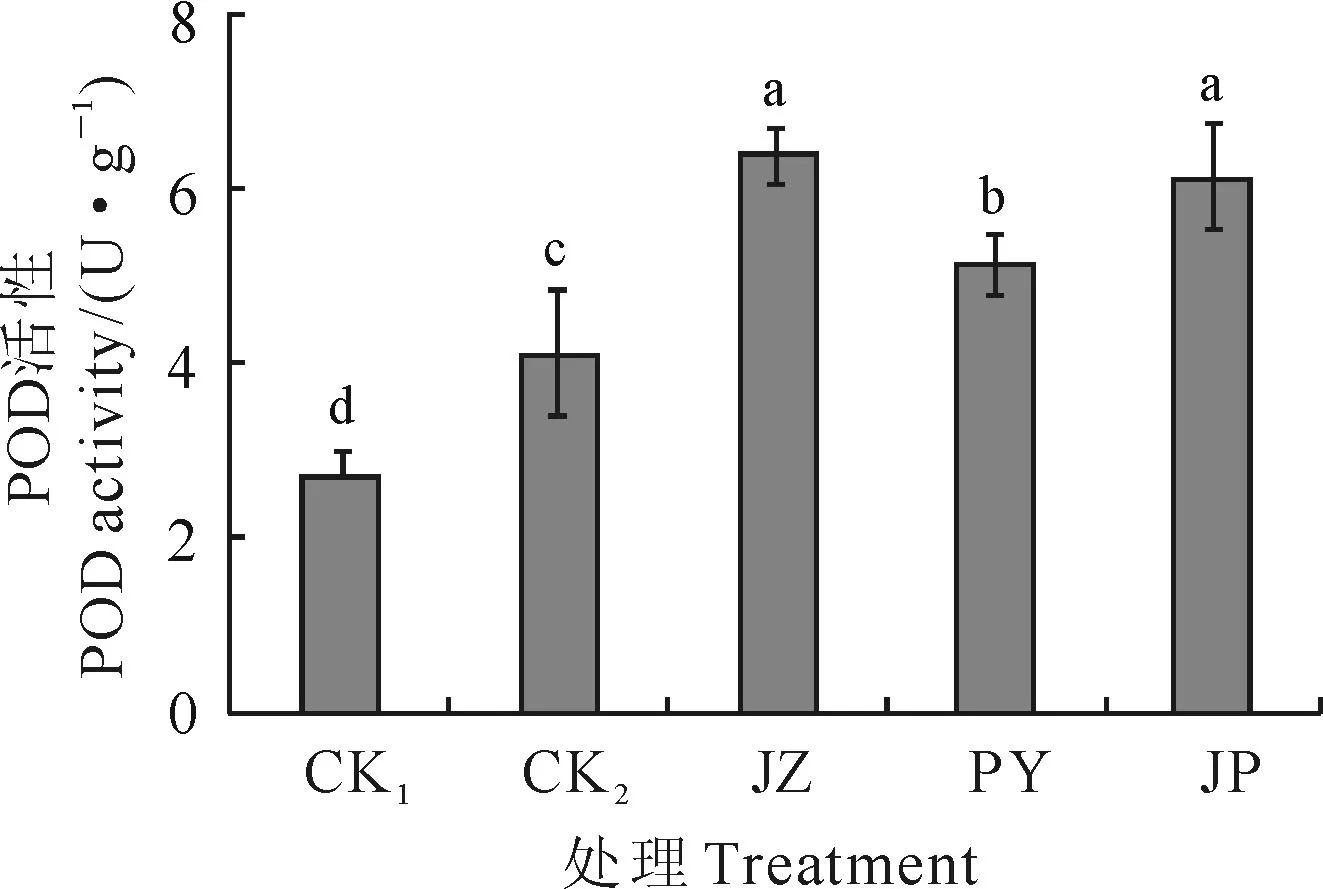
图3 外源BR对Ca(NO3)2胁迫下
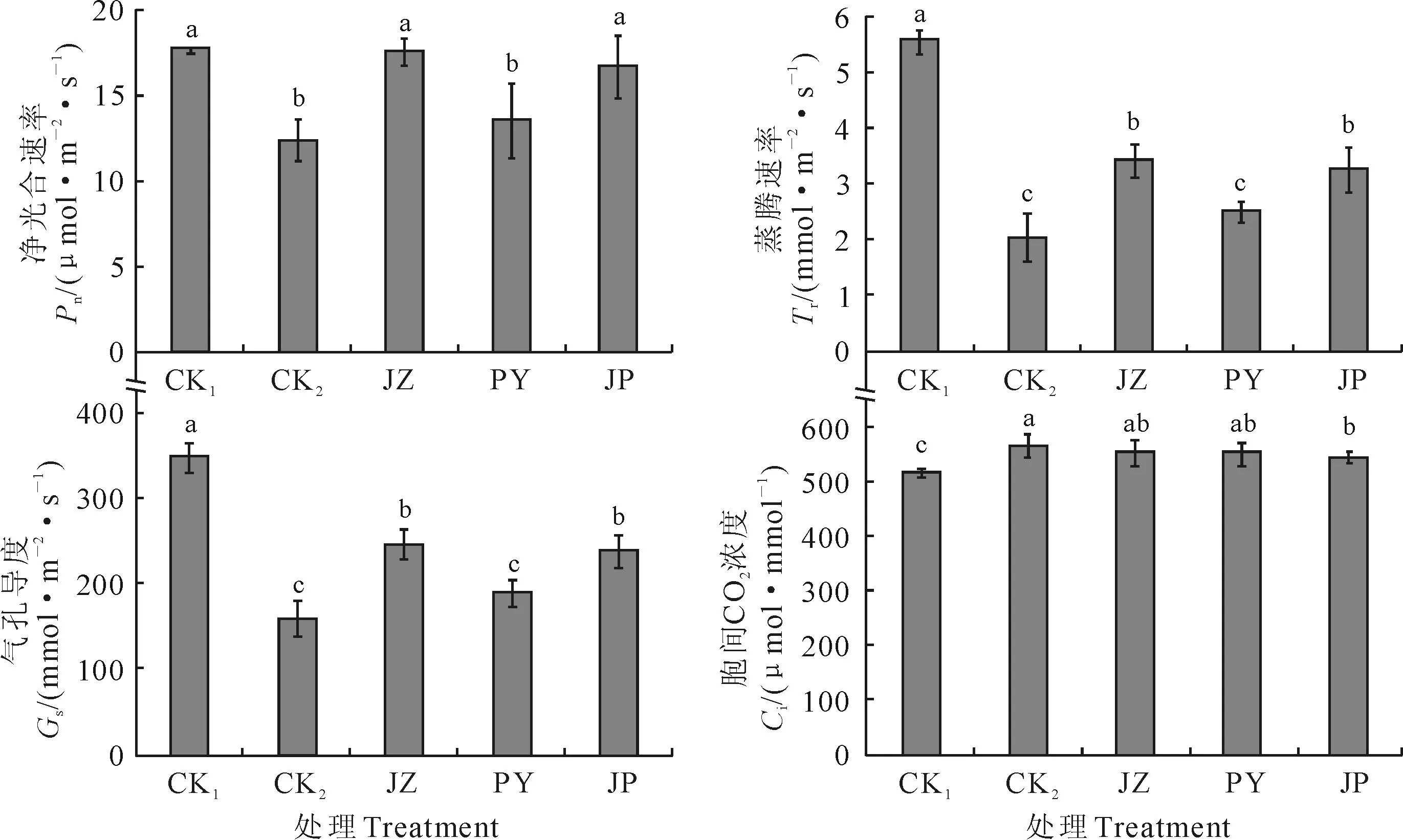
图4 外源BR对Ca(NO3)2胁迫下黄瓜幼苗光合作用的影响
处理Treatment株高Heightofplant/cm茎粗Stemdiameter/mm展开叶片数Numberofexpandleaves/(pieces)叶面积Leafarea/cm2干重含水量Dryweightofthewatercontent/%CK153.5±5.40a6.46±0.72a6.6±0.35a187.76±19.32a1084.16±107.79aCK240.0±0.69c5.35±0.16b5.7±0.00b98.22±5.39c865.63±82.95bJZ47.7±2.68b5.81±0.06b6.2±0.33a119.87±6.19b968.11±12.94abPY38.6±2.05c5.57±0.13b5.5±0.17b108.04±4.01bc927.77±15.17bJP41.4±2.00c5.63±0.23b5.7±0.29b111.35±9.97bc909.50±75.07b
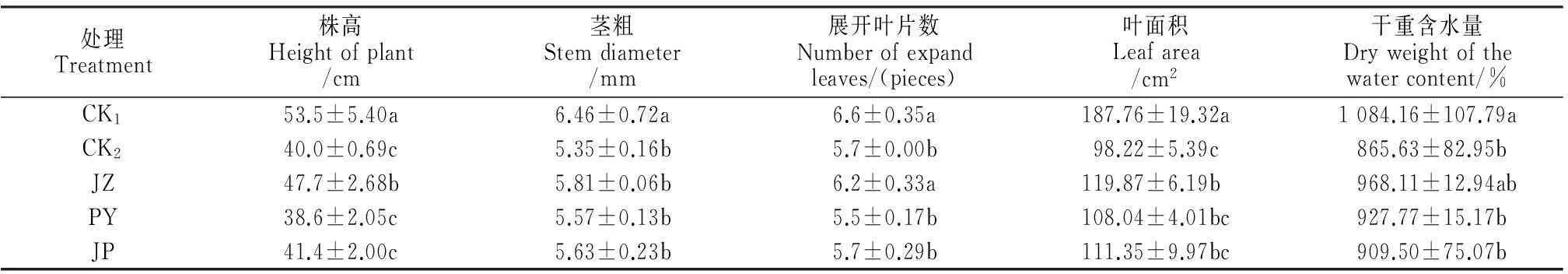
2.5外源BR对Ca(NO3)2胁迫下黄瓜幼苗生长的影响
由表2可见,Ca(NO3)2胁迫下(CK2)黄瓜幼苗的株高、茎粗、展开叶片数、叶面积和干重含水量均比清水对照(CK1)显著降低,降幅分别为25.23%、16.41%、13.64%、47.67%和20.16%;外源BR处理后均不同程度能缓解Ca(NO3)2胁迫引起的伤害,但不同施用方法缓解效果存在差异。其中,喷叶处理(PY)、浸种+喷叶处理(JP)幼苗各指标与CK2差异均没有达到显著水平,缓解盐胁迫效果不明显;浸种处理(JZ)黄瓜幼苗株高、展开叶片数、叶面积分别比CK2显著提高了19.14%、8.82%、22.04%,缓解盐胁迫效果明显。以上结果说明Ca(NO3)2胁迫下,外源BR 3种施用方法均缓解了其对黄瓜幼苗生长的抑制作用,且浸种处理(JZ)的缓解效果较好。
3结论和讨论
BR在植物体内的独特调节方式,使其从细胞的横向扩展和纵向伸长双重方向诱导了植株的Ca(NO3)2胁迫抗性:BR调节的基因所编码的酶具有木葡聚糖转糖苷酶(xyloglucan endo transglycosylase,XET)的功能,其活性与生长速率呈正相关,BR通过调节编码XET基因的表达来促进细胞壁的松弛,减小壁压,降低水势,使水分和养分进入细胞,促使细胞扩大[15-16];同时BR还可引起H+分泌到细胞壁,使细胞壁pH值降低而诱导细胞壁松弛,细胞壁可塑性的增加使组织伸长速度迅速增加[17]。
Pro和Ss是植物体内主要的渗透调节物质,Pro和Ss含量的升高能维持细胞正常膨压,是细胞内酶和亚细胞结构的保护剂[18],MDA含量越高表明胁迫对植物造成的膜脂过氧化程度越重,POD活性提高能增强植物自身对活性氧的清除能力,减缓由此引发的植物组织坏死。本实验对黄瓜叶片的Pro、Ss、MDA含量和POD活性研究表明,BR浸种处理的Pro、Ss含量显著高于BR喷叶、浸种+喷叶处理,MDA含量显著低于浸种+喷叶处理,POD活性提高幅度最大。因此,0.01 mg·L-1BR浸种诱导的黄瓜幼苗Ca(NO3)2胁迫抗性在生理指标上的效果优于0.1 mg·L-1BR喷叶以及0.01 mg·L-1BR浸种+0.1 mg·L-1BR喷叶处理。
目前认为,盐胁迫对光合作用的抑制主要有以下两个因素[19]:如果Ci、Gs同时下降,是以气孔因素为主;如果Ci升高而Gs下降,则是以非气孔因素为主。本研究中,Ca(NO3)2胁迫后黄瓜幼苗叶片Ci升高,Gs下降,说明Pn的下降是非气孔因素阻碍了CO2的利用,不是因为CO2供应减少所致;Ca(NO3)2胁迫下,施用外源BR使黄瓜叶片Ci上升幅度减小,Pn、Tr有所提高,这表明BR能在一定程度上通过增加CO2的利用率来提高叶片光合速率,从而保持植株有较高的光合性能,提高黄瓜幼苗对Ca(NO3)2胁迫的抗性。从外源BR 3种施用方法对黄瓜幼苗的Gs提高幅度来看,总体表现为经过外源BR浸种的处理要优于未经外源BR浸种的处理,推测植物的不同时期、不同部位对外源BR利用能力不同,种子萌发期比幼苗期能更有效地利用BR来提高其Ca(NO3)2胁迫抗性。胡文海等[20]研究表明,在无盐胁迫条件下0.1 mg·L-1BR喷叶能显著提高黄瓜幼苗Pn、Gs和Tr,本试验中BR喷叶、浸种+喷叶处理对黄瓜幼苗Pn、Gs和Tr提升效果不如BR浸种处理,相对于BR浸种处理而言,BR喷叶处理与Ca(NO3)2胁迫时间间隔较短,BR与Ca(NO3)2综合作用,反而降低了BR对盐胁迫抗性的诱导效果。
过量的Ca(NO3)2会对植物根际造成渗透胁迫,导致植株吸水困难,营养运输产生障碍,从而使Ca(NO3)2胁迫下黄瓜幼苗的生长量显著低于对照。植物功能叶面积的大小直接影响着干物质的合成[21]。本研究发现Ca(NO3)2胁迫对幼苗功能叶叶面积的抑制程度最大、功能叶数目的抑制程度最小,这与周俊国等[22]的研究结果一致。本研究中,0.01 mg·L-1BR浸种处理后Ca(NO3)2胁迫下的黄瓜幼苗各形态指标中,功能叶叶面积增加比例最高,说明外源BR能够通过提高黄瓜幼苗的功能叶叶面积来增加植株生物积累量,从而提高其对Ca(NO3)2胁迫的抗性。
综上所述,外源BR浸种和喷叶均能显著提高Ca(NO3)2胁迫下黄瓜幼苗的生长指标和叶片Pro、Ss含量,降低叶片MDA含量,提高叶片POD活性,促进光合作用进行,从而诱导提高黄瓜幼苗对Ca(NO3)2胁迫抗性,并以0.01 mg·L-1BR浸种这一操作简便、用量极低的方法效果最佳。
参考文献:
[1]李平.温室黄瓜新品种津优35、36号的选育及示范推广[D].北京:中国农业科学院,2013.
[2]张金锦,段增强,李汛.基于黄瓜种植的设施菜地土壤硝酸盐型次生盐渍化的分级研究[J].土壤学报,2012,49(4):673-680.
ZHANG J J,DUAN Z Q,LI X.The classification study on NO3-soil secondary salinization in cucumber-based greenhouse[J].ActaPedologicaSinica,2012,49(4):673-680.
[3]余海英,李廷轩,周健民.设施土壤盐分的累积、迁移及离子组成变化特征[J].植物营养与肥料学,2007,13(4):642-650.
YU H Y,LI Y X,ZHOU J M.Salt accumulation,translocation and ion composition in greenhouse soil profiles[J].PlantNutritionandFertilizerScience,2007,13(4):642-650.
[4]CLOUSE S D,LANGFORD M,MCMORRIS T C.A brassinosteroid-insensitive mutant inArabidopsisthalianaexhibits multiple defects in growth and development[J].PlantPhysiology,1996,111(3):671-678.
[5]CLOUSE S D,SASSE J M.Brassinosteroids:essential regulators of plant growth and development[J].AnnualReviewofPlantBiology,1998,49(1):427-451.
[6]韩刚,李凯荣.油菜素内酯对干旱胁迫下山杏光合作用的影响[J].西北林学院学报,2011,26(4):27-32.
HAN G,LI K R.Effects of brassinolide on photosynthesis ofPrunusarmeniacaL.var.ansuunder drought stress[J].JournalofNorthwestForestryUniversity,2011,26(4):27-32.
[7]MANDAVA N B.Plant growth-promoting brassinosteroids[J].Ann.Rev.PlantPhysiol.PlantMol.Boil,1988,39:233.
[8]ISHWAR S,MARIKO S.Physiological and molecular effects of 24-epibrassinolide,a brassinosteroid on thermos tolerance of tomato[J].PlantGrowthRegulation,2005,47:111-119.
[9]马梅,刘冉,郑春芳,等.油菜素内酯对盐渍下油菜幼苗生长的调控效应及其生理机制[J].生态学报,2015,35(6):1-11.
MA M,LIU R,etal.Regulation of exogenous brassinosteroid on growth of salt-stressed canola seedlings and its physiological mechanism[J].ActaEcologicaSinica,2015,35(6):1-11.
[10]尹博,梁国鹏,贾文,等.外源油菜素内酯介导Cu胁迫下番茄生长及Cu、Fe、Zn的吸收与分配[J].中国生态农业学报,2014,22(5):578-584.
YIN B,LIANG G P,JIA W,etal.Exogenous EBR mediated the plant growth and absorption and accumulation of Cu,Fe and Zn in tomato seedlings under Cu stress[J].ChineseJournalofEco-Agriculture,2014,22(5):578-584.
[11]陆晓民,孙锦,郭世荣,等.油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响[J].园艺学报,2012,39(5):888-896.
LU X M,SUN J,GUO S R,etal.Effects of brassinolide on the mitochondria antioxidant system and cellular ultrastructure of cucumber seedling roots under hypoxic stress[J].ActaHorticulturaeSinica,2012,39(5):888-896.
[12]陆晓民,孙锦,郭世荣,等.低氧胁迫下2,4-表油菜素内酯对黄瓜幼苗叶片光合特性及多胺含量的影响[J].应用生态学报,2012,23(1):140-146.
LU X M,SUN J,etal.Effects of exogenous 2,4-epibrassinolide on the leaf photosynthetic characteristics and polyamines content of cucumber seedlings under hypoxia stress[J].ChineseJournalofAppliedEcology,2012,23(1):140-146.
[13]王丽萍,郭世荣,孙锦,等.Ca(NO3)2和NaCl胁迫下耐盐砧木嫁接黄瓜光合特性及碳同化关键酶基因表达分析[J].南京农业大学学报,2012,35(3):31-36.
WANG L P,GUO S R,SUN J,etal.Analysis of photosynthetic characteristics and key enzyme genes expression of carbon assimilation in cucumber by grafting onto salt-tolerant rootstock under iso-osmotic Ca(NO3)2or NaCl stress[J].JournalofNanjingAgriculturalUniversity,2012,35(3):31-36.
[14]裴孝伯,李世诚,张福墁,等.温室黄瓜叶面积计算及其与株高的相关性研究[J].中国农学通报,2005,21(5):80-82.
PEI X B,LI S C,etal.Study on leaf area calculation and its correlation with plant height of cucumber in greenhouse[J].ChineseAgriculturalScienceBulletin,2005,21(5):80-82.
[15]STEPHEN C F,RACHEL C S,KIRSTIE F R,etal.Xylogoucan endotransgoycosylase,a newwall loosening enzyme activity from plants[J].Biochem,1992,282:821-828.
[16]PURUGGANAN M M,BRAAM J,FRY S C.TheArabidopsisTCH4 xyloglu can endotransglycosylase(substrate specificity,pH optimum,and cold tolerance)[J].PlantPhysiology,1997,115(1):181-190.
[17]CARABA R,LADO P,etal.Regulating effects of brassinosteroids and of sterols on growth and H+secretion in maize roots[J].JournalPlantPhysiology,1984,111:221-225.
[18]徐智敏,何宝燕,李取生,等.盐分胁迫下两个苋菜品种对镉及主要渗透调节物质累积的差异[J].生态学杂志,2015,34(2):483-490.
XU Z M,HE B Y,etal.Differences between two amaranth cultivars in Cd and main osmotic adjustment substances accumulation under salt stress[J].JournalofEcology,2015,34(2):483-490.
[19]周珩,郭世荣,邵慧娟,等.等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响[J].生态学报,2014,34(7):1 880-1 890.
ZHOU H,GUO S R,SHAO H J,etal.Effects of iso-osmotic Ca(NO3)2and NaCl stress on growth and physiological characteristics of cucumber seedlings[J].ActaEcologicaSinica,2014,34(7):1 880-1 890.
[20]胡文海,黄黎锋,毛伟华,等.油菜素内酯对黄瓜苗期叶片光合机构调节作用的研究[J].园艺学报,2006,33(4):762-766.
HU W H,HUANG L F,MAO W H,etal.Role of brassinosteroids in the regulation of photosynthetic apparatus in cucumber leaves[J].ActaHorticulturaeSinica,2006,33(4):762-766.
[21]MARCO F,CALVO E,etal.Physiological and molecular responses of pea plants to ozone stress[J].RecentResearchDevelopmentsinPlantMolecularBiology,2003,1:67-77.
[22]周俊国,朱月林,刘正鲁,等.NaCl胁迫对中国南瓜杂交种成株期根系生理生化特征的影响[J].西北植物学报,2007,27(10):2 052-2 058.
ZHOU J G,ZHU Y L,LIU Z L,etal.Roots physiological and biochemical characteristics ofCucurbitamoschatahybrids at adult plant stage under NaCl stress[J]..ActaBot.Boreal.-Occident.Sin.,2007,27(10):2 052-2 058.
(编辑:裴阿卫)
Inducing Effects of Exogenous BR Application with Different Methods on Ca(NO3)2Stress Resistance of Cucumber Seedlings
LI Yue,SONG Shiqing*,WANG Jiuxing
(College of Horticulture Technology,Hebei Normal University of Science and Technology,Qinhuangdao,Hebei 066600,China)
Abstract:To explore the role of exogenous BR on the induced resistance of cucumber seedlings to Ca(NO3)2stress,we determined the effects of different treatments of exogenous BR (0.01 mg·L-1BR soaking seeds,0.1 mg·L-1BR spraying leaves and combination of both) on growth,physiological indexes,and photosynthetic characteristics of cucumber seedlings under 60 mmol·L-1Ca(NO3)2stress in this paper.The result indicated that:(1)the exogenous BR significantly increased the height,stem diameter,number of expand leaves,leaf area,contents of proline and soluble sugar of cucumber seedlings and decreased the content of MDA,activity of POD increased,promoted the photosynthesis rate,transpiration rate and stomatal conductance of cucumber seedlings and inhibited the increase of intercellular CO2concentration.(2)BR soaking seeds and spraying leaves with suitable concentration of exogenous BR could effectively enhance the cucumber seedlings osmotic adjustment capacity,reduce membrane peroxidation damage,improve antioxidant enzyme activity and photosynthetic efficiency,thus showing Ca(NO3)2stress resistance,and the treatment of 0.01 mg·L-1BR soaking seeds showed the best results.
Key words:brassinosteroid;Ca(NO3)2stress;cucumber;effect of induced resistance
中图分类号:Q945.79
文献标志码:A
作者简介:李悦(1989-),女,硕士,主要从事设施蔬菜逆境生理研究。E-mail:liyue_1989@126.com*通信作者:宋士清,教授,硕士生导师,主要从事设施蔬菜栽培与逆境生理研究。E-mail:qhdsuq@163.com
基金项目:科技部专项“设施蔬菜无公害生产关键技术集成与示范”[国科发农(2013)514号]
收稿日期:2015-10-11;修改稿收到日期:2016-01-17
文章编号:1000-4025(2016)02-0377-06
doi:10.7606/j.issn.1000-4025.2016.02.0377

