马粪海胆单唾液酸神经节苷脂的结构鉴定❋
陶素媛, 丛培旭, 徐 杰, 曹 建, 李兆杰, 薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
马粪海胆单唾液酸神经节苷脂的结构鉴定❋
陶素媛, 丛培旭, 徐杰❋❋, 曹建, 李兆杰, 薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘要:为研究马粪海胆(Hemicentrotus pulcherrimus)神经节苷脂的结构。首先,用Sevennerholm法分配提取其生殖腺,经正相硅胶柱、DEAE-Sephadex A25离子交换柱纯化后,得到2种神经节苷脂组分,分别为HPG-A和HPG-B。其次,进行酸解,获得唾液酸、中性单糖、脂肪酸和长链碱。然后,采用甲基化处理,经气相色谱-质谱联用法测定基本组成结构,经湿法消化和离子色谱法测定硫酸根含量。实验表明:HPG-A的唾液酸组成为N-羟乙酰神经氨酸(Neu5Gc)和少量N-乙酰神经氨酸(Neu5Ac),而HPG-B为8位硫酸化的N-羟乙酰神经氨酸(Neu5Gc8S),且均以2-6键与葡萄糖相连;HPG-A和HPG-B神经酰胺(Cer)的主链长链碱(LCB)组成类似,主要为d16∶0和d18∶0;脂肪酸(FA)组成均以C22∶1和C22∶1 h为主。鉴定出HPG-A为单唾液酸己糖神经节苷脂Neu5Gc2-6Glc1-1Cer和Neu5Ac2-6Glc1-1Cer的混合物,HPG-B为硫酸酯化单唾液酸己糖神经节苷脂Neu5Gc8S2-6Glc1-1Cer。本文为研究马粪海胆单唾液酸神经节苷脂的构效关系提供了理论依据。
关键词:神经节苷脂;海胆;GC-MS;唾液酸
TAO Su-Yuan, CONG Pei-Xu, XU Jie, et al. Structure analysis of monosialoganglioside from the sea urchin Hemicentrotus pulcherrimus [J]. Periodical of Ocean University of China, 2016, 46(2): 61-68.
神经节苷脂(Ganglioside)是一种含有唾液酸的鞘糖脂化合物,由糖链、脂肪酸和一个作为骨架的鞘氨醇类碱基三部分组成。组成神经节苷脂寡糖链的糖通常为D-葡萄糖、D-半乳糖、N-乙酰氨基半乳糖和唾液酸。唾液酸是构成神经节苷脂的必要分子,为一种九碳糖,哺乳动物体内最常见的唾液酸是N-乙酰神经氨酸(Neu5Ac),在一些炎症组织或癌变组织中则会出现N-羟乙酰神经氨酸(Neu5Gc)。神经节苷脂在正常细胞的生长、分化、调节以及信息传递过程中发挥着重要作用,尤其是神经元的成熟和损伤神经的修复再生过程其作用备受关注[1-2]。
目前,常用的神经节苷脂的提取方法是1957年Folch建立的基于氯仿/甲醇/水分配体系[3]。该方法操作简单,适用于大多数脂质的提取,但是,Folch分配提取法容易引入硫苷脂、磷脂酰丝氨酸和其它非脂杂质。Sevennerholm在Folch法的基础上进行了优化[4],目前被广泛使用。神经节苷脂分子本身带负电荷,因此最常用的分离手段为阴离子交换柱层析[5-8]。常用的神经节苷脂分析手段是薄层层析技术,但是由于其灵敏性低不适用于微量分析而逐渐被高效液相色谱和酶联免疫技术等取代[9-11]。但是,这些技术往往需要制备大量的样品和繁琐的步骤。随着技术的发展,气质联用法(GC-MS)、核磁共振波谱法和质谱法等开始运用到神经节苷脂的结构鉴定当中,并逐渐取代传统的方法。气质联用法一直是分析神经节苷脂结构的常规手段,并且由于其在分析脂肪酸和长链碱时的灵敏性和选择性,使其至今仍无法被替代[12]。
海胆(Echinoids,sea urchin)为棘皮动物门(Echinodermata)海胆纲(Echinoidea)动物,属珍贵的海洋食品。现代医学证明,海胆的骨壳、棘刺、生殖腺等部位都具有良好的药用价值,是开发海洋药物的重要资源[13]。海胆的主要活性成分包括多糖、蛋白、脂肪酸、色素、微量元素等[14]。近年来研究发现,海胆生殖腺及精子中含有丰富的神经节苷脂类物质[15-17]。本文以马粪海胆为原料,对其中的单唾液酸神经节苷脂进行分离纯化,并利用化学手段和波谱技术进行结构鉴定,为其它棘皮动物神经节苷脂的分离、鉴定提供方法基础。
1材料与方法
1.1 原料
马粪海胆(Hemicentrotuspulcherrimus)购自大连獐子岛渔业集团股份有限公司。新鲜海胆去壳取生殖腺,冻干后备用。
1.2 仪器与试剂
高效液相色谱仪:Agilent 1100型,配置二极管阵列检测器(DAD)和荧光(FLD)检测器,美国Agilent公司;气相-质谱联用仪:6890N-5973i型,美国Agilent公司;离子色谱仪:ICS-2000型,美国Dionex公司;冷冻干燥机:ALPHA 1-4LD,德国CHRIST公司;旋转蒸发仪:Heidolph Laborota 4000型,德国Heidolph公司。
正相硅胶薄层层析板(硅胶60),德国Merck公司;正相硅胶填料(200~400目),青岛海洋化工厂;反相C8硅胶填料(40~75 μm),日本Fuji公司;离子交换凝胶(DEAE Sephadex-A25),美国GE Healthcare Bio-Sciences公司;ZORBAX Eclipse XDB-C18分析柱(4.6 mm×150 mm,5 μm),ZORBAX SB-C18分析柱(4.6 mm×150 mm,5 μm),HP-5 ms(30 m×0.32 mm,0.25 μm),DB225 ms(30 m×0.25 mm,0.25 μm),DB-1701(30 m×0.25 mm,0.32 μm),美国Agilent公司;Ionpac AS11-HC(4 mm×250 mm),IonPac AG11-HC(4 mm×50 mm),美国Dionex公司。
三甲基硅咪唑(TMS)、乙酸酐(Ac2O)、硼氢化钠、二甲亚砜(DMSO)、葡萄糖(Glc)和半乳糖(Gal)标准品、Neu5Ac和Neu5Gc标准品等购于美国Sigma公司。邻苯二胺基盐酸盐(OPD)购于Bio Basic公司。色谱纯甲醇、乙腈为美国Muskegon公司生产。氯仿、甲醇、丙酮、盐酸、硫酸钾、三氟乙酸(TFA)、1-苯基-3-甲基-5-吡唑啉酮(PMP)、吡啶、碘甲烷、氢化钠、氨水、间苯二酚、硫酸铜均为国产分析纯。
1.3 实验方法
1.3.1 马粪海胆单唾液酸神经节苷脂的分离纯化称取200 mg马粪海胆生殖腺冻干粉,先用10倍体积的氯仿/甲醇(1∶2, v/v)溶液浸提1次,再用氯仿/甲醇(2∶1, v/v)溶液提取2次。提取液合并、过滤后,37 ℃下旋转蒸发得总脂。然后,向总脂中加入3倍体积的水和正己烷进行分配,收集正己烷层,37 ℃下旋蒸干后,再用-20 ℃预冷的丙酮洗涤3次,得丙酮不溶物。该丙酮不溶物经正相硅胶柱层析分离,依次使用氯仿/甲醇/水(80∶15∶1→70∶30∶5→5∶5∶1, v/v)梯度洗脱,各洗脱成分经正相硅胶TLC板检测,展开溶剂为氯仿/甲醇/水(70∶30∶5, v/v)溶液,显色剂为间苯二酚(与唾液酸特异性显紫红色)或硫酸乙醇,合并Rf值相同的组分并旋蒸除去溶剂。将各组分分别加入适量氯仿/甲醇/水(30∶60∶8, v/v)溶解,上样至DEAE-Sephadex A25离子交换层析柱中,以3倍柱体积的氯仿/甲醇/水(30∶60∶8, v/v)溶液淋洗以除去中性脂质,最后,采用含0.1 mol/L乙酸铵的氯仿/甲醇/水(30∶60∶8, v/v)溶液洗脱,收集含唾液酸的组分并浓缩、冻干,得神经节苷脂样品[19]。
1.3.2 基本组成分析
1.3.2.1 脂肪酸与长链碱组成
样品衍生:分别称取1.3.1提纯的神经节苷脂样品1 mg于安瓿管中,加入5%的盐酸-甲醇溶液1 mL,充氮气保护、封管,再于70 ℃下反应8 h。反应结束后,冷却至室温,加入1 mL正己烷萃取脂肪酸甲酯,共萃取3次。合并正己烷层,减压浓缩后经0.22 μm微孔滤膜过滤,4 ℃冷藏,待进行脂肪酸组成分析。余下甲醇层用氨水中和后旋蒸浓缩,再放至50 ℃真空干燥箱中干燥过夜,取出后加入200 μL吡啶溶解后再加入200 μL TMS,70 ℃硅烷化反应30 min后加入200 μL Ac2O/吡啶(1∶1, v/v),90 ℃加热数分钟促溶后100 ℃再反应1 h,加入1 mL水终止反应,4 ℃冷藏,待进行长链碱组成分析。
GC-MS条件:HP-5 ms色谱柱(30 m×0.32 mm,0.25 μm, J&W);进样口温度设为250 ℃,不分流进样;脂肪酸升温程序:从140 ℃开始,以5 ℃/min或7 ℃/min的速度升温至280 ℃,保持10 min;长链碱升温程序:从180 ℃开始,以4 ℃/min的速度程序升温至250 ℃,保持10 min;载气流速为1.2 mL/min,传输线温度:280 ℃;质谱扫描范围:m/z45~550[18]。
对于获得的总离子流图(TIC)和质谱图,采用NIST02数据库比对分析质谱碎片,对峰面积进行归一化处理,得到其脂肪酸和长链碱的相对含量比例。
1.3.2.2 中性单糖组成
样品衍生:取1 mg神经节甘脂样品,加入1 mL 2 mol/L三氟乙酸降解8 h,用PMP进行衍生,定容至5 mL过膜,待进行HPLC分析。
HPLC条件:ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm);紫外检测器,检测波长250 nm;流动相:溶剂A:15% (v/v)乙腈+0.05 mol/L磷酸缓冲液(KH2PO4-NaOH, pH=6.9),溶剂B:40% (v/v)乙腈+0.05 mol/L磷酸缓冲液(KH2PO4-NaOH, pH=6.9);梯度模式:时间梯度,0→10→30 min;对应的溶剂B浓度梯度,0→8%→20%;流速为1.0 mL/min;进样体积为20 μL。
通过Glc和Gal标准品的PMP衍生物的保留时间和峰面积,确定样品的单糖组成及含量比例。
1.3.2.3 唾液酸组成称取1 mg神经节甘脂样品于安瓿管中,加入1 mL 25 mmol/L HCl后超声促溶,封管,80 ℃水解1 h后取出,加入5 mg/mL OPD,溶于1 mL的0.25 mol/L NaHSO4中再置于80 ℃衍生反应30 min,定容至5 mL过膜,待进行HPLC分析[21];唾液酸标准品按同样步骤衍生及分析。
HPLC条件:ZORBAX SB C18色谱柱(4.6 mm×150 mm,5 μm);流动相:0.5%磷酸水-乙腈-四氢呋喃(94∶5∶1, v/v),紫外检测波长230 nm,荧光激发波长230 nm,荧光发射波长425 nm。
1.3.2.4 硫酸根含量的测定
样品处理:采用湿法消化,取少量待测样品,以P2O5减压干燥24 h,准确称取1 mg样品溶于安瓿瓶,加入1 mL 6 mol/L HCl,封管,于110 ℃消化24 h,80 ℃左右氮气吹干,加超纯水定容至25 mL,用于测定分析。
离子色谱条件:Ionpac AS11-HC色谱柱(4 mm×250 mm);IonPac AG11-HC保护柱(4 mm×50 mm);抑制器为ASRS ULTRA II阴离子抑制器,抑制电流为90 mA;电导检测器;20 mmol/L KOH等度洗脱,流速为1.2 mL/min;程序时间为8 min,数据采集速率为5.0 Hz;柱温30 ℃;进样体积:25 μL。标准品溶液为25 mmol/L K2SO4。
1.3.3 结构分析
1.3.3.1 甲基化分析按改良的Hakomori法进行甲基化。步骤如下:1 mg样品中加入1 mL DMSO,转移至50 mL烧瓶中加热搅拌,加入100 mg NaH反应约30 min至溶液呈橙黄色;避光慢慢加入750 μL碘甲烷继续反应1 h后加入1 mL水终止反应,用2 mL二氯甲烷萃取3次,合并二氯甲烷层,并水洗3次;置50 ℃烘箱中烘干,加入1 mL 2 mol/L三氟乙酸后转移至安瓿管中封管,于105 ℃下降解6 h,减压旋蒸干燥,反复加入2 mL甲醇旋蒸除去三氟乙酸(至瓶壁上附着物呈白色);加入5 mg NaBH4和1 mL 2 mmol/L NaOH 70 ℃条件下反应1 h,转入旋蒸瓶中旋蒸干燥,反复加入1 mL甲醇旋蒸除硼酸(瓶壁附着物呈白色),挥干后减压干燥过夜;加入2 mL Ac2O/吡啶(1∶1, v/v)90 ℃条件下加热数分钟促溶后,100 ℃反应1 h,加入1 mL蒸馏水终止反应,二氯甲烷萃取3次再水洗3次,减压浓缩后进行GC-MS分析中性单糖连接方式。唾液酸在强酸溶液中不稳定,结构易遭破坏,水解时必须使用较弱的酸性条件,一般以含5%~10%盐酸的无水甲醇溶液70 ℃条件下进行甲醇解。水解结束后直接进行乙酰化反应,温度设为80 ℃。减压浓缩后进行GC-MS分析唾液酸取代位置。
1.3.3.2 气相色谱-质谱联用结构鉴定GC-MS分析条件:中性单糖衍生物使用DB-225 ms色谱柱(30 m×0.25 mm,0.25 μm)分析,采用程序升温的方法,起始温度为170 ℃,保持1 min,再以2 ℃/min的速度升温至230 ℃,保持20 min,载气为氦气,流速1 mL/min。质量扫描范围为m/z40~450 amu。酸性唾液酸分析使用DB-1701色谱柱(30 m×0.25 mm,0.32 μm),升温程序为:起始温度为200 ℃,以2.5 ℃/min的速度升温至250 ℃,保持10 min,载气流速1.2 mL/min,质量扫描范围为m/z40~500 amu。质谱进样口温度设为250 ℃,传输线温度280 ℃,EI离子源230 ℃。将所获得的中心单糖衍生物、唾液酸的质谱图分别与NIST02标准质谱库及文献进行比对,得到其结构信息。
2结果与讨论
2.1 马粪海胆单唾液酸神经节苷脂的提取纯化
马粪海胆总脂经硅胶柱层析,薄层色谱法检测合并Rf值相同的组分,获得2个组分记为HPG-A和HPG-B,Rf值分别为0.42和0.35,二者表现出较大的极性;经间苯二酚显色确定分子中含有唾液酸组分,进而推测这2种组分为神经节苷脂,硅胶柱层析后的样品中残留有磷脂杂质,需进一步采用离子交换柱层析除杂,分别对2组化合物进行纯化以除去磷脂,得到不含磷脂的样品。
2.2 基本组成分析
2.2.1 脂肪酸和长链碱组成按照1.3.2.1中的方法对样品HPG-A和HPG-B进行衍生,通过GC-MS法分别测定脂肪酸(FA)和长链碱(LCB)组成,所获得的质谱图与NIST02标准质谱库进行比对,对峰面积进行归一化处理,获得各脂肪酸和长链碱的相对含量。结果显示,样品HPG-A和HPG-B主要的脂肪酸和长链碱组成大致相同,脂肪酸中有羟基脂肪酸,不含多不饱和脂肪酸,主要脂肪酸为C22∶1和C22∶1 h;长链碱主要由植物鞘氨醇型碱基(t系)组成,主要长链碱为t18∶0和t16∶0,只含有少量d系鞘氨醇,结果见表1。
马粪海胆单唾液酸神经节苷脂与海参来源的神经节苷脂相比,脂肪酸组成相似,但是其长链碱结构简单,海参中除了植物鞘氨醇型还有鞘氨醇型。而海星神经节苷脂脂肪酸和长链碱结构较为固定,一般由α羟基脂肪酸和植物鞘氨醇组成[18]。与哺乳动物来源的神经节苷脂相比,海洋棘皮动物来源神经节苷脂的脂肪酸链明显增长,不饱和脂肪酸比例升高,出现了明显的羟基化,这也可能是其生物活性明显增强的原因[19]。
2.2.2 单糖、唾液酸及硫酸根分析采用文献[20]中的方法,分析样品中的中性单糖组成,发现海胆中2种神经节苷脂均只含有葡萄糖。每毫克HPG-A样品约含0.87 μmol葡萄糖;按1.3.2.3中的方法对样品进行水解衍生,水解后唾液酸开环形成α-酮酸类物质,邻苯二胺可专一地与之反应生成喹诺啉类物质,在230 nm紫外光激发下会产生荧光,串联HPLC可实现对不同唾液酸的分离从而进行定量分析[21]。分析样品中的唾液酸组成,发现样品HPG-A中的唾液酸主要为N-羟乙酰神经氨酸(Neu5Gc),另有少量的N-乙酰神经氨酸(Neu5Ac),两者峰面积比约为15∶1,唾液酸含量约为0.84 μmol,样品HPG-A中总唾液酸含量与葡萄糖的摩尔比接近1∶1,见表2。硫酸根测定结果显示样品HPG-A中不含硫酸根。推测样品HPG-A结构为Neu5Gc(或Neu5Ac)-Glc-Cer。
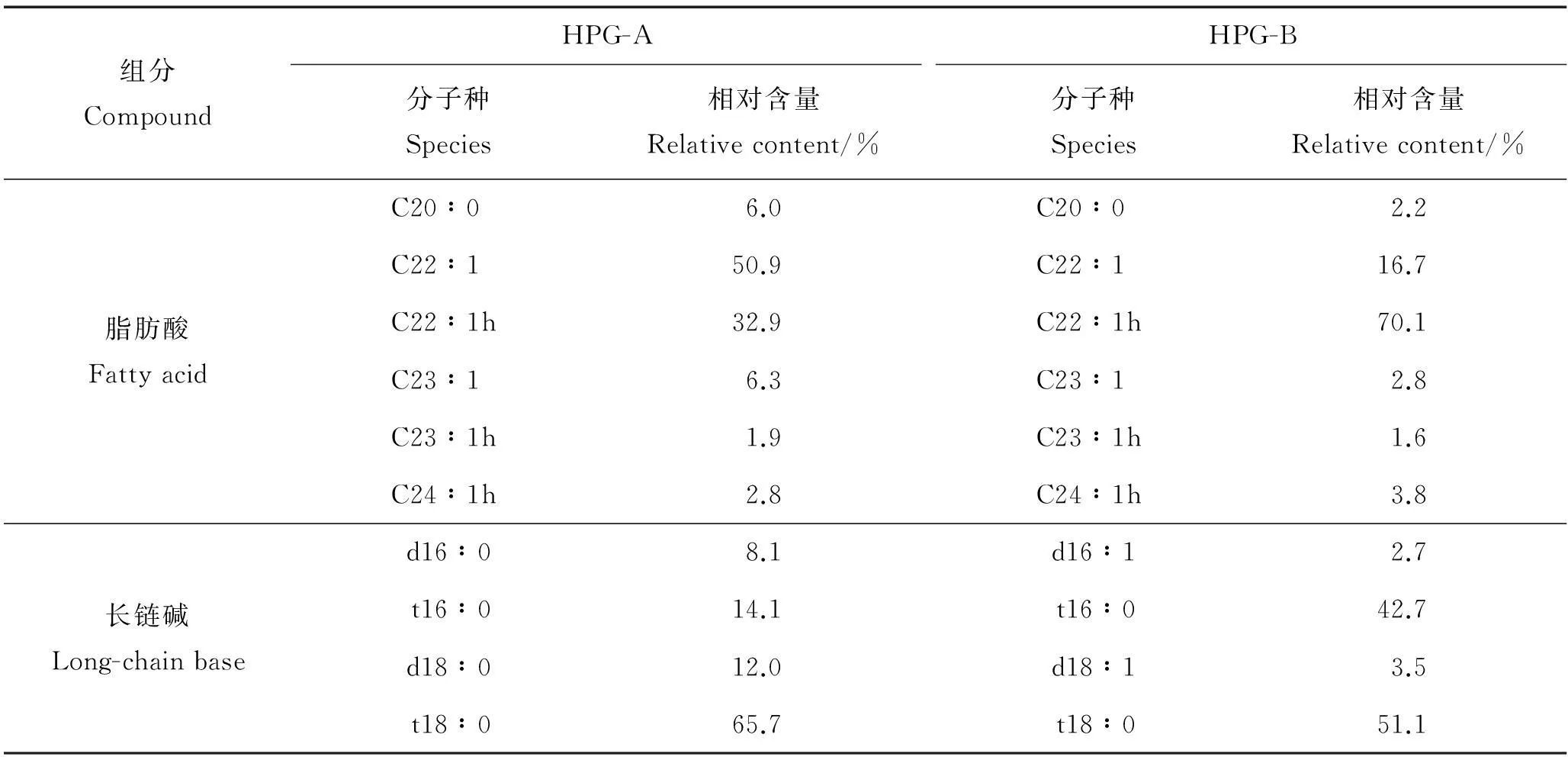
表1 HPG-A和HPG-B脂肪酸及长链碱组成
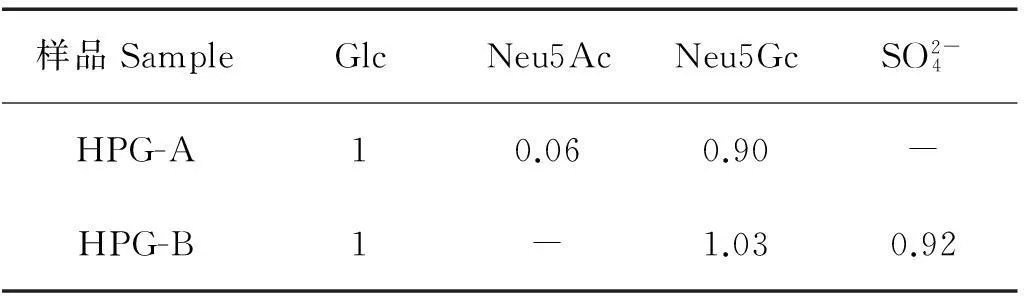
表2 HPG-A和HPG-B中糖组分及硫酸根的摩尔比
注:数值为摩尔比,设葡萄糖摩尔含量为1;“-”表示未检出。
Note: The values represent molar ratios, and molar content of glucose is set to be 1; “-” means undetected.
每毫克样品HPG-B约含0.81 μmol葡萄糖;只有Neu5Gc一种唾液酸;根据HPG-B中硫酸根在离子色谱上的色谱图[22],计算出样品中硫酸根含量为0.86 μmol/mg。样品HPG-B中葡萄糖、Neu5Gc和硫酸根的物质的量近似相等。棘皮动物神经节苷脂中硫酸酯基通常位于唾液酸上[19],由此推测样品HPG-B结构为Neu5Gc8S-Glc-Cer。与马粪海胆相比,海星和海胆神经节苷脂糖链中基本上也都存在一个二糖基本结构,海星为Neu5Ac(或Neu5Gc)-Gal-Glc-Cer,与哺乳动物相似,而海参为Neu5Ac(或Neu5Gc)-Glc-Cer,硫酸酯化仅在海胆与海参中出现[19]。
2.3 结构鉴定结果
糖脂样品中含有脂链,在其甲基化衍生物的GC-MS图中除有单糖的甲基化衍生物峰外,还有一些归属于脂肪酸和LCB的峰。根据基本组成测定结果,样品HPG-A和HPG-B中只有葡萄糖一种中性单糖,在分析中性单糖时,以m/z=117(糖环中2-羟基未被取代的己糖均产生该碎片)作为特征离子进行提取,可获得简化的中性单糖部分甲基化糖醇乙酸酯衍生物(PMAA)的提取离子色谱(EIC)图(见图1)。

图1 HPG-A和HPG-B中性单糖部分甲基化糖醇乙酸酯衍生物的EIC图(m/z=117)
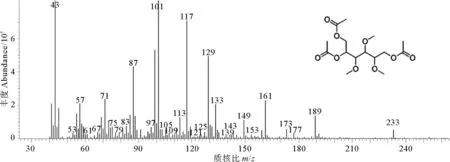
图2 2,3,4-三氧甲基-三乙酰基-D-葡萄糖醇的质谱图(衍生自6-位取代葡萄糖)
样品HPG-A和HPG-B的测定结果显示,两者含有同一种中性单糖甲基化衍生物,在EIC谱图上保留时间为30.17 min(见图1);峰1产生m/z=117、161、189的特征峰,鉴定出其的结构为2,3,4-三甲基-1,5,6-三乙酰基-D-葡萄糖醇(见图2),检索NIST 02谱库与标准谱图匹配度为98%,葡萄糖的C6位被唾液酸取代,可推断唾液酸是以2-6键连接于葡萄糖上。
根据唾液酸组成测定结果,样品HPG-A中只含有Neu5Gc和Neu5Ac,以二者共有的离子碎片(脱掉与2位碳相连的羧甲酯、5位碳上的N-乙酰基及所有与氧相连的甲基)其m/z=201为特征离子提取色谱图,获得简化的色谱图,图3。各峰质谱图见图4a和图4b,根据m/z=155、318、376特征峰,鉴定出峰2为甲基化N-乙酰基-2,4,7,8,9-四氧甲基神经氨酸(衍生自NeuAc)[23],根据m/z=159、284、378特征峰,鉴定出峰3为甲基化N-羟乙酰基-2,4,7,8,9-四氧甲基神经氨酸(衍生自NeuGc)[24]。根据唾液酸和硫酸根测定结果,样品HPG-B中唾液酸被硫酸酯化,提取m/z=406,HPG-B唾液酸特有的离子碎片(脱掉与8位碳相连的氧乙酰基)作为特征离子获得简化的色谱图(见图3),根据m/z=183、375、406特征峰,鉴定出色谱峰4(Rt=13.5 min)为甲基化N-羟乙酰基-8-氧乙酰基-2,4,7,9,11-五氧甲基神经氨酸[25],C8位上乙酰基说明硫酸酯化发生于该位点。色谱图中未发现其它唾液酸衍生物色谱峰。

图3 HPG-A(m/z=201)和HPG-B (m/z=406)中部分甲基化唾液酸乙酯的EIC图
综合甲基化分析的结果,推断出马粪海胆HPG-A的结构为非硫酸酯化单唾液酸神经节苷脂Neu5Gc(或Neu5Ac)2-6Glc1-1Cer;HPG-B的结构为硫酸酯化单唾液酸神经节苷脂Neu5Gc8S2-6Glc1-1Cer。研究表明,海胆和海参神经节苷脂中唾液酸通过α2-6键与葡萄糖相连,但是海星中唾液酸通过α2-3键与乳糖相连,哺乳动物中唾液酸通过α2-3键与半乳糖相连。糖基和连接方式的差异都会影响神经节苷脂的活性[26]。
3结语
采用氯仿/甲醇/水体系提取,经过正相硅胶柱层析和离子交换柱层析,从马粪海胆中分离得到2种单唾液酸单己糖神经节苷脂。HPG-A相对含量在1‰左右,提取率在70%~80%;HPG-B相对含量在2‰左右,提取率大于90%。通过HPLC、GC-MS等化学、光谱、质谱等手段鉴定了2种化合物的单糖、脂肪酸、长链碱和硫酸根的组成及其唾液酸、糖链的连接方式,进而推测出其结构。HPG-A和HPG-B的长链碱组成基本相同,主要为2-氨基-1,3,4-三羟基-十六烷和2-氨基-1,3,4-三羟基-十八烷;脂肪酸组成也大致相同,主要以C22∶1和C22∶1h为主(二者含量占总脂肪酸的80%以上),C20∶0、C22∶1、C22∶1h、C23∶1、C23∶1h和C24∶1h等脂肪酸相对含量略有差异。鉴定出HPG-A为Neu5Gc2-6Glc1-1Cer和Neu5Ac2-6Glc1-1Cer组成的混合物,HPG-B为Neu5Gc8S2-6Glc1-1Cer。由于海洋特殊的生态环境,使得海洋生物中所含神经节苷脂的结构和活性都比较独特,从棘皮动物中发现的大多数神经节苷脂其结构均明显有别于陆生哺乳动物体内神经节苷脂,具有良好的研究前景。通过对马粪海胆神经节苷脂结构的初步分析,可为以后其它棘皮动物神经节苷脂生物活性研究及其产品开发应用奠定基础。

图4 峰2(a),峰3(b),峰4(c)的质谱图
参考文献:
[1]Rampersaud A A, Oblinger J L, Ponnappan R K, et al. Gangliosides and growth factor receptor regulation [J]. Biochem Soc T, 1999, 27(4): 415-422.
[2]Alter M. GM1 ganglioside for acute ischemic stroke [J]. Ann N Y Acad Sci, 1998, 19(845): 371-401.
[3]Folch J, Lees M, Stanley G H S. A simple method for the isolation and purification of total lipids from animal tissues [J]. J Biol Chem, 1957, 226(1): 497-509.
[4]Svennerholm L, Fredman P. A procedure of the quantitative isolation of brain gangliosides [J]. Biochimica Biophys Acta, 1980, 617(1): 97-109.
[5]熊雄, 刘松青. 神经节苷脂分离纯化过程中的共性问题 [J]. 中国药业, 2002, 11(5): 41-42.
Xiong X, Liu Q S. The common problem in the process of separation and purification of ganglioside [J]. China Pharm, 2002, 11(5): 41-42.
[6]Ledeen R W, Yu R K, Eng L F. Ganglioside of human myelin: sialosylgalactosylceramide (G7) as a major component [J]. J Neurochem, 1973, 21(4): 829-839.
[7]Nakamuru K, Inagaki F, Tamai Y. A novel gangliosides in dogfish brain [J]. J Biol Chem, 1988, 263(20): 9896-9900.
[8]Keiko T A, Harumi K, Philip I, et al. Isolation and characterization of a unique sulfated gangliosides, sulfated GM1a from rat kidney [J]. Glycobiology, 1998, 8(4): 341-350.

[10]Filip M, Ladislav T, Libor V, et al. Estrogen-induced cholestasis results in a dramatic increase of b-series gangliosides in the rat liver [J]. Biomed Chromatogr, 2007, 21(5): 446-450.
[11]Garcia A D, Chavez J L, Mechref Y. Rapid and sensitive LC-ESI-MS of gangliosides [J]. J Chromatogr B, 2014, 947-948(2): 1-7.
[12]Yamada K, Tanabe K, Miyamoto T, et al. Isolation and structure of a monomethylated ganglioside possessing neuritogenic activity from the ovary of the sea urchinDiademasetosum[J]. Chem Pharm Bull, 2008, 56(5): 734-737.
[13]阎红, 任珅, 张晶, 等. 海胆的化学成分及药理活性研究概况 [J]. 中国药师, 2008, 11(1): 51-53.
Yan H, Ren K, Zhang J, et al. The chemical and pharmacological activity of sea urchins [J]. China Pharmacist, 2008, 11(1): 51-53.
[14]李伟, 张付云, 孙秋颖, 等. 海胆及其共附微生物的活性物质研究进展 [J]. 食品研究与开发, 2010, 31(9): 202-206.
Li W, Zhang F Y, Sun Q Y, et al. Advances of the active substances from sea urchin and symbiotic microorganism [J]. Food Res Dev, 2010, 31(9): 202-206.
[15]Muralidhar P, Radhika P, Krishna N, et al. Sphingolipids from marine organisms: A Review [J]. Nat Prod Sci, 2003, 9(3): 117-142.
[16]Takeshi I, Ken K, Yu S, et al. Isolation and identification of novel sulfated and nonsulfated oligosialyl glycosphingolipids from sea urchin sperm [J]. Glycoconjugate J, 1996, 13(3): 401-413.
[17]Yamada K, Tanabe K, Miyamoto T, et al. Isolation and structure of a monomethylated gangliosides possessing neuritogenic activity from the ovary of the sea urchinDiademasetosum[J]. Chem Pharm Bull, 2008, 56(5): 734-737.
[18]徐杰. 海参脑苷脂的分离纯化、结构分析及其生物活性研究[D]. 青岛: 中国海洋大学, 2011.
Xu J. Studies on the purification, analysis and bioactivities of cerebrosides from sea cucumbers [D]. Qingdao: Ocean University of China, 2011.
[19]Ryuichi H, Masanori I, Koji Y, et al. Biologically active gangliosides from echinoderms [J]. Nat Med, 2007, 61(4): 367-370.
[20]李国云, 王玉明, 陈士国, 等. 柱前衍生高效液相色谱法测定鲍鱼中糖原含量[J]. 食品工业科技, 2010, 31(12): 341-343.
Li G Y, Wang Y M, Chen S G, et al. Pre-column derivatization-HPLC for the determination of glycogen in balance[J]. Sci Tech Food Ind, 2010, 31(12): 341-343.
[21]曹妍, 徐杰, 高焱, 等. 白燕与血燕的营养成分分析和比较[J]. 食品工业科技, 2011, 32(10): 414-417.
Cao Y, Xu J, Gao Y, et al. Comparative analysis of nutritional components in white-edible bird’s nest (EBN) and Red-EBN [J]. Sci Tech Food Ind, 2011, 32(10): 414-417.
[22]Masafumi K, Koji Y, Tomofumi M, et al. Neuritogenic activity of gangliosides from echinoderms and their structure-activity relationship [J]. Chem Pharm Bull, 2007, 55(3): 462-463.
[23]Koji Y, Yasuo H, Tomofumi M, et al. Isolation and structure of a new ganglioside molecular species from the sea cucumberHolothuriapervicax[J]. Chem Pharm Bull, 2000, 48(1): 157-159.
[24]Kaneko M, Kisa F, Yamada K, et al. Structure of neuritogenic active ganglioside from the sea cucumberStichopusjaponicus[J]. Eur J Org Chem, 1999, 1999(11): 3171-3174.
[25]Yamada K, Harada Y, Nagaregawa Y, et al. Isolation and structure of biologically active gangliosides from the sea cucumberHolothuriapervicax[J]. Eur J Org Chem, 1998, 1998(11): 2519-2525.
[26]Inagaki M, Saito T, Miyamoto T, et al. Isolation and structure of hematoside-type ganglioside from the starfishLinckialaevigata[J]. Chem Pharm Bull, 2009, 57(2): 204-206.
责任编辑朱宝象
Structure Analysis of Monosialoganglioside from the Sea UrchinHemicentrotuspulcherrimus
TAO Su-Yuan, CONG Pei-Xu, XU Jie, CAO Jian, LI Zhao-Jie, XUE Chang-Hu
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:Gangliosides are a group of glycosphingolipids containing one or more sialic acid residues. It has been proved to be one of the most important bioactive compositions of echinodermata and play essential roles in severe pathologies. To research the structure of gangliosides in sea urchin, a method of extraction, purification and identification of monosialoganglioside has been developed. Two ganglisides, HPG-A and HPG-B, with different structures, were isolated with Sevennerholm method from the germen of the sea urchin Hemicentrotus pulcherrimus using silica gel column chromatography and DEAE-Sephadex A25 column chromatography, their chemical structures were determined by methylation analysis using gas chromatography-mass spectrometry, and the content of sulfate radical wasdetermined by wet digestion and high performance ion chromatography. Compared to the NIST02 standard mass spectral library, the sialic acid of HPG-A was identified to be a mixture of Neu5Gc and a small amount of Neu5Ac while HPG-B was identified to be Neu5Gc8S. All of them were 2~6 linked sialic acid, which is different from that in mammals where the monosaccharide components were both glucose. The long-chain bases of HPG-A were t16∶0 and t18∶0, which were similar to those of HPG-B. The main fatty acids were C22∶1 and C22∶1 h, but the relative amount of C20∶0, C22∶1, C22∶1 h, C23∶1, C23∶1 h, C24∶1 h was different. HPG-A was identified to be a mixture of Neu5Gc2-6Glc1-1Cer and a small amount of Neu5Ac2-6Glc1-1Cer, and HPG-B was identified to be Neu5Gc8S2-6Glc1-1Cer. The relative content of HPG-A was about 1‰ and the extraction rate was between 70% and 80%. It was twice more in HPG-B than in HPG-A with a higher extraction rate (more than 90%). Because of the special ecological environment, the structure and activity of gangliosides in the marine lives are unique. And it has been proved that the gangliosides with different structures have different bioactivities. The research of gangliosides from sea urchin Hemicentrotus pulcherrimus will make sense for the further research of structure-activity relationship.
Key words:ganglioside; sea urchin; GC-MS; sialic acid
DOI:10.16441/j.cnki.hdxb.20150002
中图法分类号:TS201.2
文献标志码:A
文章编号:1672-5174(2016)02-061-08
作者简介:陶素媛(1990-), 女, 硕士生。E-mail:taosuyuan@163.com❋❋通讯作者:E-mail:xujie9@ouc.edu.cn
收稿日期:2015-01-12;
修订日期:2015-07-07
基金项目:❋国家自然科学基金项目(31330060;31201329);新世纪优秀人才项目(NCET-13-0534)资助
引用格式:陶素媛, 丛培旭, 徐杰, 等. 马粪海胆单唾液酸神经节苷脂的结构鉴定[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 61-68.
Supported by National Natural Science Foundation of China (31330060;31201329); New Century Excellent Talents in University (NCET-13-0534)

