不同海拔地区AECOPD患者血清IL-2、纤维蛋白原水平变化及其与肺功能的关系
何五建,李延贞,耿红霞,冶凤英
(青海省人民医院,西宁810007)
不同海拔地区AECOPD患者血清IL-2、纤维蛋白原水平变化及其与肺功能的关系
何五建,李延贞,耿红霞,冶凤英
(青海省人民医院,西宁810007)
摘要:目的探讨不同海拔地区急性加重期慢性阻塞性肺疾病(AECOPD)患者血清白细胞介素 2(IL-2)、纤维蛋白原水平变化以及其与肺功能的相关性。方法 选取处于中海拔地区的AECOPD患者 42例、稳定期COPD患者40例和健康体检人群40例, 高海拔地区的 AECOPD 患者30例、稳定期患者32例和健康体检人群30例。采空腹静脉血用 ELISA法测定IL-2水平,缩双脲法检测纤维蛋白原。并分析中海拔地区AECOPD 患者血清IL-2、纤维蛋白原水平与第1秒用力呼气容积(FEV1)的相关性。结果同海拔地区,与稳定期患者及健康对照比较,AECOPD 患者血清 IL-2 水平低,血清纤维蛋白原水平高(P均<0.01);与健康对照比较,稳定期患者血清 IL-2 水平低,血清纤维蛋白原水平高(P均<0.01)。与中海拔地区比较,高海拔地区同疾病类型人群血清 IL-2 水平低,血清纤维蛋白原水平高(P均<0.01)。中度海拔地区AECOPD 患者血清IL-2 水平与 FEV1呈正相关(r=0.8449,P<0.01),血清纤维蛋白原水平与 FEV1呈负相关(r=-0.7545,P<0.05)。 结论 中、高海拔地区AECOPD患者IL-2 水平降低,纤维蛋白原水平升高,以高海拔地区为著;血清IL-2、纤维蛋白原水平与肺功能之间均存在相关性。
关键词:急性加重期慢性阻塞性肺疾病;白细胞介素2;纤维蛋白原;第1秒用力呼气容积;海拔高度
慢性阻塞性肺疾病(COPD)是一种危害人类健康的常见病。COPD的病理特征是慢性炎症,被激活的炎症细胞可释放许多炎性介质及细胞因子,破坏肺的结构和(或)促进中性粒细胞炎症反应,是引起气流阻塞的主要原因[1]。急性加重期慢性阻塞性肺疾病(AECOPD)是指 COPD 的急性起病过程,其特征是患者呼吸系统症状恶化,超出日常变异。频繁急性发作可使气道炎性标记物增加,并导致肺功能减退[2]。系统性炎性标记物包括纤维蛋白原、白细胞介素和肿瘤坏死因子等,其升高与肺通气功能减退相关联[2]。
西宁地区平均海拔 2 260 m,其空气中的氧含量只有平原地区的 76%。玉树州平均海拔 4 200 m,其空气中的氧含量约为海平面的 65%左右,两地区分别属于中海拔及高海拔地区。有研究表明,长期慢性低氧可引起机体巨噬细胞激活、产生氧自由基,进而释放多种细胞因子[3]。目前国内外研究均显示白细胞介素、纤维蛋白原等参与了 COPD 发病机制的不同阶段,但目前关于西宁市及玉树州两个中、高海拔地区AECOPD 发病机制的报道不多。因此本文探讨在西宁市及玉树州两个不同海拔条件下 AECOPD 患者血清 IL-2、纤维蛋白原水平的不同,以及此二者与肺功能的相关性。
1资料与方法
1.1临床资料选择 2013年12月~ 2014年3月青海省人民医院收治的AECOPD患者42例(AECOPD组),男30例、女12例,年龄(66.86±9.82)岁;稳定期COPD患者40例(稳定期组),男30例、女10例,年龄(68.40±8.17)岁;健康体检者40 例(对照组),男28例、女12例,年龄(63.27±9.54)岁。同期玉树州医院收治的 AECOPD 患者 30 例(AECOPD组),男17例、女13例,年龄(65.48±10.06)岁;稳定期COPD患者32例(稳定期组),男20例、女12例,年龄(66.68±7.25)岁;健康体检者30例(对照组),男16例、女14例,年龄(62.67±6.54)岁。各组年龄、性别有可比性。
1.2检测方法采取空腹静脉血标本5 mL 静置30 min 后常温下3 000 g离心 15 min,取血清置于-80 ℃冰箱保存待测。用双抗体夹心ELISA 法测定IL-2水平。采用双缩脲法检测纤维蛋白原。用德国 Jdeger 肺功能测定仪检测中海拔 AECOPD 患者肺功能[第1秒用力呼气容积(FEV1)]。

2结果
2.1各组中、高海拔地区血清IL-2、纤维蛋白原水平比较见表1。
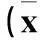
表1 各组中、高海拔地区血清 IL-2 、
注:与对照组同海拔比较,*P<0.01;与稳定期组同海拔比较,ΔP<0.01;与同组中海拔比较,#P<0.01。
2.2中海拔地区AECOPD患者IL-2、纤维蛋白原与FEV1的相关分析IL-2与FEV1呈正相关(r=0.8449,P<0.01),纤维蛋白原与FEV1呈负相关(r=-0.7545,P<0.05)。
3讨论
慢性炎症学说是COPD主要发病机制。目前普遍认为,COPD的主要炎症特征为在肺脏不同部位有肺泡巨噬细胞、T 淋巴细胞(尤其是 CD8+)、中性粒细胞、肥大细胞等炎症细胞的活化,释放多种炎性细胞因子和介质,包括白三烯 B4、IL-2、肿瘤坏死因子 α( TNF-α)和其他介质,这些细胞因子能介导中性粒细胞诱发的炎症反应、破坏肺脏的结构[4]。
IL-2由Th1细胞分泌,能使Thl扩增,在抗感染中具有重要作用,然而IL-2需与激活的膜白介素2受体(mIL-2R)结合才能发挥其免疫调节作用。正常人的血清中有少量的 sIL-2R 表达,而当机体发生炎症反应或自身免疫性疾病时,其表达水平会明显升高,通过竞争性抑制作用减少抗体的自分泌效应,使得 IL-2 实际结合减少,大大减弱 IL-2对靶细胞的生物学作用,此过程参与疾病的发生、发展过程[5,6]。王爱华等[7]发现,与正常对照组比较,血清 IL-2 水平在肺心病组与慢性支气管炎组中明显降低。崔建华等[8]的研究表明,进藏健康青年 IL-2 的表达水平及活性均降低,高原低氧环境不利于 T 细胞增殖及分化。本研究结果显示,同海拔地区AECOPD组血清 IL-2 水平明显低于相应稳定期组和对照组,稳定期组与对照组比较,前者血清 IL-2 水平明显低于后者,各组高海拔地区IL-2水平低于中海拔地区。与相关文献[9]报道一致。这表明高海拔地区 COPD 患者既存在免疫功能降低,又存在调节功能失调,易导致感染急性加重。IL-2 水平升高可能机制有:①AECOPD患者 CD3+、CD4+、CD4+/CD8+与健康人比较明显降低[10],患者反复呼吸系统感染导致免疫功能缺陷,Th1 细胞数量减少,进一步导致Th1 细胞分泌的 IL-2 减少[11];②可能与AECOPD患者长期反复使用糖皮质激素有关。Arioz等[12]的实验证实,AECOPD患者治疗期间多使用多种形式的糖皮质激素,其能够显著抑制 IL-2 与IL-2R 相结合,并能抑制活化的 T 细胞产生和分泌 IL-2;③AECOPD 患者气道及肺部感染导致T细胞、B 细胞及巨噬细胞激活,表达并释放更多的 IL-2R,导致血清 IL-2 水平因消耗而降低[13]。④在长期慢性低氧环境下,健康人群T淋巴细胞趋化因子受体7 的表达明显低于正常,这进一步导致T淋巴细胞杀伤活性降低,使机体免疫力受损。
近年研究发现,在COPD 发展过程中,缺氧、高碳酸血症等因素可影响机体凝血机制,使血小板激活、各种凝血因子及纤维蛋白原增加。纤维蛋白原是气道炎症的系统性炎性标记物,它是一种大分子糖蛋白,主要由肝脏合成,是血浆中含量最高的凝血因子,也是一种急性炎症时相蛋白。国外研究报道,COPD 患者在稳定期纤维蛋白原水平升高,急性加重期进一步升高。本研究显示:同海拔地区AECOPD组血清纤维蛋白原水平明显高于相应稳定期组和对照组,稳定期组与对照组比较,前者血清纤维蛋白原水平高于后者。高海拔地区纤维蛋白原高于中海拔地区。提示血清纤维蛋白原水平与AECOPD患者的病情及患者所处的海拔高度有关。纤维蛋白原在AECOPD中及高海拔地区中升高的机制主要为:①纤维蛋白原主要由肝细胞合成、分泌,感染、组织损伤等可上调肝脏纤维蛋白原基因表达;②肝脏是合成纤维蛋白原的主要部位,COPD因缺氧而出现肝脏功能损害,从而使纤维蛋白原合成减少;③COPD肺部感染状态下,中性粒细胞、T淋巴细胞分泌包括IL-6在内的多种细胞因子,IL-6可诱导T淋巴细胞激活,诱导肝细胞产生急性期蛋白如纤维蛋白原,加重炎症反应;④高海拔地区缺氧环镜下可导致肺血管广泛收缩和肺动脉高压,常伴有血管内膜增生、重组。纤维蛋白原增加,红细胞表面负荷下降,凝血酶原被激活,出现高凝状态。
肺功能是判断气流受限的客观指标,FEV1是评价肺功能的常用指标。本研究结果显示,AECOPD 组血清 IL-2与FEV1呈正相关,纤维蛋白原与FEV1呈负相关。表明纤维蛋白原、白细胞介素等指标与肺通气功能有关。
总之, IL-2、纤维蛋白原与AECOPD发生发展存在一定关系,并且随海拔高度不同而改变,这为后续对其发病机制的研究和探讨提供了一定的资料。
参考文献:
[1] Barnes PJ, Shapiro SD, Pauwels RA. Chronic obstructive pulmonary disease: molecular and cellular mechanisms[J]. Eur Respir J, 2003,22(4):672-688.
[2] Gan WQ, Man SF, Senthilselvan A, et al. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis[J]. Thorax, 2004,59(7):574-580.
[3] 崔建华,张西洲,何富文,等.健康青年进驻高原血清TNF-α和 IL-6 的变化[J].西北国防医学杂志,1999,20(3):197-198.
[4] Ekberg-Aronsson M, Pehrsson K, Nilsson JA, et al. Mortality in GOLD stages of COPD and its dependence on symptoms of chronic bronchitis[J]. Respir Res, 2005,6:98.
[5] Arioz DT, Altindis M, Tokyol C, et al. Human papillomavirus typing and soluble interleukin-2 receptor levels in female sex workers with a negative cervical smear result[J]. Int J Gynaecol Obstet, 2009,106(3):210-212.
[6] Barak V, Selmi C, Schlesinger M, et al. Serum inflammatory cytokines, complement components, and soluble interleukin 2 receptor in primary biliary cirrhosis[J]. J Autoimmun, 2009,33(3-4):178-182.
[7] 王爱华,李全新.IL-2、IL-4、IL-6和IL-8在慢性阻塞性肺部疾病发病中作用的初探[J].江西医药,2000,35(2):72-73.
[8] 崔建华,张西洲,何富文,等.进驻高原健康青年血清白细胞介素-2的活性变化[J].西藏医药杂志,2000,21(3):5-6.
[9] 李琛,张玲玲,赵洪茹.老年慢性阻塞性肺疾病急性加重期患者细胞免疫功能的变化[J].中国临床研究,2010,23(12):1094-1095.
[10] 崔丽华.慢性阻塞性肺疾病患者血清IL-2、IL-6及IL-12表达与生活质量的关系[J].山东医药,2010,50(37):50-51.
[11] Horst HJ, Flad HD. Corticosteroid-interleukin 2 interactions: inhibition of binding of interleukin 2 to interleukin 2 receptors[J]. Clin Exp Immunol, 1987,68(1):156-161.
[12] Arioz DT, Altindis M, Tokyol C, et al. Human papillomavirus typing and soluble interleukin-2 receptor levels in female sex workers with a negative cervical smear result[J]. Int J Gynaecol Obstet, 2009,106(3):210-212.
[13] Barak V, Selmi C, Schlesinger M, et al. Serum inflammatory cytokines, complement components, and soluble interleukin 2 receptor in primary biliary cirrhosis[J]. J Autoimmun, 2009,33(3-4):178-182.
(收稿日期:2015-06-23)
中图分类号:R563
文献标志码:B
文章编号:1002-266X(2016)01-0059-03
doi:10.3969/j.issn.1002-266X.2016.01.022

