支原体肺炎患儿外周血IL-35水平变化及其与NK细胞数、中性粒细胞功能的相关分析
袁浩,周毅峰,尹军,谢良伊
(1湖南省人民医院,长沙410005;2湖南师范大学医学院)
支原体肺炎患儿外周血IL-35水平变化及其与NK细胞数、中性粒细胞功能的相关分析
袁浩1,周毅峰1,尹军2,谢良伊1
(1湖南省人民医院,长沙410005;2湖南师范大学医学院)
摘要:目的观察支原体肺炎(MPP)患儿血清IL-35水平变化,并探讨其与自然杀伤(NK)细胞数和中性粒细胞功能的相关性。 方法 选择MPP患儿64例(观察组),健康体检儿童16例(对照组)。分别采用ELISA法检测血清IL-35;流式细胞术检测NK细胞所占百分比;金黄色葡萄球菌吞噬试验检测中性粒细胞的吞噬功能,IL-35与NK细胞所占百分比和中性粒细胞功能之间的相关性分析采用Pearson相关分析法。 结果与对照组比较,观察组血清IL-35水平升高(P<0.05),NK细胞所占百分比与中性粒细胞吞噬率降低(P均<0.05);MPP患儿外周血中IL-35水平与NK细胞数所占百分比呈负相关(r=-0.401,P﹤0.05),IL-35水平与中性粒细胞吞噬率、吞噬指数呈负相关(r分别为-0.373、-0.388,P均﹤0.05)。结论 MPP患儿血清IL-35水平升高,其与NK细胞数和中性粒细胞功能均呈负相关关系。
关键词:支原体肺炎;IL-35;自然杀伤细胞;中性粒细胞
目前支原体肺炎(MPP)发病机制尚不完全明确,但是大量研究认为,其与免疫反应密切相关。白细胞介素35(IL-35)是至今发现的唯一一种由调节性T(Treg)细胞产生,抑制效应性T细胞活性的细胞因子,它的发现对于炎症反应、自身免疫病、Ⅰ型糖尿病等的免疫治疗有重要意义[1,2]。研究证实,IL-35主要是由Treg细胞分泌,是Treg细胞发挥免疫负调控的主要细胞因子[3,4]。国内外最新研究显示,IL-35 能抑制效应性T淋巴细胞、Th17 和CD8+T细胞的增殖,但与其他非T 细胞(NK 细胞、中性粒细胞、树突状细胞、Mφ等)的关系仍然未知。国内外多项研究证实,非T细胞在MPP患儿疾病发生发展过程中发挥了与T细胞同样重要的作用。本研究观察了小儿MPP患者外周血IL-35的水平变化,并探讨了其与NK 细胞及中性粒细胞功能的相关性。现报告如下。
1.1临床资料选择2015年1~5月本院收治MPP患儿64例(观察组),均符合MPP诊断标准[5]。男36例、女28例,年龄6个月~7岁,按MP-IgM抗体滴度分为1∶80、1∶160、1∶320、1∶640四个亚组。临床表现为发热、咳嗽等症状,肺部有中小湿啰音,胸片可见一侧肺中或下野斑片状模糊影,MP-IgM抗体阳性。选择16例本院健康体检儿童为对照组,其中男8例、女8例,年龄1~6岁。两组性别及年龄具有可比性。
1.2标本的采集与处理于清晨空腹抽静脉血6 mL。其中2 mL促凝血3 500 r/min离心10 min后分离出血清,置于-70 ℃保存待检用于IL-35检测;2 mL EDTA-K抗凝血用于NK细胞检测;2 mL肝素抗凝血用于中性粒细胞吞噬功能检测试验。抗凝血均于当天采集后立即检测。
1.3血清IL-35检测采用ELISA法。每孔各加入标准品或待测样品100 μL,将反应板充分混匀后置37 ℃ 40 min。用洗涤液将反应板充分洗涤4~6次,在滤纸上印干。每孔加入蒸馏水和第一抗体工作液各50 μL(空白除外)。将反应板充分混匀后置37 ℃反应20 min。再次洗板,每孔加酶标抗体工作液100 μL,将反应板置37 ℃ 10 min。第3次洗板,每孔加入底物工作液100 μL,置37 ℃暗处反应15 min。每孔加入100 μL终止液混匀,30 min内用酶标仪在450 nm处测吸光值。所有A值减除空白值后再行计算,以标准品为横坐标,A值为纵坐标,作图,画出标准曲线。根据样品A值计算出相应IL-35水平。
1.4外周血中性粒细胞吞噬功能测定将金黄色葡萄球菌标准菌株ATCC25923置水浴中加热100 ℃ 10 min杀死细菌,用无菌生理盐水稀释成6×108/mL备用;吸取60 μL肝素钠抗凝血置于洁净凹玻片的凹孔内,加上述葡萄球菌菌液20 μL,充分混匀。然后置入铺有湿纱布的有盖容器内(此容器先放37 ℃温箱中预温),在37 ℃温箱中作用30 min,其间每隔10分钟摇匀一次;作用完毕,取1小滴混合液置于洁净无油污的载玻片一端,推成薄片。待干后,滴加瑞氏A染液作用1~2 min,再滴加瑞氏B染液(洗耳球吹匀)作用2~3 min,水洗印干,置油镜下观察。随机计数100个中性粒细胞,分别记录发生吞噬和未吞噬的白细胞数,对有吞噬作用的白细胞,同时记录所吞噬的细菌数。结果分析:吞噬率即100个中性粒细胞中吞噬有细菌的细胞数;吞噬指数为将100个中性粒细胞所吞噬的细菌总数除以100,得到每个白细胞吞噬细菌的平均数,即为吞噬指数。
1.5外周血NK细胞所占百分比测算采用流式细胞术。选用以下组合抗体,CD3-FITC/ CD( 16+56)-PE同时染色,圈定CD3-CD16+CD56+细胞即NK 细胞;流式管中加入50 μL MPP患儿EDTA抗凝血和CD3、CD16、CD56抗体各2 μL,混匀,室温避光孵育20 min,然后加入1 mL溶血素反应10 min,3 000 r/min离心10 min,去上清,加PBS溶液300 μL,用流式细胞仪测定。
2结果
2.1各组外周血IL-35水平、NK细胞所占百分比、中性粒细胞吞噬率及吞噬指数比较见表1。
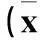
表1 各组外周血IL-35水平、NK细胞所占百分比、中性粒细胞吞噬率及吞噬指数比较±s)
注:与对照组比较,*P<0.05;与1:160组比较,#P<0.05。2.2相关性分析MPP患儿中血清IL-35水平与外周血NK细胞所占百分比呈负相关(r=-0.401,P﹤0.05),与中性粒细胞吞噬率呈负相关(r=-0.373,P﹤0.05),与中性粒细胞吞噬指数呈负相关(r=-0.388,P﹤0.05)。
3讨论
近年MPP发病年龄提前,发病率在婴幼儿中有逐年升高趋势,病情严重者可导致死亡[6~7]。目前MPP发病机制尚不完全明确,但是其发病机制与免疫功能相关已得到广泛认同,并且认为免疫反应是MPP致病的重要因素[8]。所以,MPP患儿的免疫功能状况及控制其发生发展过程成为研究热点。
IL-35属于IL-12家族,2007年被证实在免疫、炎症性疾病病情调控中扮演重要角色。新近研究显示,IL-35可能与呼吸系统疾病的发病及进展有关[9]。本研究结果显示,MPP患儿各组中血清IL-35水平均较对照组明显升高。说明在健康儿童机体内IL-35表达处于正常水平,而当MP侵入患儿机体时,引起免疫系统紊乱,出现氧化应激和炎症反应,此时IL-35出现高表达,以防止损伤程度加重。
中性粒细胞是机体最重要的炎症细胞,是防御外来病原体的第一道防线。当外来病原菌进入机体时,炎症因子诱导中性粒细胞趋化和局部浸润,通过吞噬、呼吸爆发和脱颗粒杀灭病原体,从而发挥天然免疫清除病原体的效应。中性粒细胞表面表达IgG Fc受体和补体C3b受体,也可通过调理作用促进和增强中性粒细胞的吞噬、杀菌作用。本研究结果显示,MPP患儿中性粒细胞吞噬率较对照组下降,说明MP感染机体后,机体出现免疫功能紊乱,表现为患儿免疫功能低下,易于细菌感染。其机制可能与以下原因有关:①MP感染减少中性粒细胞表面FcrRI的表达,改变了中性粒细胞对胞外病原体的吞噬调理作用[10],降低其吞噬功能;②MPP患儿细胞免疫功能紊乱,IgA水平升高[11]和C3水平降低[12],IgA水平升高抑制了中性粒细胞吞噬作用或与抗原形成抗原抗体复合物,而后者封闭了中性粒细胞Fc和C3受体,致使被调理的微生物不易被中性粒细胞吞噬。C3b由C3裂解而来,C3降低必然导致C3b减少,使得金黄色葡萄球菌得不到调理,就不易被中性粒细胞吞噬[13]。
NK细胞是机体重要的免疫细胞,与抗肿瘤、抗病毒感染和免疫调节有关,某些情况下参与超敏反应和自身免疫性疾病的发生。由于NK细胞的杀伤活性无MHC限制,不依赖抗体,因此称为自然杀伤活性。NK细胞通过自然杀伤和 抗体依赖的细胞介导的细胞毒性作用,发挥重要的免疫调节功能,对获得性免疫的启动至关重要。本研究结果显示观察组NK细胞所占百分比明显低于对照组,说明MP感染患儿后,机体的非特异性免疫受到严重抑制,其可能机制为MP感染后抑制了NK细胞表面的受体,阻断了介导信号的传导,使NK细胞活性被抑制[14]。
本研究还显示, MPP患儿血清IL-35水平与 NK细胞数和中性粒细胞功能均呈负相关性。提示IL-35可能通过抑制NK细胞增殖和中性粒细胞功能而抑制过强的免疫反应,保护机体免受过度免疫反应伤害。
参考文献:
[1] Youn YS, Lee KY. Mycoplasma pneumoniae pneumonia in children[J]. Korean J Pediatr, 2012,55(2):42-47.
[2] Collison LW, Workman CJ, Kuo TT, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J]. Nature, 2007,450(7169):566-569.
[3] Chaturvedi V, Collison LW, Guy CS, et al. Cutting edge: Human regulatory T cells require IL-35 to mediate suppression and infectious tolerance[J]. J Immunol, 2011,186(12):6661-6666.
[4] Whitehead GS, Wilson RH, Nakano K, et al. IL-35 production by inducible costimulator (ICOS)-positive regulatory T cells reverses established IL-17-dependent allergic airways disease[J]. J Allergy Clin Immunol, 2012,129(1):207-215.
[5] 胡亚美,江载芳,诸福棠.实用儿科学(7版)[M].北京:人民卫生出版社,2003:1204-1205.
[6] Chalker V, Stocki T, Mentasti M, et al. Increased incidence of Mycoplasma pneumoniae infection in England and Wales in 2010: multiocus variable number tandem repeat analysis typing and macrolide susceptibility[J]. Euro Surveill, 2011,16(19):19865.
[7] Bezerra PG, Britto MC, Correia JB, et al. Viral and atypical bacterial detection in acute respiratory infection in children under five years[J]. PLoS ONE, 2011,6(4):e18928.
[8] Hayakawa M, Taguchi H, Kamiya S, et al. Animal model of Mycoplasma pneumoniae infection using germfree mice[J]. Clin Diagn Lab Immunol, 2002,9(3):669-676.
[9] Little FF, Delgado DM, Wexler PJ, et al. Salivary inflammatory mediator profiling and correlation to clinical disease markers in asthma[J]. PLoS ONE, 2014,9(1):e84449.
[10] Pugliese A, Vidotto V, Beltramo T, et al. Phagocytic activity in human immunodeficiency virus type 1 infection[J]. Clin Diagn Lab Immunol, 2005,12(8):889-895.
[11] 韩文宁,李锦亮,李丽.肺炎MPP患儿免疫功能的变化与分析[J].中华全科医学,2012,10(1):60-61.
[12] 黄洋,杨磊,张琳.支原体肺炎患儿医院感染的危险因素分析[J].中华医院感染学杂志,2014,24(12):3070-3074.
[13] 张翠红,夏雯.肺癌患者化疗后血清IL-2、IL-8和中性粒细胞吞噬功能的研究[J].临床和实验医学杂志,2009,8(11):7-8.
[14] Gan X, Zhang L, Solomon GF, et al. Mechanism of norepinephrine-mediated inhibition of human NK cytotoxic functions: inhibition of cytokine secretion, target binding, and programming for cytotoxicity[J]. Brain Behav Immun, 2002,16(3):227-246.
(收稿日期:2015-10-08)
中图分类号:R563.1
文献标志码:B
文章编号:1002-266X(2016)01-0057-03
doi:10.3969/j.issn.1002-266X.2016.01.021
基金项目:湖南省教育厅科研项目(14C0701);长沙市科技局科研项目(K1403060-31);湖南省人民医院仁术重点课题(2013)。

