抗凋亡融合蛋白PTD-Bcl-xL原核表达载体的构建及表达纯化
王晓晔,石博妹,王英群,李 珣,刘徳玉,李 铭,李芳芳,胡传活
(1.广西大学 动物科学技术学院,广西 南宁 530005;2.广西畜禽品种改良站,广西 南宁 530001)
抗凋亡融合蛋白PTD-Bcl-xL原核表达载体的构建及表达纯化
王晓晔1,石博妹1,王英群2,李珣1,刘徳玉2,李铭2,李芳芳2,胡传活1
(1.广西大学 动物科学技术学院,广西 南宁530005;2.广西畜禽品种改良站,广西 南宁530001)
摘要:人工抗凋亡蛋白PTD-Bcl-xL能保护多种因素引起的细胞异常凋亡,为了获得高纯度Bcl-xL与PTD(Protein transduction domains)的融合蛋白,首先采用TRIzol法提取SD大鼠肝脏总RNA,将RNA反转录为cDNA,设计引物以cDNA为模板,PCR扩增Bcl-xL基因,构建pUM19-T-Bcl-xL质粒,并对质粒双酶切鉴定和测序鉴定;其次设计包含PTD序列的Bcl-xL引物,以测序正确的pUM19-T-Bcl-xL质粒为模板,PCR扩增PTD-Bcl-xL序列,将扩增序列克隆入pET28a载体,构建PTD-Bcl-xL蛋白的原核表达质粒pET28a-PTD-Bcl-xL,并对pET28a-PTD-Bcl-xL载体双酶切鉴定和测序鉴定;将pET28a-PTD-Bcl-xL重组质粒转化大肠杆菌BL21(DE3),用IPTG诱导表达,并对IPTG诱导融合蛋白表达的浓度和诱导时间进行了优化;SDS-PAGE分析表达蛋白的可溶性情况,在变性条件下用Ni-NTA琼脂纯化融合蛋白;最后用SDS-PAGE、Western Blot及质谱对融合蛋白进行鉴定。结果表明:双酶切pUM19-T-Bcl-xL质粒出现约774 bp大小条带,pUM19-T-Bcl-xL质粒测序结果与NCBI数据库比对序列一致,表明成功构建pUM19-T-Bcl-xL质粒;双酶切pET28a-PTD-Bcl-xL质粒出现约744 bp大小条带,pET28a-PTD-Bcl-xL质粒测序结果与预期序列一致,表明成功构建了pET28a-PTD-Bcl-xL原核表达载体;在IPTG诱导下pET28a-Bcl-xL重组质粒在大肠杆菌BL21(DE3)中表达出36 kDa大小蛋白,最优IPTG诱导浓度为0.1 mmol/L,最佳IPTG诱导时间为6 h;SDS-PAGE电泳显示融合蛋白主要出现在菌液超声后的沉淀里,以包涵体形式表达,经Ni-NTA琼脂纯化获得了高纯度的融合蛋白;Western Blot 和质谱鉴定证明IPTG诱导表达蛋白和纯化的融合蛋白为PTD-Bcl-xL蛋白。纯化得到了PTD-BcL-xL融合蛋白,推进了 PTD-Bcl-xL蛋白在猪、牛等家畜精液冷冻保存的应用进程。
关键词:Bcl-xL蛋白;PTD;原核表达;蛋白纯化
Bcl-2家族蛋白是重要的凋亡调节因子,Bcl-xL和Bcl-xS是Bcl2L1编码的2个剪接变异体,Bcl-xL蛋白具有抗凋亡作用,Bcl-xS发挥促凋亡作用。Bcl-xL主要分布在线粒体外膜、内质网膜、核膜,与Bad、Bax等促凋亡蛋白结合形成异源二聚体[1]抑制其发挥促凋亡作用,Bcl-xL蛋白能使从细胞质转移至线粒体的Bax重新回归细胞质[2],Bcl-xL蛋白还能与Beclin-1蛋白结合,从而提高细胞的存活率[3]。在人类胚胎干细胞中,过度表达Bcl-xL的细胞出现与含有CNV(Copy number variant)染色体干细胞有相似的生长特性,一旦抑制Bcl-xL蛋白表达,CNV细胞生长优势受到限制,提示Bcl-xL在CNV细胞生长中起到关键作用[4]。在神经系统中,Bcl-xL蛋白不仅能帮助神经体抵抗死亡刺激,还能促进神经递质的释放和突触的生长发育[5]。多种资料提示Bcl-xL蛋白在体内外都能发挥重要的抗凋亡作用。
蛋白转导域结构(Protein transduction domains,PTD)是一段由11个氨基酸(YGRKKRRQRRR)组成的短肽[6],能行使跨膜转运功能[7],并且能通过共价连接和非共价连接的方式介导外源的蛋白质、脂质体、核酸、药物等多种物质进入细胞[8-9],转运过程不依赖受体和蛋白载体,也不需要能量参与[10]。目前,国内少有关于PTD-Bcl-xL蛋白的研究报道。因此,本研究利用PTD蛋白转导快速、高效、无细胞毒性的特点,将PTD蛋白和Bcl-xL蛋白融合在一起,用RT-PCR扩增大鼠Bcl-xL基因,构建Bcl-xL高效克隆质粒和PTD-Bcl-xL的原核表达质粒,诱导大肠杆菌表达PTD-Bcl-xL融合蛋白,并对表达蛋白进行分离、纯化和鉴定,目的是为了获得PTD-Bcl-xL融合蛋白,为进一步研究PTD-Bcl-xL蛋白在组织细胞和动物精子冷冻保存的应用提供基础理论依据。
1材料和方法
1.1试验动物
SD大鼠购于广西医科大学实验动物中心。
1.2菌株载体及试剂
克隆宿主菌E.coliDH5α、表达宿主菌E.coliBL21(DE3)、表达质粒载体pET28a均为广西大学动物科学技术学院解剖实验室保存。克隆载体质粒pUM19-T、TRIzol、cDNA反转录试剂盒、2×TaqPlus Master Mix、DNA Marker、限制性内切酶EcoR Ⅰ 、Hind Ⅲ和SalⅠ、T4连接酶、抗His标签抗体和辣根过氧化物酶标记的山羊抗鼠IgG均为南京诺唯赞生物科技有限公司产品;氨苄青霉素、卡那霉素、IPTG为北京索莱宝科技有限公司产品;蛋白Marker为Thermo公司产品;PCR产物胶纯化回收试剂盒和质粒小提试剂盒为Biomiga公司产品。
1.3引物设计与合成
根据GenBank中已发表的大鼠Bcl-xL基因序列(Accession No.U72350),设计一对引物:上游引物Bcl-F,5′-TCACTTCCGACTGAA-3′;下游引物Bcl-R,5′-ATGTCTCAGAGCAAC-3′。同时设计含有PTD基因的另一条引物:上游引物Bcl-PTD-F,5′-ATT GAATTCTATGGCAGGAAGAAGCGGAGACAGCGACG AAGAATGTCTCAGAGCAACCGG-3′(下划线处为EcoR Ⅰ识别位点);下游引物Bcl-PTD-R,5′-AGT GTCGACCTTCCGACTGAAGAGTG-3′(下划线处为SalⅠ识别位点),均由上海生工生物工程股份有限公司合成。
1.4Bcl-xL基因的扩增、克隆与鉴定
取大鼠肝脏组织,用TRIzol试剂提取总RNA,反转录合成cDNA第一条链(反应条件:25 ℃ 5 min,50 ℃ 45 min,85 ℃ 5 min),以2 μL反转录产物为模板,Bcl-R和Bcl-F为上下游引物进行PCR扩增:94 ℃预变性 5 min;94 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸 30 s,循环数为35;最后于72 ℃延伸7 min。预期产物分子量为702 bp。将扩增得到的PCR产物纯化回收后克隆入pUM19-T载体,再转化大肠杆菌DH 5α,阳性单菌落经PCR和EcoR Ⅰ、Hind Ⅲ双酶切鉴定后,送华大基因公司进行目的基因测序。
1.5PTD-Bcl-xL基因的扩增
以测序正确的pUM19-T-Bcl-xL质粒为模板,用引物PTD-BcL-R和PTD-Bcl-F进行PCR扩增(反应条件同1.4),PCR产物经1%琼脂糖凝胶电泳检测,对正确PCR产物片段用胶纯化回收试剂盒回收。
1.6PTD-Bcl-xL融合蛋白原核表达载体的构建
将PTD-Bcl-xL的PCR产物胶纯化回收及载体质粒pET28a分别进行EcoR Ⅰ和SaIⅠ双酶切,然后用T4连接酶将PTD-Bcl-xL的cDNA片段与线性化载体质粒pET28a连接,转化DH5α感受态细胞,挑取阳性单菌落经PCR、酶切及测序鉴定后抽提阳性质粒,将重组质粒命名为pET28a-PTD-Bcl-xL。
1.7诱导融合蛋白表达IPTG浓度的优化
将重组质粒pET28a-PTD-Bcl-xL转化E.coliBL21(DE3)感受态细胞,挑取单菌落,37 ℃ 220 r/min振荡培养过夜,以1∶100比例接种至新的LB(含卡那霉素100 mg/mL)培养基中培养,至OD600=0.4~0.6时,IPTG浓度优化试验分6组进行,第1组为不加IPTG诱导组,第2组为pET28a空载体诱导组(0.5 mmol/L IPTG诱导),第3~6组IPTG诱导浓度分别为0.1,0.5,1.0,1.5 mmol/L诱导5 h后收集菌体,进行全菌SDS-PAGE电泳分析。
1.8诱导融合蛋白表达时间的优化
当OD600=0.4~0.6时,加入浓度为0.5 mmol/L的IPTG诱导蛋白表达,分8组进行试验,第1~8组IPTG诱导时间分别为0,2,3,4,5,6,7,8 h,收集菌体,进行全菌SDS-PAGE电泳分析。
1.9融合蛋白表达的可溶性分析
当OD600=0.4~0.6时,加入IPTG使其终浓度为0.1 mmol/L,37 ℃ 220 r/min振荡培养6 h收集菌体,用0.02 mol/L PBS(pH值8.0)重悬,超声破碎(50 W,工作5 s,间隔5 s,超声2 min),12 000 r/min 15 min离心收集上清和沉淀,沉淀用PBS液重悬。将上清和沉淀进行SDS-PAGE电泳分析。
1.10融合蛋白纯化
将含有重组质粒的阳性菌按1∶100的体积比接种到500 mL含100 mg/mL 卡那霉素的LB培养基中,37 ℃振荡培养至OD600=0.4~0.6时,加入IPTG使其终浓度0.1 mmol/L,诱导6 h后收集菌体,用0.02 mol/L PBS(pH值8.0)液重悬菌体,超声破碎(50 W工作5 s,间隔5 s,超声20 min),10 000 r/min 30 min离心,弃上清,保留沉淀,蛋白的纯化依照QIAGEN公司Ni-NTA(Nickel-nitriacetic acid) argrose使用方法[11]进行操作。
1.11原核表达产物和纯化蛋白的Western Blot分析
确定融合蛋白最优表达条件后,取诱导表达产物和纯化后的洗脱蛋白,进行SDS-PAGE分析,用半干转法将蛋白转到NC(硝酸纤维素)膜上;然后用丽春红染色,洗膜;用PBST配制的5%脱脂乳封闭1 h,PBST洗膜;一抗用抗His标签抗体(1∶5 000)室温孵育1 h,洗膜;二抗山羊抗鼠IgG(1∶10 000)孵育40 min,洗膜;用ECL发光显色法显色3 min,用透明保鲜膜封闭放入暗盒曝光5 min,再放入显影液显色,定影液定影1 min,用扫描仪扫描图片保存。
1.12洗脱蛋白的质谱鉴定
将Western Blot鉴定正确的纯化后蛋白跑SDS-PAGE电泳,用R250考马斯亮蓝染液染色后切下蛋白条带,送广西大学亚热带生物重点实验室用基质辅助激光解吸附串联飞行时间质谱仪(型号MALDI-TOF 4800 plus ABSciex公司)进行质谱鉴定。
2结果与分析
2.1Bcl-xL基因扩增及pUM19-T-Bcl-xL重组质粒鉴定
Bcl-xL基因PCR扩增产物经1.5%琼脂糖凝胶电泳检测,在预期位置出现约为702 bp单一条带(图1-A)。将该片段插入pUM19-T载体构建重组质粒经EcoR Ⅰ和Hind Ⅲ双酶切、琼脂糖电泳,在预期位置出现一条约774 bp的单一片段(图1-B)。将构建的pUM19-T-Bcl-xL重组质粒送测序、拼接,序列与NCBI数据库提供的序列完全一致,提示扩增到Bcl-xL基因CDS区全长序列,成功构建pUM19-T-Bcl-xL重组质粒。
2.2PTD-Bcl-xL基因扩增及原核表达载体的构建
pUM19-T-Bcl-xL基因扩增产物经1.5%琼脂糖电泳,在预期位置出现735 bp大小单一条带(图2-A)。胶回收PCR产物,将胶回收产物和pET28a(+)载体分别经过双酶切、连接、转化DH5α感受态细菌,构建pET28a-PTD-Bcl-xL的重组质粒,经EcoR Ⅰ和SalⅠ双酶切、琼脂糖电泳后出现约744 bp大小条带,与预期结果相符(图2-B)。经测序正确,表明成功构建了PTD-Bcl-xL原核表达载体。
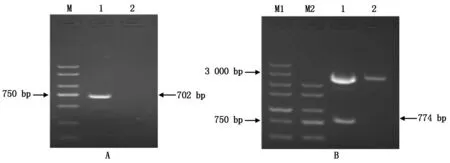
A.Bcl-xL基因的RT-PCR扩增:M.DL2000 DNA Marker;1.Bcl-xL基因;2.阴性对照;B.pUM19-T-Bcl-xL重组质粒酶切鉴定:

A.PTD-Bcl-xL基因的RT-PCR扩增:M.DL2000 Marker;1.PTD-Bcl-xL基因;2.阴性对照;B.pET28a-PTD-Bcl-xL重组质粒酶切鉴定:
2.3不同IPTG浓度与PTD-Bcl-xL融合蛋白表达量的关系
鉴于不同IPTG浓度在蛋白表达过程中的重要作用,本试验摸索了 0,0.1,0.5,1.0,1.5 mmol/L 5种 IPTG 浓度与融合蛋白表达的量的关系,SDS-PAGE电泳分析显示,以未诱导和空载体诱导为对照,发现在36 kDa大小处诱导表达出融合蛋白,但是IPTG浓度在0.1~1.5 mmol/L对PTD-Bcl-xL融合蛋白表达量的影响不明显(图3),因此,鉴于IPTG对细菌的毒性,最终选择的IPTG的最佳诱导浓度为0.1 mmol/L。
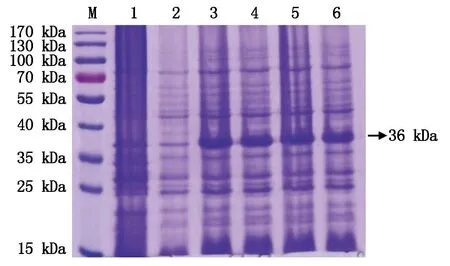
M.蛋白分子量标准;1.未诱导;2.pET28a空载体的IPTG诱导表达;3~6.分别为0.1,0.5,1.0,1.5 mmol/L IPTG诱导融合蛋白表达。
M.Protein Marker;1.Expression without IPTG induction;2.Expression of pET28a with IPTG induction;3-6.Expression of PTD-Bcl-xL with 0.1,0.5,1.0,1.5 mmol/L IPTG induction.
图3不同IPTG浓度与融合蛋白表达量的关系
Fig.3Relationship between different concentration
of IPTG and fusion protein expression
2.4IPTG不同诱导时间与PTD-Bcl-xL融合蛋白表达量的关系
为了探索融合蛋白表达的最优IPTG诱导时间,笔者分析了IPTG诱导2~8 h融合蛋白表达量,以未诱导的菌液为对照,其结果表明,在IPTG诱导的各个时间段均有约36 kDa融合蛋白的表达;且表达量随着IPTG诱导时间的增加而增多,但是6~8 h之间融合蛋白表达量差异不明显(图4),因此,选择6 h作为IPTG诱导表达的最佳时间。
2.5PTD-Bcl-xL融合蛋白表达的可溶性分析与纯化
用试验确定的IPTG最佳诱导时间和浓度诱导表达PTD-Bcl-xL融合蛋白,SDS-PAGE显示表达产物主要存在于菌体超声破碎的沉淀中,以包涵体的形式表达(图5-A)。将包涵体用低浓度尿素洗涤后,高浓度尿素溶解,镍离子亲和层析柱纯化,一次纯化就能得到较高纯度的融合蛋白(图5-B)。
2.6PTD-Bcl-xL融合蛋白的Western Blot 鉴定
Western Blot鉴定结果显示,未诱导的菌体超声后上清和沉淀未出现特异性条带;诱导的菌体超声后沉淀中出现PTD-Bcl-xL特异性条带,而上清中在相应位置未出现阳性反应(图6-A)。纯化后蛋白Western Blot 分析出现特异性条带(图6-B)。
2.7融合蛋白的质谱鉴定
质谱测序结果证实所纯化蛋白为PTD-Bcl-xL蛋白(图7)。

M.蛋白分子量标准;1.未诱导;2~8.IPTG诱导

M.蛋白标准分子量;A.融合蛋白的溶解性分析:1.裂解上清;2.裂解沉淀;3.未诱导上清;

A.表达产物的Western Blot鉴定:M.蛋白标准分子量;1~2.裂解沉淀;3.裂解上清;

图7 PTD-Bcl-xL MS+MS/MS鉴定结果
3结论与讨论
本研究以大鼠肝脏总RNA为模板,通过RT-PCR成功扩增出Bcl-xL基因编码区702 bp全长序列,设计引物将PTD的11个氨基酸(YGRKKRRQRRR)序列设计在Bcl-xL编码区的5′端,之后以pUM19-T-Bcl-xL为模板,用RT-PCR的方法扩增了PTD-Bcl-xL序列,定向插入pET28a载体中,双酶切和测序均证实pET28a-PTD-Bcl-xL质粒的正确性,表明成功构建了pET28a-PTD-Bcl-xL原核表达质粒。
在蛋白诱导表达中myc标签和his标签是常用的融合标签,myc重组蛋白在低pH值洗脱过程中会降低蛋白的活性,常用于目的蛋白的检测,而his标签不存在这个问题,且his标签只有6个氨基酸,分子量小,不会改变目的蛋白自身的可溶性,在pH值8.0时,不携带电荷,对蛋白的折叠、构象形成等影响较小,容易分离纯化。Asoh等[12]曾用myc标签成功表达了PTD-myc-Bcl-xL融合蛋白,而用其他标签表达PTD-Bcl-xL融合蛋白在国内外未曾报道,pET28a是融合型原核表达载体,融合标签为6×his-tag,因此,本试验选用pET28a载体表达PTD-Bcl-xL融合蛋白。
将pET28a-PTD-Bcl-xL质粒转化大肠杆菌BL21(DE3),加入IPTG诱导蛋白表达时,笔者对诱导蛋白表达的最佳条件进行了探索。鉴于IPTG诱导浓度对蛋白表达的重要作用,首先进行IPTG浓度梯度诱导蛋白表达试验,结果发现,IPTG诱导浓度为0.1~1.5 mmol/L 时均能诱导融合蛋白表达,且不同浓度IPTG诱导表达量差异不明显,提示IPTG浓度对PTD-Bcl-xL融合蛋白的表达影响较小,考虑到IPTG对细菌生长的毒害作用,确定IPTG工作浓度为0.1 mmol/L。同时,笔者也分析了IPTG诱导蛋白表达时间与蛋白表达量的关系。SDS-PAGE结果提示,随IPTG诱导时间增长融合蛋白表达量呈上升趋势,6~8 h表达量最高。因此,将6 h作为后续试验的诱导时间。PTD-Bcl-xL融合蛋白主要存在于菌体超声后的沉淀里,以包涵体形式表达,与Ozaki等[13]的研究结果一致。笔者尝试不同温度诱导蛋白表达,由于低温(<20 ℃)融合蛋白仍以包涵体表达为主,因此,选择37 ℃为诱导表达温度。在未诱导的菌体和空载体诱导中,也出现与融合蛋白大小相近的杂蛋白,推测是 BL21(DE3)菌种自身能表达这种大小相适蛋白,在后期纯化过程中能洗脱下去。pET28a-PTD-Bcl-xL重组质粒在大肠杆菌BL21中诱导表达蛋白大小约36 kDa,比预计的PTD-Bcl-xL融合蛋白分子量要大,推测可能是由于Bcl-xL蛋白修饰引起的,后续试验对表达蛋白进行了Western Blot 和质谱鉴定,当证实所诱导表达和纯化的蛋白为PTD-BcL-xL融合蛋白。
包涵体表达与可溶性表达相比,有蛋白不容易降解、纯化方便[14]等自身的优势。为了提高纯化效率,在纯化融合蛋白之前对包涵体进行了洗涤,洗涤液用2 mol/L尿素的0.02 mol/L PBS液(含0.1%Txion-100),低浓度尿素添加0.1%Txion-100洗涤后包涵体纯度有所提高,在后续蛋白纯化洗脱杂蛋白时洗脱液BufferC、BufferD中杂蛋白含量较少。8 mol/L尿素属于中强度蛋白变性剂,对包涵体氢键有较强的可逆变性作用。此外,高浓度的尿素对包涵体的溶解度高达90%,且在变性条件下his标签能够完全暴露在表面,提高与Ni-NTA的结合能力,增加纯化效率,提高纯化产量。Ni-NTA琼脂糖是用于纯化6×his 标签融合蛋白的一种介质,能在变性或非变性条件下纯化各种表达系统表达的his标签蛋白。his标签融合蛋白能与Ni-NTA上的Ni2+螯合,从而使其他非特异性蛋白洗脱出来。
有关PTD-Bcl-xL融合蛋白包涵体表达复性后的活性问题,Chen等[15-16]学者研究发现,复性后的PTD-Bcl-xL及其功能增强型碱基突变体PTD-FNK具备良好的穿膜和抗凋亡特性,能够在30~60 min进入细胞定位于线粒体,对多种类型因素引起的细胞死亡都有保护作用[17-19],且能显著地改善冷冻后猪精液的质量[20]。由于猪精子对低温敏感,猪精液低温保存技术自出现以来虽有进步,但商业化猪冻精没有很大突破[21],对此国内研究者将抗凋亡药物添加到精液低温保存稀释液,许春荣等[22]发现葛根素、酒石酸美托洛尔和二氯乙酸钠能有效地延长低温保存时猪精子的存活时间,杨尚雪[21-24]黄芪多糖、水蛭素添加到精液冷冻保存稀释液中能显著提高冻后精子活力。目前,国内尚未有将抗凋亡蛋白应用于精液冷冻保存的研究及抗凋亡 PTD-Bcl-xL融合蛋白研究报道。
本试验成功地表达了PTD-Bcl-xL蛋白,优化了PTD-Bcl-xL的表达条件,获得了高纯度的PTD-Bcl-xL融合蛋白,为研究Bcl-xL蛋白对动物细胞的保护作用及其在家畜精液低温保存中提供了基础理论依据。
参考文献:
[1]Harb J G,Neviani P,Chyla B J,et al.Bcl-xL anti-apoptotic network is dispensable for development and maintenance of CML but is required for disease progression where it represents a new therapeutic target [J].Leukemia,2013,27(10):1996-2005.
[2]Edlich F,Banerjee S,Suzuki M,et al.Bcl-x(L) retrotranslocates Bax from the mitochondria into the cytosol [J].Cell,2011,145(1):104-116.
[3]Maiuri M C,Le Toumelin G,Criollo A,et al.Functional and physical interaction between Bcl-X(L) and a BH3-like domain in Beclin-1 [J].The EMBO Journal,2007,26(10):2527-2539.
[4]Avery S,Hirst A J,Baker D,et al.BCL-XL mediates the strong selective advantage of a 20q11.21 amplification commonly found in human embryonic stem cell cultures [J].Stem Cell Reports,2013,1(5):379-386.
[5]Jonas E A.Contributions of Bcl-xL to acute and long term changes in bioenergetics during neuronal plasticity [J].Biochimica et Biophysica Acta,2014,1842(8):1168-1178.
[6]Andrade D M,Scherer S W,Minassian B A.Protein therapy for Unverricht-Lundborg disease using cystatin B transduction by TAT-PTD.Is it that simple?[J].Epilepsy Research,2006,72(1):75-79.
[7]Schwarze S R,Ho A,Vocero-Akbani A,et al.Invivoprotein transduction:Delivery of a biologically active protein into the mouse [J].Science,1999,285(5433):1569-1572.
[8]Asoh S,Mori T,Nagai S,et al.Zonal necrosis prevented by transduction of the artificial anti-death FNK protein [J].Cell Death and Differentiation,2005,12(4):384-394.
[9]Hashimoto M,Taniguchi M,Yoshino S,et al.S Phase-preferential Cre-recombination in mammalian cells revealed by HIV-TAT-PTD-mediated protein transduction [J].Journal of Biochemistry,2008,143(1):87-95.
[10]Mie M,Mori K,Funabashi H,et al.Delivery of antibody-captured proteins into living cells using PTD-fused protein A [J].Biotechnology Letters,2006,28(15):1209-1214.
[11]A handbook for high-level expression and pueification of 6xHis-tagged protein[M/OL].http://www.mnstate.edu/provost/QiaExpressionist.pdf.2003(7).
[12]Asoh S,Ohsawa I,Mori T,et al.Protection against ischemic brain injury by protein therapeutics [J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(26):17107-17112.
[13]Ozaki D,Sudo K,Asoh S,et al.Transduction of anti-apoptotic proteins into chondrocytes in cartilage slice culture [J].Biochemical and Biophysical Research Communications,2004,313(3):522-527.
[14]王明蓉,罗李王,王保成,等.包涵体变复性技术研究进展[J].中国医药生物技术,2012,7(4):290-293.
[15]Chen H,Zhang L,Jin Z,et al.Anti-apoptotic PTD-FNK protein suppresses lipopolysaccharide-induced acute lung injury in rats [J].Experimental and Molecular Pathology,2007,83(3):377-384.
[16]Nakachi N,Asoh S,Watanabe N,et al.Transduction of anti-cell death protein FNK suppresses graft degeneration after autologous cylindrical osteochondral transplantation [J].The Journal of Histochemistry and Cytochemistry:Official Journal of the Histochemistry Society,2009,57(3):197-206.
[17]Sakurazawa M,Katsura K,Saito M,et al.Mild hypothermia enhanced the protective effect of protein therapy with transductive anti-death FNK protein using a rat focal transient cerebral ischemia model [J].Brain Research,2012,1430:86-92.
[18]Sudo K,Asoh S,Ohsawa I,et al.The anti-cell death FNK protein protects cells from death induced by freezing and thawing [J].Biochemical and Biophysical Research Communications,2005,330(3):850-856.
[19]Arakawa M,Yasutake M,Miyamoto M,et al.Transduction of anti-cell death protein FNK protects isolated rat hearts from myocardial infarction induced by ischemia/reperfusion [J].Life Sciences,2007,80(22):2076-2084.
[20]Shimokawa K,Oshiro R,Yamanaka K,et al.Improvement of the post-thaw qualities of Okinawan native Agu pig sperm frozen in an extender supplemented with antiapoptotic PTD-FNK protein [J].Theriogenology,2012,78(7):1446-1455.
[21]李珣,杨尚雪,王晓晔,等.黄芪多糖对冷冻前后猪精液中过氧化氢酶活性及其mRNA表达的影响[J].中国兽医科学,2015,45(4):435-440.
[22]许春荣,陆媚,刘德玉,等.3种抗凋亡试剂在猪精液低温保存中的应用[J].中国畜牧兽医,2014,41(2):170-173.
[23]杨尚雪,潘天彪,黄明光,等.黄芪多糖对猪精液冷冻保存效果的影响[J].中国畜牧兽医,2014,41(9):179-183.
[24]杨尚雪,汪彦玲,黄明光,等.水蛭素对猪精液冻后质量的影响[J].中国兽医学报,2015,35(3):489-492.
Prokaryotic Expression Plasmid Construction and Expression/Purification of Anti-apoptotic Fusion Protein PTD-Bcl-xL
WANG Xiaoye1,SHI Bomei1,WANG Yingqun2,LI Xun1,LIU Deyu2,LI Ming2,LI Fangfang2,HU Chuanhuo1
(1.College of Animal Science and Technology,Guangxi University,Nanning530005,China;2.Guangxi Work Station of Livestock & Poultry Breed Improvement,Nanning530001,China)
Abstract:Artificial anti-apoptotic protein PTD-Bcl-xL can control abnormal apoptosis induced by a variety of factors.The present study was to obtain a high-purity Bcl-xL and PTD (Protein transduction domains) fusion protein.SD rat liver total RNA was extracted by TRIzol and transcribed into cDNA.Bcl-xL gene was amplified by PCR with cDNA as a template and was cloned into pUM19-T vector to construct pUM19-T-Bcl-xL plasmid,which was Identified by restriction enzyme digestion and sequencing and the pUM19-T-Bcl-xL plasmid was used as a template to amplify PTD-Bcl-xL fragment which was cloned into vector pET28a to construct recombinant plasmid pET28a-PTD-Bcl-xL and PTD sequence were designed to be placed before the Bcl-xL by designing primers.Then the recombinant plasmid was identified by restriction enzyme and was transformed into E.coli BL21(DE3),PTD-Bcl-xL fusion protein was induced to express with different IPTG concentration and induction time.Then the expression culture was analyzed for it′s solubility and was prepared to purify PTD-Bcl-xL fusion protein with Ni-NTA agarose under denaturing condition.Finally,the expressing culture and purified protein was identified with SDS-PAGE analysis,Western Blot and MS.The results showed that detected by sequencing and enzyme digestion plasmid pUM19-T-Bcl-xL was constructed;prokaryotic expression vector pET28a-PTD-Bcl-xL was constructed with confirmed by sequencing and enzyme digestion;The fused protein PTD-Bcl-xL could be expressed by IPTG induction with 0.1 mmol/L IPTG induction 6 hours for well expression;The fusion protein expressed in an insoluble form of inclusion bodies and a high-purity fused protein was obtained with Ni-NTA agarose purification;the expressing culture and purified protein were proved to be the PTD-Bcl-xL fusion protein with SDS-PAGE,Western Blot and MS analysis.This study obtains purified PTD-BcL-xL fusion protein and promotes the application process PTD-Bcl-xL protein in pork,beef and other livestock semen cryopreservation.
Key words:Bcl-xL protein;PTD;Prokaryotic expression;Protein purification
doi:10.7668/hbnxb.2016.01.001
中图分类号:Q78
文献标识码:A
文章编号:1000-7091(2016)01-0001-07
作者简介:王晓晔(1987-),男,山东潍坊人,讲师,博士,主要从事兽医外科学及产科学研究。王晓晔、石博妹、王英群、李珣为同等贡献作者。通讯作者:胡传活(1964-),男,广西平南人,教授,博士,主要从事动物解剖学及组织胚胎学研究。
基金项目:广西科学研究与技术开发计划项目(桂科能1598022-2);广西畜禽品种改良站横向科技项目(20140220)
收稿日期:2015-09-24

