纹缟虾虎鱼对Cu2+、Cd2+和氨氮的毒性响应和敏感性分析
郝雅,朱丽岩,巩文静,韩萃,江田田
中国海洋大学海洋生命学院,青岛 266003
纹缟虾虎鱼对Cu2+、Cd2+和氨氮的毒性响应和敏感性分析
郝雅,朱丽岩*,巩文静,韩萃,江田田
中国海洋大学海洋生命学院,青岛 266003
以纹缟虾虎鱼为受试生物,分别进行了Cu2+、Cd2+和氨氮为环境因子的急性毒性实验和氨氮慢性暴露实验,结合文献数据分析纹缟虾虎鱼对3种污染物的敏感性。结果表明,Cu2+、Cd2+和氨氮对纹缟虾虎鱼的EC50分别为4.527、40.408和63.182 mg·L-1。组织切片结果显示,氨氮暴露能够引起纹缟虾虎鱼肝组织结构退化,组织细胞畸变,其损伤程度随着氨氮浓度的升高而加剧。氨氮暴露对肠管未见明显影响。敏感性分析结果表明,纹缟虾虎鱼对Cu2+、Cd2+和氨氮的累积概率分别为83.33%、96.27%和90.48%,均表现为不敏感。在Cu2+、Cd2+和氨氮对海洋生物的敏感性排名中,纹缟虾虎鱼分别在第31/35、32/32和19/20位。在8~12种海洋鱼类中,纹缟虾虎鱼对上述3种污染物的敏感性都处在较低水平。
重金属;氨氮;纹缟虾虎鱼;慢性暴露;急性毒性;组织切片;敏感性;河口生态
河口是陆地河流的入海口,具有复杂的水体混合机制和相对脆弱的生态环境[1],河口受到淡水输入、地表径流、潮汐等因素[2]的综合影响,盐度等环境物化因子在不同时间尺度上变化剧烈。作为部分海洋生物的产卵场、育幼场和索饵场[2],河口对渔业资源发展具有重要意义。从世界范围来看,河口流域通常是人口稠密的地区,大量未经处理的生活和工业污水的输入导致河口水质富营养化和重金属污染严重[3]。
氨氮在我国地表水中广泛存在[4],是我国水环境的主要污染物之一。除了工农业和生活废水排放,水产养殖中饲料的投喂和水产生物的排泄[5]也是氨氮的来源。氨氮对水生生物的毒性主要来自于非离子氨,非离子氨能够影响水生生物的酶水解反应和膜稳定性[5]。Reddy-Lopata和Auerswald[6]进行了氨氮对南非鲍(Haliotis midae)的急性毒性实验,结果发现长期暴露于亚致死浓度的氨氮下鲍鱼幼苗的生长率比对照组降低了约58.7%。Miron等[7]研究了不同pH下氨氮暴露对蓝棣鲇的急性毒性,结果显示氨氮的毒性随着pH的降低而升高,这与低pH下毒性强的非离子氨的比例增加有关。
重金属是河口和近海水环境中含量较高的污染物,能够通过食物链迁移积累[8],对高营养级的生物能够产生严重危害[9]。砷、镉、铜、汞、锌是5种在农业生产和水产养殖过程中排放的对水体环境质量最有潜在影响的重金属[10]。其中,铜常用作水产养殖业的除藻剂。镉则是农药的主要组成元素[11]。重金属对海洋生物的污染不易被发现并难以恢复,威胁野外生物群落结构的稳定,造成水产养殖业的大量损失。
纹缟虾虎鱼(Tridentiger trigonocephalus)属鲈形目(Perciformes),虾虎鱼科(Gobiidae),缟虾虎鱼属(Tridentiger),为广盐性近岸底层小型鱼类[12],栖息于河口咸淡水水域及近岸浅水处[13],是国家一级重点野生保护动物中华鲟幼鱼的主要食物之一[12],在潮间带和河口生态系统食物链中占有关键地位。
目前国内外对虾虎鱼科的研究仍然很少,Saaristo等[14]研究了17α-雌二醇对沙虾虎鱼(Pomatoschistus minutus)性别选择的破坏效应。冯广朋等[12]系统地研究了纹缟虾虎鱼的繁殖生物学特征和早期生活史。庄平等[13]研究了Cu2+、Zn2+、Pb2+对纹缟虾虎鱼耗氧率的影响。本文以纹缟虾虎鱼为受试生物,进行了河口重点污染物Cu2+、Cd2+和氨氮对纹缟虾虎鱼的急性毒性实验,并通过组织切片技术研究了氨氮慢性暴露对纹缟虾虎鱼消化器官的影响。结合文献数据分析纹缟虾虎鱼对3种污染物的敏感性。研究旨在丰富纹缟虾虎鱼的毒理学资料,对其在污染水体生物修复过程中的应用前景进行展望。
1 材料与方法(Materials and methods)
1.1 纹缟虾虎鱼
实验用纹缟虾虎鱼于2014年4月—11月在青岛鲁迅公园潮间带采集,采集时使用手持塑料捞网。驯养容器为玻璃鱼缸,在鱼缸内用潮间带砾石搭建人工巢穴,培养海水经0.45 μm滤膜过滤,24 h不间断充氧。日换水量70%~90%。投饵量2次/天,投喂饵料为冷冻卤虫(咸水丰年虾),高温灭菌后投喂,具体投喂量根据水温、鱼的数量和鱼的摄食情况灵活掌握。
1.2 实验试剂
实验使用的化学试剂(CuCl2,CdCl2,NH4Cl等)购自上海振兴试剂厂,均为分析纯。实验前使用去离子水将各实验药物配成一定离子质量浓度母液备用。
1.3 急性毒性实验
实验周期96 h,设置一个对照组和若干浓度组,每组设3个平行,每个平行投入10尾成年纹缟虾虎鱼。实验期间日投饵1次。
污染物浓度设置如下:氨氮为5、10、20、40、80、160、320 mg·L-1。Cu2+为0.3、0.6、1.2、2.4、4.8、9.6、19.2、38.4 mg·L-1。Cd2+为3、6、12、24、48、96、192 mg·L-1。
1.4 氨氮慢性暴露实验
1.4.1 氨氮对纹缟虾虎鱼21 d慢性暴露实验
根据纹缟虾虎鱼对氨氮急性毒性实验结果,进行了氨氮慢性暴露下纹缟虾虎鱼消化器官病理切片观察。实验设置了包括对照组在内的3个实验组(空白对照组0 mg·L-1,低浓度组5 mg·L-1,高浓度组50 mg·L-1)。实验培养容器为36 cm×36 cm×36 cm的正方形玻璃鱼缸,每个浓度设3个平行,每个平行投入10尾成年虾虎鱼,暴露时间21 d。
1.4.2 生理组织切片制作
慢性暴露实验结束后,通过断尾法处理受试纹缟虾虎鱼。解剖出肠管和肝脏并立即置于Bouin’s液固定12 h。对固定样品进行洗涤、脱水、透明及石蜡包埋等一系列流程。用爱华QPJ-1转轮切片机切片,厚度为5 μm。H.E染色后用OlympusBX53荧光显微镜观察。
1.5 数据收集和敏感性分析
搜索并筛选Cu2+、Cd2+和氨氮对海洋生物毒性数据,将不同物种的毒性数据排序,计算累积概率。累积概率小于30%为较为敏感。文献毒性数据来源于ECOTOX数据库和公开发表的文献。毒性实验数据的筛选原则:溞类、枝角类和摇蚊幼虫的急性毒性实验终点选择48 h-LC50或EC50,鱼类的急性毒性实验终点选择96 h-LC50或EC50[15]。未设立对照组的、对照死亡超过10%的、实验设计不科学的、实验生物曾经暴露于污染物中的等毒性数据均不能采用[16],其中,3种污染物对指状伪镖水蚤(Pseudodiaptomus inopinus)和褶皱臂尾轮虫(Brachionus plicatilis)的部分急性毒性实验结果通过室内实验得出。
对所得毒性数据进行整理和排序:首先求得各个物种的种平均急性值(species mean acute value, SMAV),SMAV等于同一物种的急性毒性值的几何平均值,即对同一物种的所有LC50或EC50求几何平均值,然后根据污染物对全部物种的SMAV从小到大进行排序。
1.6 数据处理
采用直线回归法分别求得各污染物的96 h-EC50及其95%置信区间,数据分析采用软件SPSS 20.0。污染物对全部物种的SMAV数据使用Excel软件排序。
2 结果(Results)
2.1 急性毒性实验
对照组无死亡个体。3种污染物对受试生物EC50值见表1。从中可知:Cu2+对纹缟虾虎鱼的毒性高于Cd2+,氨氮对纹缟虾虎鱼的毒性显著低于Cu2+,稍低于Cd2+。纹缟虾虎鱼对3种污染物的敏感性大小为:Cu2+>Cd2+>氨氮。
2.2 病理切片
对肝脏的病理切片结果显示,随着氨氮浓度的升高,纹缟虾虎鱼的肝脏组织细胞畸变和肝小管结构退化程度均显著增高。在空白对照组中,肝脏组织细胞均匀完整,细胞间排列紧密(图1A),肝小管结构完整,管壁细胞形态完好,细胞核与细胞质HE染色清晰,与周围肝脏组织细胞连接紧密(图2A黑色空心箭头)。在低浓度组(5 mg·L-1)中,肝脏组织细胞发生一定程度的畸变,组织细胞大小较不均匀,部分细胞失去完整细胞形态,部分组织区域病变严重,细胞间排列松散(图1B黑色空心箭头),肝小管发生结构变化,管壁破裂,管壁细胞失去完整形态,细胞核溶解(图2B黑色空心箭头)。肝小管与周围肝脏组织细胞分离,肝小管周围区域出现蛋白质积液,这些积液中由于血细胞的存在而呈现嗜酸性,使该组织区域伊红着色加深(图2B黑色实心箭头)。在高浓度组(50 mg·L-1)中,肝脏组织细胞发生大面积畸变,细胞出现不同程度的增生(图1C黑色实心箭头),融合(图1C黑色空心箭头),破裂,细胞大小极不均匀,细胞间排列无序。肝小管病变坏死,与周围肝脏细胞分离脱落,导致肝脏组织中出现大量管状空隙(图2C黑色空心箭头),空隙中由于肝小管破裂而出现大量血液和蛋白质积液,形成局部伊红着色斑块(图2C黑色实心箭头)。

表1 污染物对纹缟虾虎鱼的急性毒性试验结果Table 1 The results of acute toxicity test of various types of pollutants to T. trigonocephalus

图1 氨氮慢性暴露后纹缟虾虎鱼肝脏生理组织切片照片(×100)注:A为空白对照组;B为低浓度组(5 mg·L-1),黑色空心箭头指示肝细胞发生一定程度的增生和破裂;C为高浓度组(50 mg·L-1),黑色空心箭头指示肝细胞出现融合现象,黑色实心箭头指示肝细胞明显增生。Fig. 1 The histological change in the liver of T. trigonocephalus after chronic exposure to ammonia nitrogen (×100)Note: A was control group; B was low concentration group (5 mg·L-1), and the hollow black arrow showed that hyperplasia and rupture occurred in liver cells; C was high concentration group (50 mg·L-1),and the hollow black arrow showed convergence occurred in liver cells, while the solid black arrow showed hyperplasia occurred in liver cells.

图2 氨氮慢性暴露后纹缟虾虎鱼肝小管生理组织切片照片(×200)注:A为空白对照组,黑色空心箭头指示肝小管结构完整,细胞排列紧密有序,核质染色清晰;B为低浓度组(5 mg·L-1),黑色空心箭头指示肝小管与周围组织分离,肝小管管壁破损,核质染色模糊,黑色实心箭头指示肝小管周围出现嗜伊红性积液;C为高浓度组(50 mg·L-1),黑色空心箭头指示肝小管消失形成腔隙,黑色实心箭头指示局部出现嗜伊红斑块。Fig. 2 The histological change in the hepatic tubules of T. trigonocephalus after chronic exposure to ammonia nitrogen (×200)Note: A was control group, and the hollow black arrow showed that liver tubular structure was complete, cells arranged closely and orderly,and nuclear staining was clearly; B was low concentration group (5 mg·L-1), and the hollow black arrow showed that hepatic tubules separated from the surrounding tissue, liver tubular wall was damaged, and karyoplasm dyeing was fuzzy, while the solid black arrow showed eosinophilic effusion appeared around the liver tubules; C was concentration group (50 mg·L-1), and the hollow black arrow showed that liver tubules disappeared, while the solid black arrow showed eosinophilic erythema block.
肠管的病理切片结果显示,氨氮暴露浓度的变化对肠管的组织结构影响不明显。各个浓度组肠绒毛细胞核完整,染色清晰,细胞未发生明显的形态学畸变。空白对照组和低浓度组(5 mg·L-1)肠道内有较多食糜颗粒(图3A, B黑色空心箭头),高浓度组(50 mg·L-1)肠道内未见明显食糜颗粒(图3C)。根据慢性暴露实验观察,高浓度氨氮暴露对纹缟虾虎鱼的摄食行为具有一定程度的抑制。
2.3 敏感性分布
分析结果显示,在全部物种的敏感性排序当中,海洋鱼类的敏感性一般排在较不敏感的位置,对3种河口污染物Cu2+、Cd2+和氨氮的敏感性普遍低于浮游甲壳类。3种污染物对海洋生物的累积概率分布图显示,纹缟虾虎鱼对3种污染物的累积概率都超过了80%(图4)。其中,纹缟虾虎鱼对Cu2+的累积概率为83.33%,在35种海洋生物中排名第31(见表2)。纹缟虾虎鱼对Cd2+的累积概率为96.27%,在32种海洋生物中排名第32(见表2)。纹缟虾虎鱼对氨氮的累积概率为90.48%。在20种海洋生物中排名第19(见表2)。纹缟虾虎鱼对3种污染物的敏感性普遍低于其他海洋生物。
3 讨论(Discussion)
本文的主要研究目的是探究纹缟虾虎鱼对重金属Cu2+、Cd2+和氨氮的毒性响应,并进一步研究纹缟虾虎鱼在器官水平上对氨氮持续暴露的响应,以及对3种污染物的敏感性分析。研究旨在丰富纹缟虾虎鱼的毒理学数据,为河口水环境治理提供一定的生物学资料。
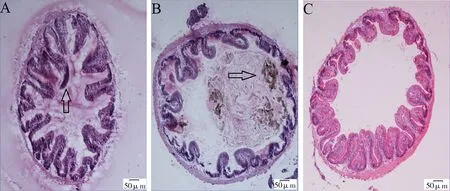
图3 氨氮慢性暴露后纹缟虾虎鱼肠管生理组织切片照片(×100)注:A为空白对照组,黑色空心箭头指示肠管中的食糜颗粒;B为低浓度组(5 mg·L-1),黑色空心箭头指示肠管中的食糜颗粒;C为高浓度组(50 mg·L-1),组织表现出明显的嗜伊红性。Fig. 3 The histological change in the intestine of T. trigonocephalus after chronic exposure to ammonia nitrogen (×100)Note: A was control group, and the hollow black arrow showed chyme in the intestine; B was low concentration group (5 mg·L-1), and the hollow black arrow showed chyme in the intestine; C was high concentration group (50 mg·L-1), and the whole tissue structure was eosinophilic.

图4 海洋生物对Cu2+、Cd2+和氨氮的物种敏感度(SSD)分布图注:红色点为纹缟虾虎鱼的位置。Fig. 4 The species sensitivity distribution (SSD) of marine organisms to Cu2+, Cd2+ and ammonia nitrogenNote: Red scatter shows T. trigonocephalus location.

表2 纹缟虾虎鱼对3种污染物的敏感性Table 2 The sensitive of T. trigonocephalus to three pollutions
急性毒性实验结果显示,Cu2+对纹缟虾虎鱼具有较强的毒性,Cd2+对纹缟虾虎鱼的96 h-EC50比Cu2+高一个数量级,这与重金属Cu2+、Cd2+对诸氏鲻虾虎鱼[17]、斑马鱼[18]、海陆蛙蝌蚪[19]的急性毒性实验结果一致。曾艳芝等[20]测定了Cu2+和Cd2+对几种珠江口天然幼鱼和仔鱼的安全浓度,Cu2+的安全浓度比镉低一个数量级,与本实验结果相符。氨氮对纹缟虾虎鱼的96 h-EC50低于2种重金属污染物。根据国家环保总局《水和废水监测分析方法(第四版)》[21]中鱼类急性毒性分级标准:EC50<1 mg·L-1为极毒;1~10 mg·L-1为高毒;10~100 mg·L-1为中毒;>100 mg·L-1为低毒。氨氮和Cd2+对纹缟虾虎鱼为中毒,Cu2+对纹缟虾虎鱼为高毒。氨氮对纹缟虾虎鱼的96 h-EC50低于2种重金属污染物,推测是因为氨氮作为水溶性无机污染物,更容易通过代谢排出。而重金属作为典型的工业废水污染物,具有较强的生物富集性和持久性,难以通过代谢排出体外,因此对纹缟虾虎鱼的毒性高于氨氮。
氨氮慢性暴露后的生理组织切片结果显示,一定浓度的氨氮暴露可以诱导纹缟虾虎鱼的肝脏组织细胞畸变和肝小管结构退化,氨氮暴露浓度越高,肝脏组织细胞畸变损伤程度越严重,肝小管退化现象越明显。蒋玫等[22]研究表明,氨氮暴露能够降低鲻鱼肝组织中Na+-K+-ATP酶的活性,损害肝脏内的抗氧化酶系统。氨氮对纹缟虾虎鱼肝脏的毒性影响主要表现在肝小管结构的改变,细胞形态大小的改变,细胞间排列连接的改变,细胞核完整性丧失及组织畸形增生。慢性氨氮暴露对肠管形态结构的影响不明显,在低浓度组和高浓度组的病理切片未见明显异常。推测肝脏是纹缟虾虎鱼主要的解毒器官,在氨氮的水体暴露下,氨氮通过纹缟虾虎鱼皮肤、鳃及消化道进入纹缟虾虎鱼血液,肝脏在第一时间作为解毒器官发挥解毒作用,氨氮在肝脏内积累并最终对肝脏组织细胞结构产生破坏作用。而肠道是纹缟虾虎鱼主要消化器官,由于实验期间投喂的饵料并未经过同等浓度的氨氮暴露,所以氨氮水体暴露对纹缟虾虎鱼的肠管的形态结构没有产生明显影响,但是水体氨氮的浓度过高会显著影响纹缟虾虎鱼的摄食行为,导致高浓度组肠管内消化中的食糜团数量减少。黄厚见等[23]的研究证实了高浓度氨氮能够严重干扰梭鱼的摄食行为并降低摄食率,这与本研究实验观察结果一致。
纹缟虾虎鱼对3种污染物的累积概率高于大部分海洋生物,特别是在已收集到毒性数据背景的8~12种海洋鱼类中,纹缟虾虎鱼对3种污染物的耐受性均较高。在外源性污染物富集程度较高的河口和潮间带生态系统中,纹缟虾虎鱼能够较好地适应环境刺激来保证自身的种群数量,这也是纹缟虾虎鱼在生物圈广泛分布的重要原因之一。钟俊生等[24]研究了长江口沿岸碎波带的仔稚鱼种类组成,其中纹缟虾虎鱼是除个别洄游鱼类外最主要的优势种。本文中组织切片结果说明,氨氮长期暴露也会影响纹缟虾虎鱼组织结构和生理寿命。因此,当自然条件稳定,但环境中纹缟虾虎鱼种群数量发生巨大波动时,说明环境中外源污染物的输入量较多,所以纹缟虾虎鱼的种群数量对河口环境监测具有一定的参考价值。对比先前其他河口生物研究,以日本虎斑猛水蚤(Tigriopus japonicus)为例,其作为全球范围内环境研究的模式生物[25],是一种分布广泛并对环境温度、盐度具有较强适应性的河口桡足类。Raisuddin等[26]对其研究表明,日本虎斑猛水蚤对多种化合污染的急性毒性均不敏感,但是也会对污染物暴露表现出应激性,能够为河口污染物排放阈值提供一个良好的生态毒理学模型。纹缟虾虎鱼在分布范围和对污染物的敏感性方面,与日本虎斑猛水蚤具有相同的生态学意义,因此可为河口生态系统的毒理学研究提供高营养级的水生生物模型。
综上,研究证明了3种污染物对纹缟虾虎鱼的毒性由低到高为:氨氮 致谢:感谢中国海洋大学陈学超同学在文章修改过程中提供的大量帮助,感谢审稿专家提供的宝贵意见。 [1] 陈静. 河口区水生态健康评价技术方法及其应用[D]. 青岛: 中国海洋大学, 2014: 1-2 Chen J. Estuarine water eco-health assessment technical method and application [D]. Qingdao: Ocean University of China, 2014: 1-2 (in Chinese) [2] 王丽平, 刘录三, 郑丙辉, 等. 我国入海河口区水质标准制定初探[C]//中国环境科学学会环境标准与基准专业委员会(Committee of Environmental Standards & Criteria, Chinese Society for Environmental Sciences). 中国毒理学会环境与生态毒理学专业委员会第三届学术研讨会会议论文集(二). 北京: 北京师范大学出版社, 2013: 32-40 [3] 崔燕. 小清河口水质污染现状与亚硝酸盐分布趋势及其来源[D]. 青岛: 中国海洋大学, 2012: 1-2 Cui Y. Study on the water pollution situation and nitrite distribution and its origin in the Xiaoqing River Estuary [D]. Qingdao: Ocean University of China, 2012: 1-2 (in Chinese) [4] 张学青, 夏星辉, 杨志峰. 黄河水体氨氮超标原因探讨[J]. 环境科学, 2007, 28(7): 1435-1441 Zhang X Q, Xia X H, Yang Z F. Reasons of high concentration ammonium in Yellow River, China [J]. Environmental Sciences, 2007, 28(7): 1435-1441 (in Chinese) [5] 蔡继晗, 沈奇宇, 郑向勇, 等. 氨氮污染对水产养殖的危害及处理技术研究进展[J]. 浙江海洋学院学报: 自然科学版, 2010, 29(2): 167-172, 195 Cai J H, Shen Q Y, Zheng X Y, et al. Advancement in researches of ammonia pollution hazards on aquaculture and its treatment technology [J]. Journal of Zhejiang Ocean University: Natural Science, 2010, 29(2): 167-172, 195 (in Chinese) [6] Reddy-Lopata K, Auerswald L. Ammonia toxicity and its effect on the growth of the South African abalone Haliotis midae Linnaeus [J]. Aquaculture, 2006, 261(2): 678-687 [7] Miron D S, Moraes B S, Becker A J, et al. Ammonia and pH effects on some metabolic parameters and gill histology of silver catfish, Rhamdia quelen (Heptapteridae) [J]. Aquaculture, 2008, 277(3-4): 192-196 [8] 赵顺顺. 海水重金属单一及复合污染对双壳类金属硫蛋白的影响和非生物因子的干扰[D]. 青岛: 中国海洋大学, 2013: 1-5 Zhao S S. Effects of single and combined pollution of heavy metals in seawater and abiotic factors on metallothionein of Ruditapes philippinarum [D]. Qingdao: Ocean University of China, 2013: 1-5 (in Chinese) [9] 穆景利, 王莹, 王新红, 等. Cd2+, Hg2+, Cr6+和Pb2+对黑点青鳉(Oryzias melastigma)早期生活阶段的毒性效应研究[J]. 生态毒理学报, 2011, 6(4): 352-360 Mu J L, Wang Y, Wang X H, et al. Toxic effects of cadmium, mercury, chromium and lead on the early life stage of marine medaka (Oryzias melastigma) [J]. Asian Journal of Ecotoxicology, 2011, 6(4): 352-360 (in Chinese) [10] 孟晓林. 镉, 铜分别胁迫虾夷扇贝的毒性作用机制研究[D]. 北京: 中国科学院研究生院, 2013: 1-2 Meng X L. Studies on the toxicology mechanism of Japanese scallop (Mizuhopecten yessoensis) respond to cadmium or copper exposure [D]. Beijing: The University of Chinese Academy of Sciences, 2013: 1-2 (in Chinese) [11] Wang C, Zheng S S, Wang P F, et al. Effects of vegetations on the removal of contaminants in aquatic environments: A review [J]. Journal of Hydrodynamics, 2014, 26(4): 497-511 [12] 冯广朋, 庄平, 章龙珍, 等. 长江口纹缟虾虎鱼的繁殖生物学特征[J]. 长江流域资源与环境, 2009, 18(8): 711-718 Feng G P, Zhuang P, Zhang L Z, et al. Characteristics of reproductive biology of Tridentiger trigonocephalus at the Yangtze River Estuary [J]. Resources and Environment in the Yangtze Basin, 2009, 18(8): 711-718 (in Chinese) [13] 庄平, 赵优, 章龙珍, 等. 纹缟虾虎鱼胚胎耗氧率及Cu2+, Pb2+, Zn2+对其影响的研究[J]. 海洋渔业, 2008, 30(1): 43-48 Zhuang P, Zhao Y, Zhang L Z, et al. Studies on the oxygen consumption rate of embryo of trident goby (Tridentiger trigonocephalus) and its influences caused by heavy metals Cu2+, Pb2+and Zn2+[J]. Marine Fisheries, 2008, 30(1): 43-48 (in Chinese) [14] Saaristo M, Craft J A, Lehtonen K K, et al. Disruption of sexual selection in sand gobies (Pomatoschistus minutus) by 17α-ethinyl estradiol, an endocrine disruptor [J]. Hormones and Behavior, 2009, 55: 530-537 [15] US EPA. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses (PB85-227049) [R]. Washington D C: US EPA, 1985 [16] 王晓南, 刘征涛, 闫振广, 等. 麦穗鱼物种敏感性评价[J]. 环境科学, 2013, 34(6): 2329-2334 Wang X N, Liu Z T, Yan Z G, et al. Species sensitivity evaluation of Pseudorasbora parva [J]. Environmental Science, 2013, 34(6): 2329-2334 (in Chinese) [17] 李建军, 林忠婷, 陈小曲, 等. 四种重金属离子对诸氏鲻虾虎鱼的单一和联合毒性[J]. 海洋环境科学, 2014(2): 236-241 Li J J, Lin Z T, Chen X Q, et al. Single and joint toxicity of four heavy metal ions on Mugilogobius chulae [J]. Marine Environmental Science, 2014(2): 236-241 (in Chinese) [18] 王庆伟. 重金属, TPT和PCP对斑马鱼单一和联合毒性作用[D]. 青岛: 青岛科技大学, 2011: 38-45 Wang Q W. Single and joint toxicity effects of heavy metals, TPT and PCP on Brachydanio rerio (zebrafish) [D]. Qingtao: Qingdao University of Science and Technology, 2011: 38-45 (in Chinese) [19] 李春瑜. 重金属铜, 镉对海陆蛙蝌蚪毒性作用的初步研究[D]. 海口: 海南师范大学, 2013: 9-42 Li C Y. Preliminary study on toxicity of copper and cadmium on Fejervaya cancrivora tadpoles [D]. Haikou: Haikou Normal University, 2013: 9-42 (in Chinese) [20] 曾艳艺, 赖子尼, 杨婉玲, 等. 铜和镉对珠江天然仔鱼和幼鱼的毒性效应及其潜在生态风险[J]. 生态毒理学报, 2014, 9(1): 49-55 Zeng Y Y, Lai Z N, Yang W L, et al.The toxicities and potential ecological effects of copper and cadmium to natural fish larvae and juveniles from the Pearl River [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 49-55 (in Chinese) [21] 国家环境保护总局. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 2002: 728 [22] 蒋玫, 李磊, 沈新强, 等. 慢性氨氮胁迫对鲻鱼(Mugil cephalus)幼鱼组织细胞免疫指标的影响研究[J]. 海洋与湖沼, 2014, 45(3): 529-535 Jiang M, Li L, Shen X Q, et al. Effect of ammonia stress on immunity indicators of juvenile Mugil cephalus [J]. Oceanologia et Limnologia Sinica, 2014, 45(3): 529-535 (in Chinese) [23] 黄厚见. 摄食水平, 氨氮胁迫对梭鱼幼鱼生长的影响及其毒理效应研究[D]. 上海: 上海海洋大学, 2012: 15-32 Huang H J. The effects of ammonia and ration size on growth and toxicological response of mullet, Liza haematocheila [D]. Shanghai: Shanghai Ocean University, 2012: 15-32 (in Chinese) [24] 钟俊生, 郁蔚文, 刘必林, 等. 长江口沿岸碎波带仔稚鱼种类组成和季节性变化[J]. 上海水产大学学报, 2005, 14(4): 375-382 Zhong J S, Yu W W, Liu B L, et al. Seasonal occurrences of fish larvae and juveniles in the surf zone of the Yangtze River Estuary [J]. Journal of Shanghai Fisheries University, 2005, 14(4): 375-382 (in Chinese) [25] Han J, Won E J, Lee M C, et al. Developmental retardation, reduced fecundity, and modulated expression of the defensome in the intertidal copepod Tigriopus japonicus exposed to BDE-47 and PFOS [J]. Aquatic Toxicology, 2015, 165: 136-143 [26] Raisuddin S, Kwok K W H, Leung K M Y, et al. The copepod Tigriopus: A promising marine model organism for ecotoxicology and environmental genomics [J]. Aquatic Toxicology (Amsterdam, Netherlands), 2007, 83(3): 161-173 ◆ Toxic Response and Sensitivity ofTridentigertrigonocephalusto Cu2+, Cd2+and Ammonia Nitrogen Hao Ya, Zhu Liyan*, Gong Wenjing, Han Cui, Jiang Tiantian College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China Received 13 April 2016 accepted 9 May 2016 The toxic response and sensitivity of Tridentiger trigonocephalus to Cu2+, Cd2+and ammonia nitrogen were evaluated by 96 h acute and 24 d chronic toxicity test. Results showed that the 96 h-EC50of Cu2+, Cd2+and ammonia nitrogen was 4.527, 40.408 and 63.182 mg·L-1respectively. Histological observation showed ammonia nitrogen could lead to degradation of liver structure, and the distortion and damage in liver cells was aggravated with the increase in the concentration of ammonia nitrogen. The ammonia nitrogen had no significant effect on intestinal canal. The sensitivity analysis revealed that the cumulative probability of T. trigonocephalus to Cu2+, Cd2+and ammonia nitrogen was 83.33%, 96.27% and 90.48% respectively. All of these were presented as insensitivity. In the ranking of the marine organism sensitivity to Cu2+, Cd2+and ammonia nitrogen, T. trigonocephalus was ranked in 31/35, 32/32 and 19/20 respectively. Among 8-12 marine fish species whose data were available, T. trigonocephalus has the strongest tolerance to the three kinds of pollutants. heavy metal; ammonia nitrogen; Tridentiger trigonocephalus; chronic exposure; acute toxicity; histology; species sensitivity; estuarine ecosystems 国家水体污染控制与治理科技重大专项(2012ZX07501-003-06);国家自然科学基金(31172412);国家自然科学基金(31572621) 郝雅(1990-),男,硕士研究生,研究方向为生态毒理学,E-mail: situqiong@163.com *通讯作者(Corresponding author), E-mail: smfysw@ouc.edu.cn 10.7524/AJE.1673-5897.20160413002 2016-04-13 录用日期:2016-05-09 1673-5897(2016)6-163-08 X171.5 A 朱丽岩(1965—),女,海洋生物学博士,教授,硕士研究生导师,主要研究方向为海洋浮游动物生物学、海洋无脊椎动物生态毒理学,发表学术论文40余篇。 郝雅, 朱丽岩, 巩文静, 等. 纹缟虾虎鱼对Cu2+、Cd2+和氨氮的毒性响应和敏感性分析[J]. 生态毒理学报,2016, 11(6): 163-170 Hao Y, Zhu L Y, Gong W J, et al. Toxic response and sensitivity of Tridentiger trigonocephalus to Cu2+, Cd2+and ammonia nitrogen [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 163-170 (in Chinese)

