活性氧和钙信号参与铅对酵母细胞的毒性作用
张瑞刚,仪慧兰
山西大学生命科学学院,太原030006
活性氧和钙信号参与铅对酵母细胞的毒性作用
张瑞刚,仪慧兰*
山西大学生命科学学院,太原030006
以模式生物酵母菌为材料,研究铅对细胞的毒性效应,探讨胞内活性氧(ROS)和Ca2+在铅诱导细胞死亡中的作用。结果显示,浓度为5 ~ 100 mg·L-1的硝酸铅可降低酵母细胞活性,诱导酵母细胞死亡,随着铅浓度的提高和作用时间的延长,细胞死亡率增高。在铅处理组酵母细胞中,ROS和Ca2+水平显著升高,线粒体膜电位明显下降;用1 mmol·L-1的外源抗坏血酸(AsA)能降低铅引发的酵母细胞死亡,0.5 mmol·L-1的钙离子螯合剂乙二醇双四乙酸(EGTA)或0.1 mmol·L-1的质膜Ca2+通道特异性抑制剂氯化镧(LaCl3)亦可明显抑制铅引起的酵母细胞死亡。研究结果表明,铅诱发的酵母细胞死亡与处理组胞内ROS和Ca2+升高有关,高浓度的Ca2+可能通过诱导线粒体膜通透性转变孔道开放,或者高水平ROS可能损伤线粒体膜,致线粒体膜电位下降,继而激活相关下游信号导致细胞死亡。
铅;酵母;细胞毒性;ROS;Ca2+
随着工业和交通业的发展,含铅废气、废水和废渣的排放量逐年增多,导致大气、水体和土壤中的铅含量不同程度超标。环境中高浓度的铅对人类、动物和植物均具有毒性作用。长期的铅暴露可引发人体神经系统、造血系统、消化系统以及生殖系统等的损伤,且铅蓄积还可致癌[1]。研究发现,铅可以与人体内蛋白分子的羧基结合,影响细胞内正常钙代谢和凋亡相关基因Bcl-2、p53和Fas表达[2-3];铅暴露能影响动物细胞、人体细胞和植物细胞的增殖、分化、DNA复制和修复[4-5],亦可致实验动物体内代谢紊乱、生殖细胞畸形,并可产生致死作用[6]。高浓度铅可影响种子萌发,抑制植物生长,甚至引起植株死亡[7]。因此,研究铅诱导细胞死亡的毒性机制具有重要意义。
铅的生物效应问题已在全世界范围内引起广泛关注。目前,关于铅毒性研究多集中于氧化损伤方面,铅可引起动植物细胞内活性氧(reactive oxygen species, ROS)水平增高,由此引发膜脂、蛋白质、DNA等生物大分子的氧化损伤,导致细胞死亡[8-9]。但是,有关铅的氧化损伤机制还缺乏进一步探讨,在铅诱导真核细胞死亡过程中胞内ROS如何参与以及ROS和胞内Ca2+信号转导之间的关系尚不清楚。
酵母是一种研究真核生物细胞学机制的模式生物,由于其简单的遗传背景,较短的生长周期等优点,已被广泛用于细胞分裂和死亡过程等复杂信号途径的研究[10]。因此,本文以酵母细胞作为研究对象,探讨了在铅诱导酵母细胞死亡中ROS和Ca2+信号的调控作用,旨在为揭示铅毒性作用机理提供科学依据。
1材料与方法(Materials and methods)
1.1 材料
酵母(Saccharomyces cerevisiae)EGY48菌株由浙江大学生命科学学院朱睦元教授惠赠。
取单菌落至YPD液体培养基中活化过夜,转至新YPD液体中,于30 ℃,200 r·min-1下培养至对数期。
1.2 酵母细胞染毒
采用1.5 mL离心管收集对数期的酵母细胞,用灭菌磷酸缓冲液(PBS)洗涤并悬浮,使菌液细胞浓度大约为106cell·mL-1。菌液中加入一定量的Pb(NO3)2,使处理浓度分别为2、7、20、60和100 mg·L-1,分别于30 ℃,200 r·min-1条件下处理3、6和24 h。
干预组分别采用1 mmol·L-1抗坏血酸(AsA)、0.5 mmol·L-1乙二醇双四乙酸(EGTA)和0.1 mmol·L-1氯化镧(LaCl3)与20 mg·L-1或60 mg·L-1Pb(NO3)2同时作用。处理6 h后,细胞经PBS洗涤备用。
1.3 细胞死亡率测定
采用美蓝染色法测定细胞死亡率,当美蓝进入活细胞时,由于活细胞新陈代谢旺盛,可将蓝色的美蓝还原为无色,而死细胞代谢作用微弱则呈蓝色或者浅蓝色。取酵母细胞进行染色,置于光学显微镜下观察并计数着色细胞和总细胞数,计算细胞死亡率(着色细胞数/总细胞数×100%)。每一处理组重复3次,每次观察至少1 000个细胞。
1.4 胞内ROS、Ca2+和线粒体膜电位水平的测定
用PBS制成体积90 μL、细胞浓度106cell·mL-1的细胞悬液3份,各自分别加入体积10 μL、浓度50 μmol·L-1特异性荧光染料二氯荧光黄双乙酸酯(DCFH-DA),体积10 μL、浓度50 μmol·L-1的Fluo-3AM和体积10 μL、浓度100 μg·mL-1罗丹明123(Rh123),用于检测胞内ROS、Ca2+和线粒体膜电位水平。用BD Accuri C6流式细胞仪(Becton Dickinson and Company, USA)进行检测,每个样品收集50 000个细胞,测其荧光强度变化。数据采集和分析分别用CellQuest 3.1f和ModFitLT3.0软件。
1.5 数据统计分析
采用SPSS17.0软件对实验结果进行方差分析,采用Duncan方法检验处理组与对照组差异显著性(*表示差异显著,P<0.05),以及干预组与铅单独处理组间的差异显著性(&表示差异显著,P<0.05)。
2 结果与分析(Results and analysis)
2.1 铅对酵母细胞活性的影响
经美蓝染色后显微镜观察发现,对照组有个别细胞呈淡蓝色,而铅处理组中有较多细胞被染成蓝色,说明铅可对酵母细胞产生毒性,引发细胞死亡。从图1可看出,铅作用在3~24 h内,死亡率与铅离子浓度呈现明显剂量效应关系,作用时间越长,死亡率越高:经2 mg·L-1的硝酸铅作用3 h后,细胞死亡率为2.3%,与对照无明显差异,但在24 h后死亡率达5.85%,明显高于对照组;100 mg·L-1硝酸铅处理3 h后死亡率为33.81%,显著高于对照,表明铅对酵母细胞的毒性具有浓度和时间依赖性。

图1 铅对酵母细胞的致死率Fig. 1 Effects of lead on mortality of yeast cell
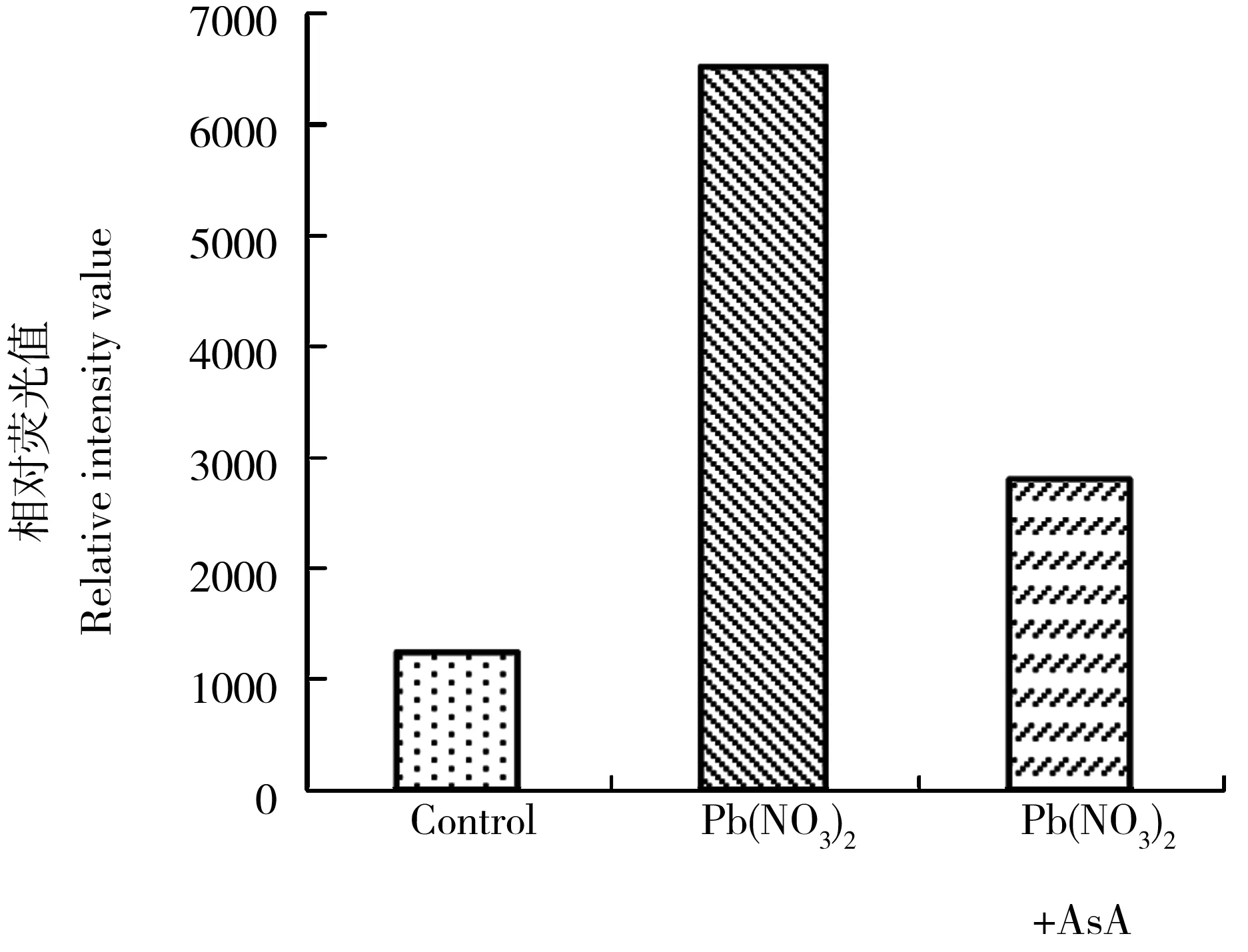
图2 铅对酵母胞内活性氧(ROS)水平的影响注:Pb(NO3)2处理组,浓度20 mg·L-1,处理时间为6 h;Pb(NO3)2+AsA为干预组,AsA表示抗坏血酸,浓度为1 mmol·L-1,Pb(NO3)2浓度为20 mg·L-1,处理时间为6 h。Fig. 2 Effects of lead on intracellular reactive oxygen species (ROS) levels in yeast cellsNote: Pb(NO3)2 is the treatment group, with its concentration being 20 mg·L-1 and the treatment time being 6 h. In comparison, Pb(NO3)2+AsA is the intervention group. In this group, the Pb(NO3)2 concentration is 20 mg·L-1, the ascorbic acid (AsA) concentration is 1 mmol·L-1,and the treatment time is 6 h.
2.2 ROS参与铅诱导酵母细胞死亡
经用流式细胞仪检测酵母细胞内的ROS水平,发现20 mg·L-1铅处理6 h后,胞内ROS水平明显增高(图2),为对照组的5.3倍,而在铅处理液中加入外源抗氧化剂AsA可降低铅引发的胞内ROS水平。同时检测细胞死亡率,发现1 mmol·L-1的AsA与20 mg·L-1或60 mg·L-1的铅同时作用时,细胞死亡率明显降低(图3);表明铅处理组胞内ROS水平升高与铅对酵母细胞的毒性作用有关。

图3 AsA对铅毒性的干预作用注:20 mg·L-1 Pb(NO3)2和60 mg·L-1 Pb(NO3)2处理组的处理时间分别为3 h和6 h;Pb(NO3)2+AsA为干预组,AsA浓度均为1 mmol·L-1,20 mg·L-1 Pb(NO3)2+AsA和60 mg·L-1 Pb(NO3)2+AsA的处理时间分别为3 h和6 h。* 处理组与对照组的差异显著P<0.05,&干预组与铅单独处理组间的差异显著P<0.05。Fig. 3 Intervention effects of AsA on Pb-induced yeast cell deathNote: in 20 mg·L-1 Pb(NO3)2 and 60 mg·L-1 Pb(NO3)2 treatment group,the treatment time is 3 h and 6 h respectively. In Pb(NO3)2+AsA intervention group, the AsA concentration is 1 mmol·L-1. The treatment time for 20 mg·L-1 Pb(NO3)2+AsA and 60 mg·L-1 Pb(NO3)2+AsA is 3 h and 6 h. * significant difference between Pb(NO3)2 treatment group and control group, P<0.05; & significant difference between single Pb(NO3)2 treatment group and intervention group with AsA, P<0.05.
2.3 Ca2+参与铅诱导的酵母细胞死亡
流式细胞仪检测发现,20 mg·L-1铅处理酵母细胞6 h后胞内Ca2+水平明显增高(图4),为对照组的1.7倍,而在铅处理液中加入EGTA或者LaCl3都能降低铅引发的胞内Ca2+水平的增高。同时,在铅处理液中加入钙离子干扰剂降低胞内Ca2+水平后检测细胞死亡率,发现0.5 mmol·L-1的钙离子螯合剂EGTA或0.1 mmol·L-1的质膜Ca2+通道抑制剂LaCl3能显著降低20 mg·L-1和60 mg·L-1铅的细胞毒性,使细胞死亡率显著降低(图5)。这表明铅处理组胞内Ca2+水平升高与铅对酵母细胞的毒性作用有关。

图4 铅对酵母胞内Ca2+水平的影响注:Pb(NO3)2处理组,浓度为20 mg·L-1,处理时间为6 h;Pb(NO3)2+EGTA为干预组,EGTA表示乙二醇双四乙酸,浓度为0.5 mmol·L-1,Pb(NO3)2浓度为20 mg·L-1,处理时间为6 h;Pb(NO3)2+LaCl3为干预组,LaCl3表示氯化镧,浓度为0.1 mmol·L-1,Pb(NO3)2浓度为20 mg·L-1,处理时间为6 h。Fig. 4 Effects of lead on intracellular Ca2+ levels in yeast cellsNote: in Pb(NO3)2 treatment group, Pb(NO3)2 concentration is 20 mg·L-1and the treatment time is 6 h. The Pb(NO3)2+EGTA is the intervention group, in which group the concentration of the ethylene glycol tetraacetic acid (EGTA) is 0.5 mmol·L-1, the Pb(NO3)2 concentration is 20 mg·L-1, and the treatment time is 6 h. In the Pb(NO3)2+LaCl3intervention group, the concentration of lanthanum chloride (LaCl3) is 0.1 mmol·L-1, the Pb(NO3)2 concentration is 20 mg·L-1, and the treatment time is 6 h.
2.4 铅对酵母细胞线粒体膜电位的影响
经20 mg·L-1铅处理6 h后,线粒体膜电位下降,为对照组的73%(图6)。这说明铅的细胞毒性伴随着线粒体膜电位的下降,对线粒体膜的损伤参与了介导酵母细胞死亡的途径。
3 讨论(Discussion)
铅是一种极其重要的工业和环境化学污染物,通过食物和饮水等方式进入机体后,可在体内长期蓄积,对人体造成严重危害。ROS是细胞受环境刺激后产生的一种胞内信号分子,可以介导生物适应,也能引发细胞死亡[11]。本文在检测到铅对酵母细胞的毒性作用后,采用流式细胞仪检测证实了铅处理组酵母细胞内ROS水平同期升高,用AsA降低铅处理组胞内ROS水平后,可发现细胞死亡率下降,从而说明铅毒性与胞内ROS水平升高有关,铅引起ROS水平升高介导了其毒性作用,胞内ROS升高是诱发细胞死亡的重要原因。该结果与其他学者报道的铅通过ROS水平升高介导动植物细胞死亡的结果一致[8-9],说明ROS是触发铅毒性作用的关键因素。

图5 EGTA和LaCl3对铅毒性的干预作用注:20 mg·L-1 Pb(NO3)2和60 mg·L-1 Pb(NO3)2处理组的处理时间分别为3 h和6 h;Pb(NO3)2+EGTA为干预组,EGTA浓度均为0.5 mmol·L-1,20 mg·L-1 Pb(NO3)2+EGTA和60 mg·L-1 Pb(NO3)2+EGTA的处理时间分别为3 h和6 h;Pb(NO3)2+LaCl3为干预组,LaCl3浓度均为0.1 mmol·L-1,20 mg·L-1 Pb(NO3)2+LaCl3和60 mg·L-1 Pb(NO3)2+LaCl3的处理时间分别为3 h和6 h。*处理组与对照组的差异显著P<0.05,&干预组与铅单独处理组间的差异显著P<0.05。Fig. 5 Intervention effects of EGTA and LaCl3 on Pb-induced yeast cell deathNote: in 20 mg·L-1 Pb(NO3)2 and 60 mg·L-1 Pb(NO3)2 treatment group,the treatment time is 3 h and 6 h respectively. In Pb(NO3)2+EGTA intervention groups, the EGTA concentration is 0.5 mmol·L-1. The treatment time for 20 mg·L-1 Pb(NO3)2+EGTA and 60 mg·L-1 Pb(NO3)2+EGTA is 3 h and 6 h. In Pb(NO3)2+LaCl3 intervention groups, the LaCl3concentration is 0.1 mmol·L-1. The treatment time for 20 mg·L-1 Pb(NO3)2+LaCl3 and 60 mg·L-1 Pb(NO3)2+LaCl3 is 3 h and 6 h. *significant difference between Pb(NO3)2 treatment group and control group,P<0.05; & significant difference between single Pb(NO3)2treatment group and intervention group with EGTA or LaCl3, P<0.05.

图6 铅对酵母细胞线粒体膜电位的影响Fig. 6 Effects of lead on mitochondrial membrane potential in yeast cell
研究发现,ROS主要通过以下2种途径导致细胞死亡:(1)ROS具有很高的反应活性,可以与细胞中各类大分子物质,如蛋白质、脂类和核酸等发生反应,从而破坏细胞结构,最终导致细胞死亡;(2)ROS作为重要的信号分子,可通过调节下游信号事件,启动细胞的凋亡级联反应,导致细胞死亡[12]。
已有研究表明,Ca2+水平的失衡可调控细胞内凋亡相关因子Bcl-2/Bax的表达,导致能量代谢等发生改变,继而引发细胞凋亡[13-14]。文中铅可诱导酵母细胞胞内Ca2+水平显著升高,用一定浓度Ca2+螯合剂EGTA或Ca2+通道抑制剂LaCl3降低铅处理组胞内Ca2+水平后,酵母细胞死亡率显著降低,即胞内Ca2+下降可缓解铅对酵母细胞的毒性,说明胞内Ca2+升高介导了铅的毒作用,而胞外Ca2+内流是胞内Ca2+升高的重要原因。铅诱发的酵母细胞内ROS水平升高可能是通过激活质膜Ca2+通道,使胞外Ca2+内流,导致胞内Ca2+水平升高,继而引发酵母细胞死亡,该研究结果与有关学者报道相一致[15-16]。
线粒体是多种促细胞凋亡信号转导分子的靶点,在细胞凋亡中起着决定性作用。当细胞受到外界胁迫时,胞内自由基水平升高,线粒体膜发生脂质过氧化反应[17];或者胞内Ca2+超载时,诱导线粒体通透性转换孔(PTP)开放,进而影响线粒体功能,导致线粒体膜电位发生改变,细胞色素c(cytc)释放,从而激活下游的凋亡途径,最终导致细胞凋亡[18]。Rh123是一种线粒体膜电位指示剂,细胞处于存活状态时,Rh123通过细胞膜,积聚于线粒体发出绿色荧光,而在细胞凋亡时,线粒体膜电负性降低,细胞线粒体积聚Rh123的能力也丧失,荧光强度降低[19]。本研究发现经铅处理后,Rh123的相对荧光值降低,即胞内线粒体膜电位明显下降,说明胞内高浓度的Ca2+可能通过诱导线粒体膜通透性转变孔道开放,或者高水平ROS可能损伤线粒体膜,致线粒体膜电位下降,继而激活相关下游信号导致细胞死亡。
本文以模式生物酵母菌研究了铅对酵母细胞的毒性效应,发现了铅诱导的细胞死亡及胞内ROS和Ca2+的调节作用,证实了铅致死的线粒体途径,与某些学者在人和动物细胞中的研究结果相似[9,20],说明铅毒性作用过程在动物细胞和酵母细胞中具有较高的一致性,而酵母细胞具有生长周期短,易培养,遗传背景简单等优点,有望作为研究铅毒性作用的模式系统。
[1] Flora G, Gupta D,Tiwari A. Toxicity of lead: A review with recent updates [J]. Interdisciplinary Toxicology, 2012, 5(2): 47-58
[2] Papanikolaou N C, Hatzidaki E G, Belivanis S, et al. Lead toxicity update. A brief review [J]. Medical Science Monitor, 2005, 11(10): 329-336
[3] Xu J, Ji L D, Xu L H. Lead induced apoptosis in PC12 cells: Involvement of p53,bcl-2 family and caspase-3 [J]. Toxicology Letters, 2006, 166: 160-167
[4] Senut M C, Sen A, Cingolani P, et al. Lead exposure disrupts global DNA methylation in human embryonic stem cells and alters their neuronal differentiation [J]. Toxicological Sciences, 2014, 139(1): 142-161
[5] Pourrut B, Shahid M, Dumat C, et al. Lead uptake, toxicity, and detoxification in plants [J]. Reviews of Environmental Contamination and Toxicology, 2011, 213: 113-136
[6] Hamadouche N A, Nesrine S, Abdelkeder A. Lead toxicity and the hypothalamic-pituitary-testicular-axis [J]. Notulae Scientia Biologicae, 2013, 5(1): 1-6
[7] Shu X, Zhang Q, Wang W. Lead induced changes in growth and micronutrient uptake of Jatropha curcas L [J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(5): 611-617
[8] Kaur G, Singh H P, Batish D R, et al. A time course assessment of changes in reactive oxygen species generation and antioxidant defense in hydroponically grown wheat in response to lead ions (Pb2+) [J]. Protoplasma, 2012, 249(4): 1091-1100
[9] Flora S J, Saxena G, Mehta A. Reversal of lead-induced neuronal apoptosis by chelation treatment in rats: Role of reactive oxygen species and intracellular Ca2+[J]. Journal of Pharmacology and Experimental Therapeutics, 2007, 322(1): 108-116
[10] Wu L H, Yi H L, Zhang H F. Reactive oxygen species and Ca2+are involved in sodium arsenite-induced cell killing in yeast cells [J]. FEMS Microbiology Letters, 2013, 343(1): 57-63
[11] Panieri E, Gogvadze V, Norberg E, et al. Reactive oxygen species generated in different compartments induce cell death, survival, or senescence [J]. Free Radical Biology and Medicine, 2013, 57(2): 176-187
[12] Ray P D, Huang B W, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling [J]. Cellular Signaling, 2012, 24(5): 981-990
[13] Pei Z M, Murata Y, Benning G, et al. Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells [J]. Nature, 2000, 406(6797): 731-734
[14] Rosario R, Paolo P, Davide F, et al. Calcium and apoptosis: Facts and hypotheses [J]. Oncogene, 2003, 22(53):8619-8627
[15] Sanders T, Liu Y, Buchner V, et al. Neurotoxic effects and biomarkers of lead exposure: A review [J]. Reviews on Environmental Health, 2009, 24(1): 15-45
[16] Ma Y, Fu D, Liu Z. Effect of lead on apoptosis in cultured rat primary osteoblasts [J]. Toxicology and Industrial Health, 2012, 28(2): 136-146
[17] Balaban R, Nemoto S T. Mitochondria, oxidants, and aging [J]. Cell, 2005, 120(4): 483-495
[18] Orrenius S, Gogvadze V, Zhivotovsky B. Calcium and mitochondria in the regulation of cell death [J]. Biochemical and Biophysical Research Communications, 2015, 460(1): 72-81
[19] Oconnor J E, Vargas J L, Kimler B F, et al. Use of rhodamine 123 to investigate alterations in mitochondrial activity in isolated mouse liver mitochondria [J]. Biochemical and Biophysical Research Communications, 1988, 151(1):568-573
[20] Gillis B S, Arbieva Z, Gavin I M. Analysis of lead toxicity in human cells [J]. BMC Genomics, 2012, 13(1):1-12
◆
ROS and Calcium Signal is Involved in Lead Toxicity in Yeast Cells
Zhang Ruigang,Yi Huilan*
School of Life Sciences, Shanxi University, Taiyuan 030006, China
Received 7 January 2016 accepted 17 May 2016
This paper was conducted to research the cellular toxicity of lead based on the model yeasts to explore the role that intracellular reactive oxygen species (ROS) and Ca2+play in the mechanism of the cell death induced by lead. The results revealed that the cellular bioactivity of yeasts was inhibited by lead nitrate at the concentration from 5 to 100 mg·L-1and the cell death induced by lead was found. Yeast cell mortality increases with the increase of lead concentration and the extension of time. The levels of ROS and Ca2+elevated significantly and the mitochondrial membrane potential decreased dramatically in yeast cells under lead stress. Cell death induced by lead was decreased by ascorbic acid (AsA) at the concentration of 1 mmol·L-1and was inhibited by the calcium chelator (EGTA) at the concentration of 0.5 mmol·L-1or the specific inhibitor of plasma membrane Ca2+channel (LaCl3) at the concentration of 0.1 mmol·L-1. The results showed that cell death induced by lead was related to the levels of intracellular ROS and Ca2+. The opening of mitochondrial membrane permeability transition pore channels may be induced by high levels of Ca2+, or mitochondrial membranes were broken by high levels of ROS, which lead to decreasing membrane potential and cause cell death by activating down-stream relevant signal pathways.
lead; yeast cell; cytotoxity; ROS; Ca2+
国家自然科学基金项目(No.30870454, 30470318, 31371868);山西省科技攻关计划(No.20120322008-02);山西省回国留学人员科研项目(No.2012013)
张瑞刚(1984-),男,博士,研究方向为环境微生物,E-mail: zhangruigang1224@163.com;
*通讯作者(Corresponding author), E-mail: yihl@sxu.edu.cn
10.7524/AJE.1673-5897.20160107001
2016-01-07 录用日期:2016-05-17
1673-5897(2016)6-128-06
X171.5
A
仪慧兰(1963—),女,博士,教授,博士生导师,主要从事环境生物学与逆境生理学方面的研究,承担和完成国家级研究课题5项,省部级研究课题10余项,发表研究论文90余篇。
张瑞刚, 仪慧兰. 活性氧和钙信号参与铅对酵母细胞的毒性作用[J]. 生态毒理学报,2016, 11(6): 128-133
Zhang R G, Yi H L. ROS and calcium signal is involved in lead toxicity in yeast cells [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 128-133 (in Chinese)

