PFOS对多齿围沙蚕CYPs、GST基因转录及酶活性的毒性效应
陈西,阎希柱,*,宿丽丽
1. 集美大学,厦门 361000 2. 农业部东海海水健康养殖重点实验室,厦门 361000
PFOS对多齿围沙蚕CYPs、GST基因转录及酶活性的毒性效应
陈西1,2,阎希柱1,2,*,宿丽丽1,2
1. 集美大学,厦门 361000 2. 农业部东海海水健康养殖重点实验室,厦门 361000
多毛类沙蚕已经广泛应用于海洋环境污染的生物监测,但其对新型持久性有机污染物全氟辛烷磺酰基化合物PFOS的毒理学研究尚无报道。本研究以潮间带优势种多齿围沙蚕(Perinereis nuntia)为研究对象,以细胞色素P450(CYP)、谷胱甘肽硫转移酶(GST)的基因和酶作为联合指标,研究了在PFOS亚致死浓度(4、8、16 mg·L-1)暴露第1、4、7、14天及净水恢复5 d后多齿围沙蚕CYP431A1、CYP424A1基因转录水平和EROD酶活性、GST omega基因转录水平和GST酶活性的响应情况。结果表明,PFOS暴露对EROD的抑制具有明显的时间-效应关系;CYP2系成员CYP431A1基因转录水平对PFOS的响应具有良好的剂量-效应关系并在胁迫第14天表现出最高的可诱导性;CYP4系基因CYP424A1的转录在4、8 mg·L-1处理组中与PFOS暴露时间正相关。II相解毒系统成员GST酶活和GST omega基因的响应均表现出随着PFOS胁迫时间的延长先下降,后上升的规律;多齿围沙蚕在高强度PFOS胁迫下仍可加速新陈代谢,表现出对PFOS的耐受性;净水恢复阶段,各指标都有向对照组水平恢复的趋势。总之,基因和蛋白的响应表明CYPs和GST在多齿围沙蚕PFOS新陈代谢中发挥重要作用,这些基因和酶具有作为生物标志物监测海洋潮间带PFOS污染效应的潜力。
全氟辛烷磺酸化合物(PFOS);多齿围沙蚕;氧化损伤;细胞色素P450;谷胱甘肽硫转移酶
全氟辛烷磺酰基化合物(perfluorooctane sulfonate, PFOS)是最主要的全氟化污染物[1],已经造成全球性污染,其环境效应也受到越来越多的关注[2]。2009年,PFOS作为新型持久性有机污染物被正式列入《斯德哥尔摩公约》附件[3]。但是PFOS仍然被制造和应用,而且PFOS是多种全氟化合物前体的终端产物,有超过50类PFOS前体广泛地应用于工业生产中[4],Thibodeaux等[5]指出,人类和环境仍将长期处于PFOS的暴露中。PFOS在水体中的污染水平相对较低,处于纳克级,但PFOS具有生物放大效应,通过食物链蓄积于高营养级生物体内,可达毫克级水平。例如,在采集自德国海湾的斑海豹组织中含有的18种全氟化合物中,PFOS污染浓度最高,达到1.7 mgg-1[6];Tomy等[7]检验北极东部海域PFOS在食物网中的生物富集程度,PFOS在所有受检物种中均存在并且污染含量最高,PFOS污染生物放大因子为0.4~9.0,表现出与物种营养级之间显著的线性关系。Martin等[8]在北极生物群食物链顶端的北极熊体内检测到,最高浓度达到4 mgg-1。关于我国PFOS在生物体内污染的研究中,比较值得关注的是PFOS在海洋食品中的污染。Gulkowska等[9]以水产市场为检测对象,发现PFOS做为最主要的氟化污染物在27类海洋食品样品包括软体动物、螃蟹、小虾、牡蛎、蚌和蛤中均被检出,最高污染浓度达到1.3 mgg-1。张新等[10]在大连市常见海洋产品如鱼、蟹、乌鱼中也检测到PFOS的普遍污染。此外,因为PFOS是众多全氟化合物的终产物,经污水处理厂处理后排放的水中,PFOS含量反而会升高。李飞等[11]检测全氟有机酸在上海市9座污水处理厂进水和出水中的污染情况,结果表明中等链长(C6~C10)全氟有机酸会在污水处理过程中显著增加,其中PFOS是主要的全氟污染物之一,浓度为最高为1.027 mgL-1占总全氟有机酸污染物的1%~30%。PFOS因污染持续性,蓄积性和已造成全球污染的现状受到广泛关注,亟需进一步探讨PFOS致毒机理并筛选可行的生物标志物。
沙蚕是环节动物门、多毛纲、沙蚕目、沙蚕科动物的通称,是潮间带生态系统中的主要类群,在近岸水域食物网的物质循环和能量流动中发挥重要作用。任可欣和阎希柱[12]基于沙蚕的分布广泛性,养殖易得性,以及已经表现出的生境修复功能将沙蚕列为现阶段我国滩涂修复优势种。目前已经开展了多毛类沙蚕分子生物标志物对多种重金属污染和有机污染指示的研究。研究表明,沙蚕在养殖底泥[13],虾池水质[14],河口的泥水界面[15]的生境修复中发挥重要作用。尚无探讨潮间带优势种多齿围沙蚕作为PFOS污染指示物种可行性的研究。
胞色素P450(cytochrome P450, CYP)属于Ⅰ相解毒系统,在内源性基质生物转化和催化作用中发挥重要作用,还可将脂溶性有机异生物质转化为水溶性、易排泄的代谢产物,几乎存在于生物体内的所有组织[16],由于CYPs可对低剂量的外源污染物产生响应,这使得利用CYPs酶活性或基因表达量指示低剂量PFOS生态毒理诊断成为可能[17-18]。7-乙氧基异吩恶唑-O-脱乙基酶(EROD)的活性可以用来表示对CYP1A1亚型的诱导作用[19]。目前以EROD酶为代表的CYPs作为生物标志物反映污染胁迫效应在不同生物中得到验证。Oost等[20]因EROD在肝脏中表现出的敏感性而将其列为最有价值的鱼类生物标志物。目前已经开展EROD酶作为多种持久性有机污染物如二噁英[21]、多氯联苯[22]、苯并(a)芘[23]等的生物标志物的研究。但是在复杂的污染海域,如果仅仅应用EROD活性这一个生物标志物来监测和评估海洋环境污染及其效应状况将具有一定的局限性,有可能出现指标与环境污染程度不完全一致的情况[19]。CYPs蛋白与基因水平的联合指示对野外生境污染物的监测更具有实际意义。然而与脊椎动物不同,无脊椎动物尚未克隆得到CYP1A序列,至今只鉴定得到十几条多毛纲动物的CYPs基因[24-25]。CYP431A1由Won等[26]克隆,属于CYP2系成员,与脊椎动物CYP1家族属于同一系,该研究探究了多齿围沙蚕CYPs基因作为多环芳烃(PAHs)生物指示物的可行性,结果显示CYP431A1 mRNA表达量与对照组相比上调800倍,并具有良好的剂量效应。推断多齿围沙蚕CYP2系基因CYP431A1在代谢亲水性PAHs毒性中发挥显著作用,提供了环境监测评估的可能性,但多齿围沙蚕CYP431A1外源性物质新陈代谢中各种生化功能仍不清楚,需要更多沙蚕CYP2系基因的研究。CYP424A1基因由Zheng等[27]克隆,归类于新的CYPs家族但属于CYP4系成员。研究发现该基因转录水平对PAHs胁迫表现出了最高的可诱导性(12倍)并指出CYP424A1可能在外源性物质解毒过程中扮演着较为活跃的角色。
谷胱甘肽硫转移酶(GST)是广泛分布于动物、植物及微生物体内的一组多功能同工酶,属于Ⅱ相解毒酶。GST能催化过氧化物的还原反应,促进GSH的巯基(-SH)与毒素结合形成亲电子试剂[28]从而减轻污染物毒性。厦门岛周围F个采样点僧帽牡蛎消化腺和鳃中GST的活性与整个组织石油碳氢化合物的含量有很好的相关性[29]。Cairrão等[30]的一项研究认为用墨角藻GST活性作为环境生物标志物进行沿海地区和港湾污染监测是可行的。GST基因含有多个成员,GST omega基因在多齿围沙蚕对镉胁迫的响应中具有高的敏感性和剂量-效应关系,被认为是多齿围沙蚕最具有潜力的分子生物标志物之一[31]。
本文首次研究了潮间带这一重要生态系统中多齿围沙蚕CYPs及GST在PFOS胁迫下基因(CYP431A1、CYP424A1、GST omega),酶活性(EROD、GST)的联合响应,以期建立量效关系,为评价PFOS污染效应提供依据,探究二者在PFOS新陈代谢中可能的功能和解毒机理。
1 材料与方法(Materials and methods)
1.1 试剂和仪器
主要试剂包括全氟辛烷磺酸钾(C8F17KO3S),纯度AR级(Tokyo公司)。蛋白定量试剂盒,GST酶活性试剂盒购自南京建成生物工程研究所。还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),7-乙氧基异吩噁唑酮(ERF),异吩噁唑酮(RF)均购自sigma公司。Trizol,逆转录试剂盒,回收试剂盒,实时荧光定量试剂盒均购自Takara公司。助溶剂二甲基亚砜(DMSO)及其他试剂为市售AR级分析纯。使用的主要仪器包括荧光分光光度计(Cary Eclipse,美国Varian);酶标仪(Synergy HT,美国BioTek);荧光定量PCR仪(Fast step one,美国ABI)。
1.2 暴露实验
受试动物多齿围沙蚕(Perinereis nuntia)购自福建省福清沙蚕养殖场。健康成体沙蚕在洁净海水(盐度30‰;温度(22±1) °C;pH 7.8;DO (6.5±0.5) mg·L-1)中暂养7 d,海水取自集美大学海水养殖场,经4层纱布过滤并煮沸冷却后用于试验,期间不断曝气。饵料为凡纳滨对虾饵料,颗粒粒径粉碎为60目后投喂,每日喂食2次及时清理死亡个体。24 h饥饿处理后挑取规格一致的沙蚕(0.45 g±0.05 g)进行暴露实验,试验期间停止喂食。
实验在500 mL烧杯中进行,铺2 cm经450 ℃灼烧6 h的细沙。根据前期实验结果,以PFOS对多齿围沙蚕96 h-LC50(64 mgL-1)的1/4,1/8,1/16为暴露浓度(DMSO助溶,终浓度0.01%),以DMSO(终浓度0.01%)海水组和空白海水组做对照,胁迫14 d后,各处理组转入洁净海水中进行净水恢复实验,每天换液一次并昼夜曝气。每个处理取3个平行样,各放入10条沙蚕,加溶液20 mL。于暴露实验的第1、4、7、14天以及净水恢复的第5天(图中用r5表示)活体取样。暴露期间,沙蚕出现行动迟缓等症状,但存活状况良好未发现该胁迫强度下有死亡个体。
1.3 酶活性的测定
称取沙蚕除头部以外的组织样品(30 mg±1.5 mg)加1.5 mL预冷的匀浆液(磷酸缓冲液,pH 7.6),在冰浴中每匀浆15 s,暂停30 s,循环3次,立即冷冻离心(-4 ℃,10 000 r·min-1,20 min),取上清液立即测EROD酶活和总蛋白质含量。根据文献[21-22]的方法稍加改进,测EROD酶活性。反应温度为室温20 ℃,反应总体系中含磷酸缓冲液(PBS)(pH 7.6)3 mL,待测酶样200 μL,ERF(0.40 mmol·L-1)20 μL。反应通过加入NADPH(0.25 mmol·L-1)20 μL启动。激发波长为532 nm,发射波长580 nm,反应开始后每隔30 s记录产物RF荧光值至5 min。绘制RF标准曲线,将所测得的数据作线性回归,求其产物每分钟的变化情况,经蛋白质数据归一化处理后,即可计算出其活性,酶活单位为pmol·min-1·mg prot-1。GST酶活性和总蛋白含量的测定均采用南京建成生物工程研究所试剂盒,GST酶活性数据来自实验室未发表的成果,所有暴露实验条件及方法与本研究一致。
1.4 基因相对表达量的测定
取沙蚕除头部以外的组织样品(100 mg±5 mg)于液氮中研磨,每个处理取3个平行样,按照Trizol试剂盒说明书提取样品总RNA,并根据琼脂糖凝胶电泳以及样品A260/280比值判断总RNA质量与完整度,测定RNA浓度,以1 000 ng的总RNA为初始模板合成cDNA。
多齿围沙蚕内参基因18S rRNA,CYPs基因CYP431A1、CYP424A1、GST基因GST omega通过Primer primer 5.0设计并由华大基因合成,引物序列见表1。以反转录得到的第一链cDNA为模板,进行PCR扩增反应,检验引物是否可以单一特异性扩增。将PCR扩增产物纯化后进行梯度稀释,作为模板进行实时荧光定量PCR扩增,根据标准曲线的R2值检验引物的扩增效率。
荧光定量PCR反应体系包括模板cDNA 1 μL,SYBR Premix EX Taq 10 μL,PCR上下游引物(10 μmol·L-1)各0.8 μL,ROX Dye 0.4 μL,双蒸水7 μL,配制20 μL反应体系,每个生物学平行做3个复孔。
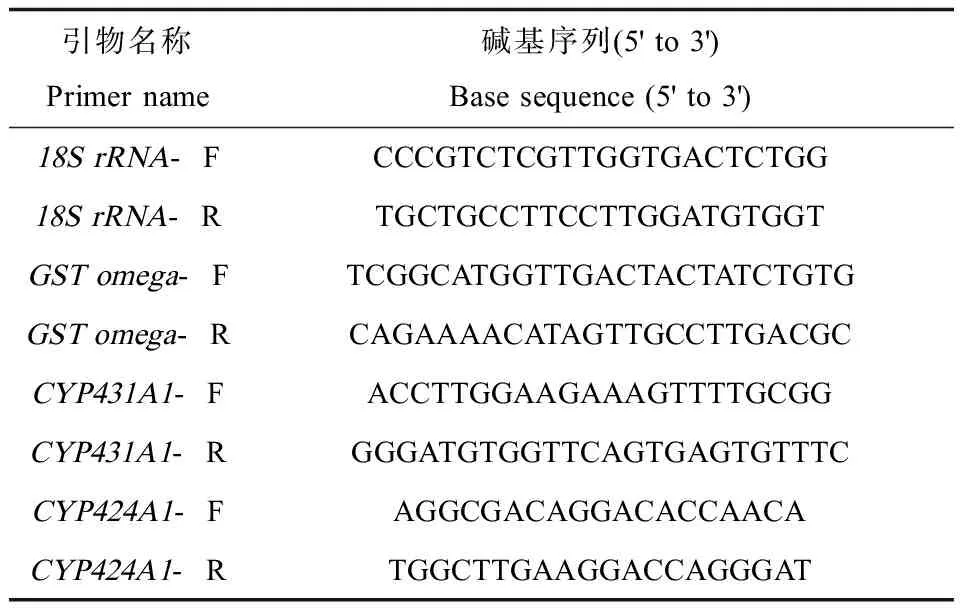
表1 逆转录-实时荧光定量PCR中检测CYPs和GST mRNAs的引物序列Table 1 Primer sequences for CYPs and GST mRNAs in RT-real time PCRs
根据优化结果最终确定反应条件:95 ℃ 30 s,40个循环,95 ℃ 5 s,60 ℃ 30 s。
1.5 数据统计
实验结果用SPSS 19.0软件进行单因素方差分析并进行LSD多重分析,“*”、“**”表示处理组与对照组差异显著,显著性水平为P<0.05、P<0.01。实时荧光定量数据采用2-△△Ct法分析。实验数据用平均值±标准差(mean±SD)表示,Origin 8.0软件作图。
2 结果(Results)
通过单因素方差分析发现助溶剂对照组与空白对照组中的多齿围沙蚕各指标的响应无显著差异,表明0.01%的DMSO对指标的变化没有影响。以下分析PFOS对多齿围沙蚕CYPs、GST酶活性和基因表达的影响时选取助溶剂对照组作为参照。对各指标数据进行方差齐性检验,符合方差齐性的要求。

图1 PFOS对多齿围沙蚕EROD酶活性的影响注:r5表示净水恢复实验时间为5 d。*、**表示与二甲基亚砜(DMSO)溶剂对照相比,差异显著,P<0.05、P<0.01。下同。Fig. 1 The response of EROD activity of P. nuntia exposed to PFOSNote: r5 means the 5-day recovery period. *, ** mean the statistical difference from control (DMSO) group at P<0.05 and P<0.01 respectively. Similarly hereinafter.
2.1 PFOS对多齿围沙蚕EROD酶活性和CYPs基因相对表达的影响
本研究测定的RF浓度与荧光强度F值(x)具有良好的线性关系,y=0.00094x+0.13391,R2=0.997。PFOS胁迫下多齿围沙蚕EROD酶活性变化如图1。与对照组相比,EROD酶活性总体处于被抑制的状态,胁迫第1天时EROD活性被显著抑制(P<0.01),第4天时有所上升但仍低于对照水平。在7~14 d胁迫阶段,不同处理组EROD酶活性均表现出线性下降趋势,随着胁迫时间增加PFOS对EROD酶活性的抑制程度逐步上升。胁迫过程中EROD酶活性普遍在低浓度4 mg·L-1处理组中具有更高的抑制率。净水处理阶段EROD的酶活性有所恢复,各处理组分别为胁迫第14天的1.98、2.70、1.63倍。
利用RT-real time PCRs检测多齿围沙蚕暴露于不同浓度PFOS在不同时间CYP431A1、CYP424A1基因转录表达量的变化情况(图2)。结果显示,CYP431A1基因的表达(图2A)具有一定的剂量效应,相同胁迫时间内,基因表达量随胁迫浓度的增加呈递增趋势。在胁迫初期第1天基因CYP431A1表达量显著(P<0.01)上升且在16 mg·L-1浓度处理组表现更加明显,达到对照组的12倍,在4、7 d的胁迫中,在各剂量组中该基因的表达受到了一定的抑制,但与相应的对照组比较,高剂量处理组中该基因上调表达仍然呈现出显著差异(P<0.01)。胁迫第14天各处理组表达量均出现了显著(P<0.01)上调,3个处理组CYP431A1表达量分别达到对照组的45、51、80倍。净水恢复5 d后基因表达量明显下降。
图2B中,同一浓度下随着胁迫时间的延长,各处理组CYP424A1基因相对表达量总体上出现上调,呈现出该基因表达量随时间的延长而升高的趋势。其中,4 mg·L-1处理组在胁迫1~4 d与对照组无显著差异,在胁迫第7、14天分别达到对照组的2倍、5倍;8 mg·L-1处理组在胁迫1~7 d与对照组无显著差异,但在第14天与对照组差异显著(P<0.01)并达到对照组的3倍;16 mg·L-1处理组基因表达量在胁迫1~7 d也出现线性增长,在胁迫第14天被抑制。CYP431A1基因的相对表达量呈现出明显的时间-效应关系。但PFOS胁迫与该基因表达含量之间并未出现剂量-效应关系,普遍结果表现为随着胁迫浓度的升高基因相对表达量呈现先升高后降低再升高的趋势,净水恢复5 d后该基因表达量有所下降。
2.2 PFOS胁迫对多齿围沙蚕GST酶活性和GST基因相对表达量的影响
根据前期实验结果(图3),GST酶活性在PFOS胁迫第1天的低浓度4 mg·L-1处理组中被显著抑制(P<0.05),抑制率为50%;在中浓度8 mg·L-1处理组也被显著抑制(P<0.01),抑制率为70%;但在高浓度16 mg·L-1处理下活性有所上升。该特征也体现在时间-效应中,随着胁迫时间的延长GST酶活性被抑制,但在胁迫后期14 d时各处理组均有所上升,虽然8 mg·L-1浓度处理组GST酶活性仍低于对照,但相较于胁迫第7天上升了1.3倍,14 d时已基本回到对照水平(P>0.05),而14 d时4、16 mg·L-1浓度处理组则显著高于对照水平(P<0.05)。在净水恢复后5 d,除中浓度处理组外,GST酶活性有恢复正常表达的趋势。
除胁迫第1天,4 mg·L-1处理组以外,各胁迫情况下GST基因相对表达量(图4)始终高于对照组,表明GST基因参与到了PFOS的外源性物质代谢中。GST基因相对表达量呈现一定的剂量效应,总体表现为随着胁迫浓度的升高而升高。8 mg·L-1和16 mg·L-1处理组出现了相似的时间效应关系,均在胁迫1~4 d有所上升,在胁迫第7天被抑制,在胁迫后期第14天出现了显著的上升(P<0.01);而低浓度4 mg·L-1处理下,GST基因相对表达量在1~4 d期间显著高于对照组(P<0.05),7~15 d期间表达量持续上调与对照组差异显著(P<0.01)。不同处理组GST表达量均在第14天显著上调并达到最高值,分别为对照组的6、8、7倍。净水恢复后5 d,GST表达量有所下降,其中4、8 mg·L-1处理组下降到对照水平,16 mg·L-1处理组仍显著高于对照组(P<0.05)。

图2 PFOS对多齿围沙蚕CYPs基因转录水平的影响Fig. 2 The response of CYPs mRNA relative expression of P. nuntia exposed to PFOS
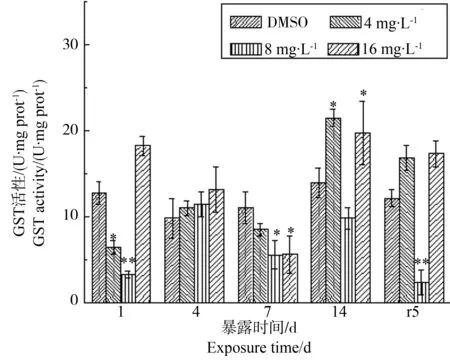
图3 PFOS对多齿围沙蚕GST酶活性的影响Fig. 3 The response of GST activity of P. nuntia exposed to PFOS
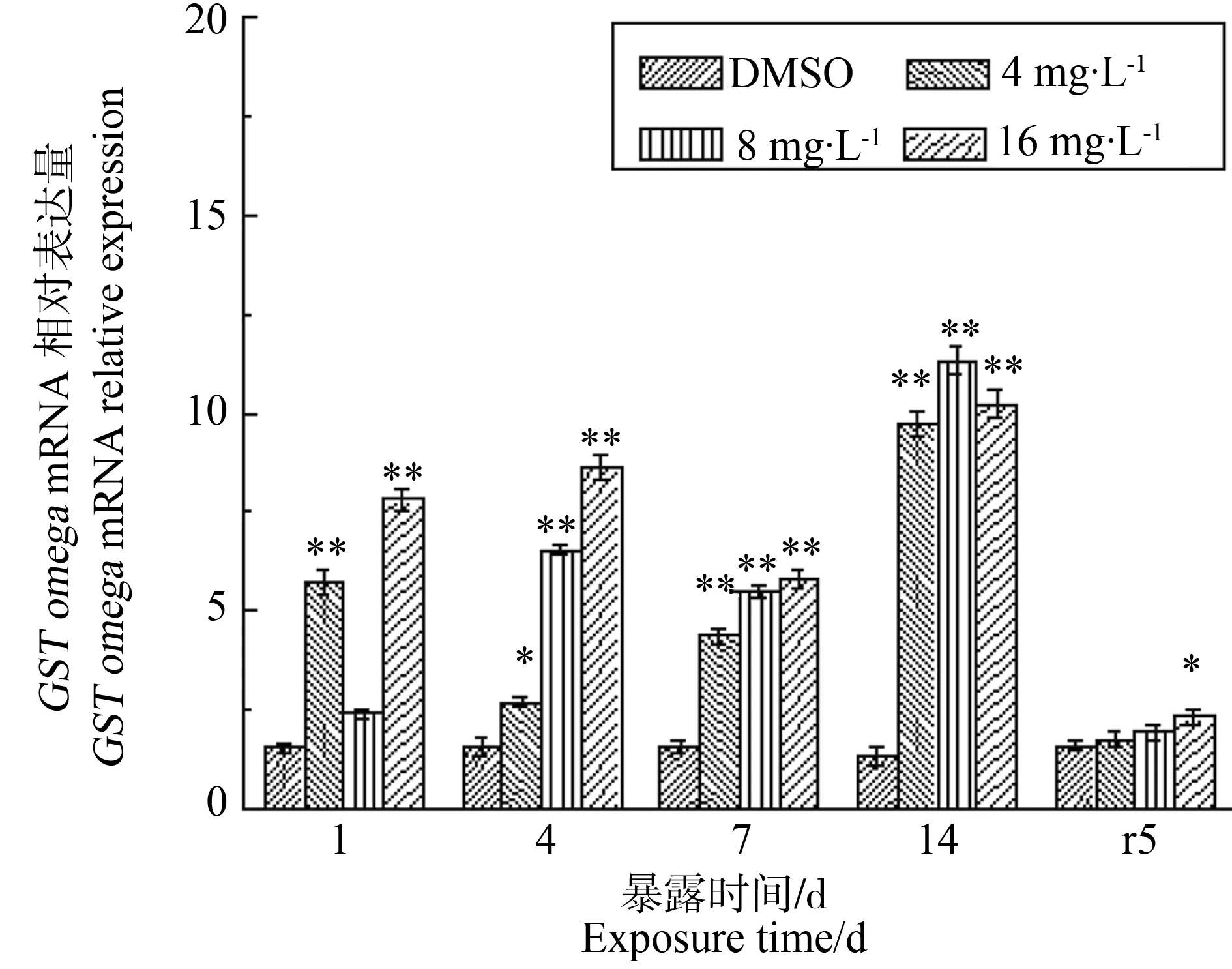
图4 PFOS对多齿围沙蚕GST基因转录水平的影响Fig. 4 The response of GST mRNA relative expression of P. nuntia exposed to PFOS
3 讨论(Discussion)
本研究中,EROD活性与对照组相比总体处于被抑制的状态,胁迫第1天各处理组酶活性与对照组产生显著差异(P<0.01),但随着PFOS胁迫时间的延长EROD活性反而有所恢复,第4天时已恢复到正常水平,酶活性恢复到一定程度后随着胁迫时间的延续而降低。同一浓度组的EROD酶活性随时间均呈现出先上升后下降的钟形曲线,这种趋势反映PFOS暴露初期可以对EROD酶活性产生抑制,机体可以通过恢复CYP1A1酶活性并与PFOS结合,增加外源性物质极性。但随着代谢产物的增加,仍对CYP1A1酶活性产生抑制,这种抑制趋势可以在净水恢复阶段得到缓解。在PFOS对赤子爱胜蚯蚓胁迫的研究中,细胞色素450含量与其他抗氧化防御系统酶如过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)相比也表现出更强的敏感性[32]。值得注意的是,在4~14 d的后期胁迫中各处理组EROD酶活性均呈下调趋势,酶活性与胁迫时间具有良好的线性关系,R2值分别为0.85(4 mgL-1)、0.96(8 mgL-1)、0.91(16 mgL-1)。结果表明PFOS胁迫强度与多齿围沙蚕EROD酶活性的抑制之间存在一定的正相关关系,因此,多齿围沙蚕EROD酶活性的抑制程度有作为环境污染指标的潜力。一些研究已经表明PFOS暴露无法诱导动物CYP1A[33-34]。Hu(2003)等[34]通过测定EROD酶活性发现PFOS单独胁迫无法诱导CYP1A1的表达。本研究EROD活性始终处于被抑制状态与之结果相似。以EROD酶抑制率作为高强度胁迫下污染等级的评价指标还需要更深入的统计。
CYP2系基因CYP431A1 mRNA在PFOS胁迫初期就表现出良好的剂量效应,最高浓度组(16 mgL-1)达到对照的12倍,随着胁迫时间的延长,该基因的表达逐渐恢复初始水平,在胁迫后期第14天,最高浓度组达到对照组的80倍表现出显著的可诱导性(P<0.01)。这表明CYP431A1可能参与机体在损伤初期的氧化应激保护和损伤后期的外源性物质代谢。在脊椎动物和一些昆虫中,CYP2系(如CYP1、CYP2家族)包含大量功能的酶可在不同药物和外源性物质代谢中发挥作用[35]。本研究与Won等[26]的研究结果相似,显著上调的CYP431A1表明多齿围沙蚕CYP2系对PFOS所引起的损伤最为敏感。Rewitz等[36]的研究表明海滨螃蟹(Carcinus maenas)CYP2系CYP330A1基因可被苯巴比妥和苯并芘(BaP)诱导并指出CYP2系在无脊椎动物和脊椎动物中有相似功能的酶。Brinkworth和Hodson[37]报道了虹鳟鱼CYP2系酶可能参与低分子量外源性物质的生物转化。CYP431A1与脊椎动物CYP1家族属于同一系[26],PFOS对真鲷CYP1A1诱导结果表明[38],CYP1A1参与PFOS代谢是由多环芳烃受体AhR所介导的,这与大部分研究结果相似,真鲷CYP1A1基因在高浓度PFOS胁迫(2 mgL-1)和长时间(7 d )胁迫下均呈现被抑制的趋势,CYP1A1在PFOS低强度胁迫下的表达更为活跃。PFOS对斑马鱼肝脏内CYP1A基因的诱导也呈现随浓度升高先上升后回落的趋势[39]。本研究中,CYP431A1在PFOS前7 d胁迫下表达水平也表现为先显著上升后下降,与鱼类CYP1A参与PFOS代谢的表达趋势部分吻合,暗示CYP431A1可能在多齿围沙蚕外源物质代谢中发挥着与脊椎动物CYP1A相似的作用。
与CYP431A1相比,PFOS胁迫下多齿围沙蚕CYP4系基因CYP424A1并没有特别突出的诱导量,但是该基因表达具有一定的时间效应,随胁迫时间延长,不同浓度组总体呈现上调趋势。哺乳动物中,CYP4酶催化脂肪酸末端羟基化并且活跃多类有毒物质新陈代谢,昆虫CYP4基因参与外源性物质的新陈代谢,并且可能参与了对杀虫剂的抵抗[27]。与Li等[24]在小头虫(Capitella capitata),赵欢等[40]在双齿围沙蚕(Perinereis aibuhitensis)上的研究结果相似,CYP4在多毛纲的表达诱导程度较低,但鉴于CYP424A1表达的持续上调,推断该基因在PFOS代谢中仍处于较活跃的位置。CYP424A1构型和脊椎动物CYP3A基因非常相似[27],CYP3A酶同样在鱼肠道外源性食物的首过代谢中扮演着重要角色[41]。多齿围沙蚕CYP424A1表达量在PFOS胁迫后期(14 d)对低浓度胁迫更为敏感,而高浓度胁迫使其表达量下降到与对照组无显著差异的水平。推测多齿围沙蚕CYP4系CYP424A1基因在高强度胁迫下甚至会出现被抑制的可能,当然这需要更宽PFOS浓度的胁迫来证实它的转录抑制性。结果表明多齿围沙蚕CYP424A1更适合做为低剂量长期PFOS暴露下的参选标记。
EROD酶活性以及CYPs基因转录水平对PFOS的响应表明多齿围沙蚕CYP1A1亚族、CYP2系以及CYP4系成员是可对外源性物质的胁迫产生响应的。这三者分属于CYPs不同家族,响应模式的差异可能受以下2个方面的影响:(1)与CYPs不同成员自身与基质亲和力差异有关。例如,Kurt和Kathleen[42]的研究表明CYP2系(CYP2E)和CYP3系(CYP3A4)酶分别与人类小分子亲水性化合物和亲脂性的化合物具有更高的亲和力。(2)Skupinska等[43]指出CYPs超家族不同成员的响应可能受不同受体通路的诱导。该差异也说明,以EROD作为单一指标进行污染物监测的结果可能无法概括生物体受污染状态的全貌。从EROD反映的结果来看,在本研究的浓度范围内PFOS胁迫下机体解毒酶处于被抑制状态,但从CYP2系基因的高表达和CYP4系基因表达量的持续上调来看沙蚕此时仍处于积极防御状态。结果表明沙蚕CYPs参与到了PFOS的解毒代谢中,其中CYP2系基因扮演的角色尤为活跃,与Won等结果一致[26]。
本研究以II相解毒酶的代表GST为研究对象,探究PFOS代谢过程中II相解毒酶的响应情况。GST基因含有多个成员,多齿围沙蚕GST omega基因在镉、铜污染指示中均表现出良好的可行性[44],是多齿围沙蚕极具潜力的分子生物标志物之一[31]。本研究GST酶活性总体上处于被抑制或无显著变化水平,而GST omega基因则受到诱导,与对照组产生显著变化(P<0.01)。但GST酶活性的抑制趋势在胁迫第14天得到恢复,其中4、16 mg·L-1浓度组均显著高于对照水平,而8 mg·L-1浓度处理组也从显著抑制状态恢复到对照水平,这种上调趋势与基因GST omega转录水平的诱导出现较为一致的趋势,在胁迫后期7~14 d显著上升。PFOS暴露后期,GST酶活性和GST omega基因的上调表明PFOS诱导的Ⅱ相解毒是由CYPs基因及酶进行I相解毒反应所诱导,并且在本研究的浓度范围内PFOS胁迫仍可以加速多齿围沙蚕体内各种化学反应形成的亲电子剂的代谢解毒,清除体内形成的氧化还原产物和氧自由基[45]。
PFOS作为外源性物质诱导的氧化应激反应中,多齿围沙蚕I相解毒系统CYP450,II相解毒系统GST的酶和基因在抗氧化防御机制中扮演重要角色。虽然脊椎动物CYPs的多环芳烃受体AhR同系物在无脊椎动物如果蝇和线虫中被鉴定,它们和脊椎动物有相似的二级结构区域,但它们缺少典型的特定高亲和性芳烃受体(AhRs)配体粘合物[46]。Yadetie等[47]也指出被囊类动物CYPs基因参与苯并a芘代谢是受其他核受体的诱导,Zheng等[48]则探究了多毛类以孕烷X受体PXR,核受体CAR为核受体的可能性。PFOS通过干扰多齿围沙蚕CYPs通路受体对机体I相解毒反应系统的触发,以及EROD酶活及2类CYPs基因在诱导初期的快速应答均反映了多齿围沙蚕CYP450参与了PFOS初级代谢,降低PFOS的亲脂性,增加水溶性。随后受到CYPs代谢产物的诱导,II相解毒酶GST也参与了PFOS的代谢,催化极性基团与之共价结合,增加代谢物疏水性以促进PFOS的代谢。目前,仍需探索PFOS胁迫下多齿围沙蚕的核受体。此外,CYPs单氧酶经常催化外源性物质分解成更多的有毒代谢物,这需要联合其他抗氧化机制研究PFOS的致毒机理,并进一步探究多齿围沙蚕对PFOS的代谢机制。
综上所述,本研究探究了多齿围沙蚕I相,II相解毒系统在PFOS诱导产生的氧化损伤中发挥的保护作用。研究结果为PFOS污染预警提供了可参考的标志物,并且为PFOS暴露下CYPs和抗氧化酶及基因所参与的机制研究依提供了依据。
致谢:感谢国家海洋公益性行业科研专项“封闭海湾典型生境物理修复和生物修复的关键技术研究与集成示范”子课题封闭海湾滩涂多毛类修复集成技术研究与示范(201205009-4)对本研究给予的经费支持。
[1] Houde M, Czub G, Small J M, et al. Fractionation and bioaccumulation of perfluorooctane sulfonate (PFOS) isomers in a Lake Ontario food web [J]. Environmental Science & Technology, 2008, 42(24): 9397-9403
[2] Lindstrom A B, Strynar M J, Libelo E L. Polyfluorinated compounds: Past, present, and future [J]. Environmental Science & Technology, 2011, 45(19): 7954-7961
[3] 武晔, 海热提. PFOS的禁用及其处理处置技术[J]. 环境科学与技术, 2011(S1): 352-357
Wu Y, Hai R T. The disabled PFOS and its disposal technology [J]. Environmental Science & Technology, 2011(S1): 352-357 (in Chinese)
[4] Pelley J. Canada moves to eliminate PFOS stain repellents [J]. Environmental Science & Technology, 2004, 38(23): 452A
[5] Thibodeaux J R, Hanson R G, Rogers J M, et al. Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. I: Maternal and prenatal evaluations [J]. Toxicological Sciences, 2003, 74(2): 382-392
[6] Ahrens L, Siebert U, Ebinghaus R. Temporal trends of polyfluoroalkyl compounds in harbor seals (Phoca vitulina) from the German Bight, 1999-2008 [J]. Chemosphere, 2009, 76(2): 151-158
[7] Tomy G T, Budakowski W, Halldorson T, et al. Fluorinated organic compounds in an eastern Arctic marine food web [J]. Environmental Science & Technology, 2004, 38(24): 6475-6481
[8] Martin J W, Smithwick M M, Braune B M, et al. Identification of long-chain perfluorinated acids in biota from the Canadian Arctic [J]. Environmental Science & Technology, 2004, 38(2): 373-380
[9] Gulkowska A, Jiang Q, So M K, et al. Persistent perfluorinated acids in seafood collected from two cities of China [J]. Environmental Science & Technology, 2006, 40(12): 3736-3741
[10] 张新, 刘薇, 金一和. 大连沿海常见海产品PFOS和PFOA的暴露水平调查[J]. 环境科学与技术, 2012(8): 104-106
Zhang X, Liu W, Jin Y H. Investigation of exposure level of PFOS and PFOA in the body of marine animals in Dalian coastal waters [J]. Environmental Science & Technology, 2012(8): 104-106 (in Chinese)
[11] 李飞, 曾庆玲, 沈春花, 等. 上海市市政污水中全氟有机酸污染特征[J]. 中国环境科学, 2012, 32(9): 1602-1612
Li F, Zeng Q L, Shen C H, et al. Pollution profiles of perfluorinaed acids in municipal sewage in Shanghai, China [J]. China Environmenal Science, 2012, 39(9): 1602-1612 (in Chinese)
[12] 任可欣, 阎希柱. 沙蚕在海洋滩涂生境修复中的应用与展望[J]. 水产学杂志, 2013, 26(2): 63-68
Ren K X, Yan X Z. Application and prospect of environmental bioremediation at marine tideflat with nereis [J]. Chinese Journal of Fisheries, 2013, 26(2): 63-68 (in Chinese)
[13] 江小桃, 谭烨辉, 柯志新, 等. 投放双齿围沙蚕和马尾藻对养殖底泥上覆水氮、磷含量的影响[J]. 热带海洋学报, 2012, 31(4): 129-134
Jiang X T, Tan Y H, Ke Z X, et al. Effects of introduction of Perinereis aibuhitensis and Sargassum hemiphyllum on nitrogen and phosphorus in overlying water [J]. Journal of Tropical Oceanography, 2012, 31(4): 129-134 (in Chinese)
[14] Rainbow P S. Biomonitoring of heavy metal availability in the marine environment [J]. Environmental Pollution, 1995, 31(4-12): 183-192
[15] Bergström M, Muhr C, Jossan S, et al. Preliminary data on the bioturbation activity of Hediste diversicolor (Polychaeta, Nereididae) from the Loire Estuary, France [J]. Open Marine Biology Journal, 2012, 6(6): 53-56
[16] 蔡文超, 黄韧, 李建军, 等. 生物标志物在海洋环境污染监测中的应用及特点[J]. 水生态学杂志, 2012, 33(2): 137-146
Cai W C, Huang R, Li J J, et al. Applications and characteristics of biomarkers on monitoring of marine environmental pollution [J]. Journal of Hydroecology, 2012, 33(2): 137-146 (in Chinese)
[17] Binelli A, Ricciardi F, Riva C, et al. New evidences for old biomarkers: Effects of several xenobiotics on EROD and AChE activities in zebra mussel (Dreissena polymorpha) [J]. Chemosphere, 2006, 62(4): 510-519
[18] 王磊, 宋玉芳, 张薇, 等. 蚯蚓(Eisenia fetida)细胞色素P450及抗氧化酶系对环境浓度苯并(a)芘的响应[J]. 农业环境科学学报, 2009, 28(2): 337-342
Wang L, Song Y F, Zhang W, et al. Influence of benzo(a) pyrene on cytochrome P450 and antioxidant enzyme in earthworms (Eisenia fetida) [J]. Journal of Agro-environment Science, 2009, 28(2): 337-342 (in Chinese)
[19] 张玉生, 郑榕辉, 陈清福. 褐菖鲉肝CYP 1A作为生物标志物监测厦门海域石油污染状况[J]. 2011, 31(19): 5851-5859
Zhang Y S, Zheng R H, Chen F Q. A study on application of hepatic microsomal CYP1A biomarkers from Sebastiscus marmoratus to monitoring oil pollution in Xiamen waters [J]. Actaecologica Sinica, 2011, 31(19): 5851-5859 (in Chinese)
[20] Oost R V D, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: A review [J]. Environmental Toxicology & Pharmacology, 2003, 13(2): 57-149
[21] 黎雯, 徐盈, 吴文忠, 等. 鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标[J]. 2000, 24(3): 201-207
Li W, Xu Y, Wu W Z, et al. Introduction of EROD activity in fish liver as a bioindicator for dioxin-link compounds in aquatic system [J]. Actaecologica Hydrobiologica Sinica, 2000, 24(3): 201-207 (in Chinese)
[22] 任加云, 李树峰. 多氯联苯(PCB-1254)对栉孔扇贝消化盲囊和鳃丝EROD、GST酶活力的影响[J]. 中国水产科学, 2008, 15(2): 342-346
Ren J Y, Li S F. Effects of polychlorinated biphenyls 1254 (PCB-1254) on two enzyme activity of biotransformation in digestive gland and gills of scallop Chlamys ferrari [J]. Journal of Fishery Science, 2008, 15(2): 342-346 (in Chinese)
[23] 穆景利, 王新红, 王淑红, 等. 苯并(a)芘影响黑鲷肝脏EROD活性变化的动力学研究[J]. 海洋科学, 2009, 33(1): 68-71
Mu J L, Wang X H, Wang S H, et al. Study on the kinetics of hepatic EROD activities in black porgy (Sparusmacro cephalus) exposed to benzo(a)pyrene [J]. Marine Science, 2009, 33(1): 68-71 (in Chinese)
[24] Li B, Bisgaard H C, Forbes V E. Identification and expression of two novel cytochrome P450 genes, belonging to CYP4 and a new CYP331 family, in the polychaete Capitella capitata sp.I [J]. Biochemical & Biophysical Research Communications, 2004, 325(2): 510-517
[25] Jørgensen A, Rasmussen L J, Andersen O. Characterisation of two novel CYP4 genes from the marine polychaete Nereis virens and their involvement in pyrene hydroxylase activity [J]. Biochemical & Biophysical Research Communications, 2005, 336(3): 890-897
[26] Won E J, Rhee J S, Shin K H, et al. Expression of three novel cytochrome P450 (CYP) and antioxidative genes from the polychaete,Perinereis nuntia exposed to water accommodated fraction (WAF) of Iranian crude oil and benzo[α]pyrene [J]. Marine Environmental Research, 2013, 90(106): 211-223
[27] Zheng S, Chen B, Qiu X, et al. Three novel cytochrome P450 genes identified in the marine polychaete Perinereis nuntia and their transcriptional response to xenobiotics [J]. Aquatic Toxicology, 2013, 134-135C(12): 11-22
[28] 程炜轩, 梁旭方, 李观贵, 等. 鳜鱼两种谷胱甘肽S-转移酶基因cDNA的克隆与分析[J]. 生态毒理学报, 2009, 4(4): 537-543
Cheng W X, Liang X F, Li G G, et al. Molecular cloning and sequence analysis of alpha- and Rho-classes of glutathione S-transterases in Chinese Perch (Siniperca chuatsi) [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 537-543 (in Chinese)
[29] Chen R, Zheng W Y, Yu Q, et al. Effect of oil pollution on gluthione and relative enzyme in oyster (Saccostrea cuculiata) [J]. Acta Oceanologica Sinica, 2003, 22(1): 145-150
[30] Cairrão E, Couderchet M, Soares A M V M, et al. Glutathione- S -transferase activity of Fucus spp. as a biomarker of environmental contamination [J]. Aquatic Toxicology, 2004, 70(4): 277-286
[31] Won E J, Kim R O, Rhee J S, et al. Response of glutathione S -transferase (GST) genes to cadmium exposure in the marine pollution indicator worm, Perinereis nuntia [J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2011, 154(2): 82-92
[32] 姚洪伟, 沈根祥, 朱江, 等. 全氟辛烷磺酸对蚯蚓体内4种酶活性的影响[J]. 环境科学与技术, 2013(4): 5-8
Yao H W, Shen G X, Zhu J, et al. Activity of antioxidant enzymes of PFOS pollution on Eisenia foetida [J]. Environmental Science and Technology, 2013(4): 5-8 (in Chinese)
[33] Hu W, Jones P D, Celius T, et al. Identification of genes responsive to PFOS using gene expression profiling [J]. Environmental Toxicology & Pharmacology, 2005, 19(1): 57-70
[34] Hu W Y, Jones P D, Decoen W, et al. Alterations in cell membrane properties caused by perfluorinated compounds [J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2003, 135(1): 77-88
[35] Nebert D W, David W. Clinical importance of the cytochromes P450 [J]. Lancet, 2002, 360(9340): 1155-1162
[36] Rewitz K, Styrishave B, Andersen O. CYP330A1 and CYP4C39 enzymes in the shore crab Carcinus maenas: Sequence and expression regulation by ecdysteroids and xenobiotics [J]. Biochemical & Biophysical Research Communications, 2003, 310(2): 252-260
[37] Brinkworth L C, Hodson P V. CYP1A induction and blue SAC disease in early developmental stages of rainbow trout (Oncorhynchus mykiss) exposed to retene [J]. Journal of Toxicology & Environmental Health Part A, 2003, 66(7): 627-646
[38] 王贺威. 全氟辛烷磺酸对翡翠贻贝和真鲷抗氧化系统、基因表达以及组织损伤的影响[D]. 上海: 上海海洋大学, 2012: 32
Wang H W. Effects of perfluorooctane sulfonate on antioxidant system, tissues injury and genes expression ofPerna viridis and Pagrosomus major [D]. Shanghai: Shanghai Ocean University, 2012: 32 (in Chinese)
[39] 胡芹. 全氟辛烷磺酸(PFOS)对斑马鱼胚胎发育及成鱼的毒性效应研究[D]. 武汉: 华中农业大学, 2009: 58-62
Hu Q. Embryo developmental and maternal toxicity of perfluorooctane sulfonate (PFOS) in the zebrafish [D]. Wuhan: Central China Agricultural University, 2009: 58-62 (in Chinese)
[40] 赵欢, 赵新达, 岳宗豪, 等. 苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J]. 大连海洋大学学报, 2014(4): 342-346
Zhao H, Zhao X D, Yue Z H, et al. Effects of B(a)P exposure on antioxidant enzyme activity and CYP450 gene expression in sandworm Perinereis aibuhitensis [J]. Journal of Dalian Ocean University, 2014(4): 342-346 (in Chinese)
[41] James M O, Lou Z, Rowland-Faux L, et al. Properties and regional expression of a CYP3A-like protein in channel catfish intestine [J]. Aquatic Toxicology, 2005, 72(4): 361-371
[42] Kurt C K, Kathleen A D. Goldfrank’s Toxicologic Emergencies [M]. McGraw-Hill Medical Publishers, 2010: 173
[43] Skupinska K, Misiewicz I, Kasprzycka-Guttman T. A comparison of the concentration-effect relationships of PAHs on CYP1A induction in HepG2 and Mcf7 cells [J]. Archive Für Toxikologie, 2007, 81(3): 137-149
[44] Won E J, Lee J S, Lee Y M. Combined effects of cadmium and copper on the expression of antioxidant enzyme-coding genes in the polychaete, Perinereis nuntia [J]. Toxicology & Environmental Health Sciences, 2013, 5(1): 26-33
[45] 杨秀芬, 钟正贤, 廖梅春, 等. 蛇葡萄素与苯并芘合用对大鼠肺组织内CYP和GST基因表达的影响[J]. 中国药理学通报, 2010, 25(1):135-136
Yang X F, Zhong Z X, Liao M C, et al. The research development of inflammatory signal pathway of atherosclerosis [J]. Chinese Pharmacological Bulletin, 2010, 25(1):135-136 (in Chinese)
[46] Butler R A, Kelley M L, Powell W H, et al. An aryl hydrocarbon receptor (AHR) homologue from the soft-shell clam, Mya arenaria: Evidence that invertebrate AHR homologues lack 2,3,7,8-tetrachlorodibenzo-p-dioxin and beta-naphthoflavone binding [J]. Gene, 2001, 278(1-2): 223-234
[47] Yadetie F, Butcher S, Førde H E, et al. Conservation and divergence of chemical defense system in the tunicate Oikopleura dioica revealed by genome wide response to two xenobiotics [J]. BMC Genomics, 2012, 13(2): 151-157
[48] Zheng S, Qiu X, Chen B, et al. Toxicity evaluation of benzo[a]pyrene on the polychaete Perinereis nuntia using subtractive cDNA libraries [J]. Aquatic Toxicology, 2011, 105(3-4): 279-291
◆
Effects of PFOS on the Genes Transcription and Enzymes Activity of CYPs, GST in PolychaetePerinereisnuntia
Chen Xi1,2, Yan Xizhu1,2,*, Su Lili1,2
1. Jimei University, Xiamen 361021, China 2. Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture, P. R. China, Xiamen 361021, China
Received 13 April 2016 accepted 18 May 2016
Polychaete has been widely used to monitor the environmental pollution. Perfluorooctane sulfonate (PFOS) is an emerging persistent organic pollutant that has global distribution. However, the effect of PFOS on the dominant species of polychaete, nereis, has received little attention. To research its potential biomarkers for PFOS pollution, this paper studied the combine response of genes transcription and enzymes activity of cytochrome P450 (CYP), glutathione S-transferase (GST) in nereis, Perinereis nuntia. The sandworms were exposed to sublethal concentrations of PFOS (4, 8, 16 mg·L-1) for 1, 4, 7, 14 days and recovered for 5 days, respectively. The PFOS-induced inhibition of EROD showed a time-dependent relationship clearly. The P. nuntia CYP431A1 (CYP2 clan) mRNA was sensitively expressed to PFOS exposure with a clear dose-dependent relationship and showed the highest inducibility on day 14. The transcription levels of CYP424A1, a CYP4 clan gene, in 4 and 8 mg·L-1treatments were all positively correlated with the PFOS exposure time. As one of phase II detoxification enzymes, the GST enzyme and GST omega gene both decreased first and upregulated then with the extension of PFOS exposure. P. nuntia could still accelerate metabolism under the serious exposure and showed its tolerance for PFOS. During recovery period, all the observed indexes showed a tendency to recover to the control level. In conclusion, the response of gene transcription and enzyme activity showed that CYPs and GST of P. nuntia played important roles in the PFOS detoxification and these indexes of P. nuntia would have great potentials as biomarkers to detect the PFOS pollution in marine intertidal zone.
PFOS; Perinereis nuntia; oxidative stress; cytochrome P450; glutathione S-transferase
海洋公益性行业科研专项(201205009-4)
陈西(1991-),女,硕士,研究方向为水域生态毒理学,E-mail: 1361158525@qq.com;
*通讯作者(Corresponding author), E-mail: xzyan@jmu.edu.cn
10.7524/AJE.1673-5897.20160413001
2016-04-13 录用日期:2016-05-18
1673-5897(2016)6-102-10
X171.5
A
阎希柱(1965-),男,博士,教授,主要研究方向水产养殖生态学。
陈西, 阎希柱, 宿丽丽. PFOS对多齿围沙蚕CYPs、GST基因转录及酶活性的毒性效应[J]. 生态毒理学报,2016, 11(6): 102-111
Chen X, Yan X Z, Su L L. Effects of PFOS on the genes transcription and enzymes activity of CYPs, GST in polychaete Perinereis nuntia [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 102-111 (in Chinese)

