α1-肾上腺素受体在前列腺Cajal间质细胞上的表达及意义
马路平,王勤章,王江平,钱彪,李应龙,李强,倪钊,王新敏
α1-肾上腺素受体在前列腺Cajal间质细胞上的表达及意义
马路平,王勤章△,王江平,钱彪,李应龙,李强,倪钊,王新敏
摘要:目的观察α1-肾上腺素受体在豚鼠前列腺Cajal间质细胞(ICCs)上的表达,并探讨其生理意义。方法取豚鼠前列腺组织冰冻切片以及体外培养的豚鼠前列腺细胞,使用c-Kit标记ICCs,α肌动蛋白(α-actin)标记平滑肌细胞,分别进行c-Kit与α1-肾上腺素受体、α-actin与α1-肾上腺素受体配对的免疫荧光双标记染色。结果豚鼠前列腺组织及分离培养的c-Kit阳性ICCs细胞膜和细胞浆中均表达α1肾上腺素受体,同时α-actin阳性平滑肌细胞上也有α1-肾上腺素受体表达,但在组织切片中ICCs上α1肾上腺素受体的表达显著强于平滑肌细胞。结论表达α1-肾上腺素受体的前列腺ICCs作为交感神经的功能靶细胞在前列腺平滑肌活动调控中可能发挥重要的作用。
关键词:Cajal间质细胞;α1-肾上腺素受体;交感神经;前列腺;豚鼠
前列腺平滑肌的异常兴奋致前列腺内的压力升高会不同程度地破坏排尿、生殖等生理功能。传统的观点认为交感神经神经纤维通过释放神经递质作用于平滑肌,从而调节平滑肌的活动,即形成“神经-平滑肌”功能单位[1]。本课题组前期研究发现,前列腺中一种特殊的Cajal间质细胞(interstitial cells of Cajal, ICCs)与前列腺交感神经及平滑肌存在密切的形态联系[2],在电镜下可见前列腺内神经末梢与ICCs之间存在突触样连接,推测可能存在“神经-ICCs-平滑肌”功能单位,ICCs在其中发挥介导交感神经信号、调节平滑肌兴奋性的作用[3]。在前列腺中,平滑肌的收缩主要依赖于交感神经支配的α1-肾上腺素受体[4-5]。那么作为交感神经末梢对应的突触后膜,前列腺ICCs上是否存在α1-肾上腺素受体,从而通过α1-肾上腺素受体调节平滑肌的收缩呢?目前尚缺乏明确证据。本研究旨在探讨α1-肾上腺素受体在前列腺ICCs上的表达及意义。
1 材料与方法
1.1材料2月龄荷兰种普通级雄性豚鼠30只,体质量300~400 g,购自新疆医科大学动物实验中心。青链霉素、胰蛋白酶(HyClone公司),胶原酶V、PBS(Sigma公司),胎牛血清(Biological Industries),DMEM(Gibco公司),干细胞刺激因子(SCF)、6孔板、细胞爬片、无钙Hank′s溶液(Boster公司),水合氯醛、丙酮、大鼠抗c-Kit抗体(Millipore,美国),兔抗α1-肾上腺素受体抗体(Abcam,美国),小鼠抗α肌动蛋白(α-ac⁃tin)抗体(Santa Cruz,美国),FITC标记的山羊抗大鼠抗体、FITC标记的山羊抗小鼠抗体、TRITC标记的山羊抗兔抗体(北京中杉金桥)。超净台(AIR TECH),培养箱(Thermo),离心机(上海安亭科学仪器厂),倒置显微镜(OLYMPUS),激光共聚焦显微镜(ZEISS)。
1.2方法
1.2.1豚鼠前列腺标本取材水合氯醛(0.3mL/100 g)腹腔注射,麻醉豚鼠至尿道括约肌松弛排空尿液。将豚鼠固定至操作台上,组织剪沿下腹正中切口依次剪开皮肤、皮下、腹膜、耻骨联合,将阴茎提起,沿阴茎背侧仔细游离阴茎、后尿道直至充分暴露前列腺背侧叶,沿膀胱颈顺行快速仔细游离前列腺,避免损伤膀胱及后尿道,以免污染前列腺组织。
1.2.2组织免疫荧光双重标记取新鲜豚鼠前列腺标本,经OTC包埋,采用恒冷冰冻切片机切片,厚度均为20 μm。将切片置于4℃冷丙酮中固定15min;0.03%医用双氧水封闭内源性过氧化物酶20min;10%胎牛血清封闭60min,弃去封闭液;将上述组织切片分为2组,分别加入大鼠抗c-Kit (1∶200)和兔抗α1-肾上腺素受体抗体(1∶200)、兔抗α1-肾上腺素受体抗体(1∶200)和小鼠抗α-actin抗体(1∶100)的混合液,4℃孵育过夜(12~20h);再次分别加入FITC标记的山羊抗大鼠抗体(1∶100)和TRITC标记的山羊抗兔抗体(1∶100)、FITC标记的山羊抗小鼠抗体(1∶100)和TRITC标记的山羊抗兔抗体(1∶100);以上各步骤间均1×PBS漂洗3×5min。甘油封片后放置于激光共聚焦显微镜下观察拍照。FITC激发波长为488 nm,TRITC激发波长为543 nm,所有拍摄图片均用Zeiss LSM进行处理。
1.2.3豚鼠前列腺ICCs体外培养取豚鼠前列腺组织,将组织置于1×PBS中清洗2遍,眼科剪迅速将新鲜前列腺组织剪成1mm3大小组织块,将组织块置于无钙Hank′s溶液浸泡15min,倾弃无钙Hank′s液,加入胰蛋白酶,37℃温箱消化30min。离心5min (1 000 r/min),弃上清,加入37℃含1 g/L胶原酶V的无钙的Hank′s溶液中消化50min,加入含10%胎牛血清DMEM液终止消化(1∶2),过滤、离心后将细胞种植于已放置细胞爬片的6孔板中,每孔含有50 μg/L SCF、15%胎牛血清、1%双抗的DMEM 2mL。将6孔板移至37℃、5%CO2培养箱中培养24h,换液,将未贴壁的平滑肌细胞及杂质去除,其余贴壁细胞继续培养,每间隔24~36h换液1次,并置于倒置显微镜下观察,直至可清晰看见纺锤形或星形ICCs。
1.2.4细胞免疫荧光双重标记将上述培养的细胞爬片取出,将其分为2组,分别加入大鼠抗c-Kit(1∶200)和兔抗α1-肾上腺素受体抗体(1∶200)、兔抗α1-肾上腺素受体抗体(1∶200)和小鼠抗α-actin抗体(1∶100)的混合液,4℃孵育过夜(12~20h);再次分别加入FITC标记的山羊抗大鼠抗体(1∶100)和TRITC标记的山羊抗兔抗体(1∶100)、FITC标记的山羊抗小鼠抗体(1∶100)和TRITC标记的山羊抗兔抗体(1∶100);具体步骤同1.2.2。甘油封片后放置于激光共聚焦显微镜下观察拍照。
2 结果
2.1组织免疫荧光双重标记c-Kit与α1-肾上腺素受体在ICCs上染色均阳性,且ICCs上α1-肾上腺素受体染色明显较平滑肌中染色深,平滑肌细胞α1-肾上腺素受体染色阳性,见图1。
2.2细胞免疫荧光双重标记倒置显微镜下可见体外培养的豚鼠前列腺ICCs较前列腺平滑肌细胞小,呈纺锤形或星形,细胞周围有多个突起,细胞借突起呈网状分布或与平滑肌连接,具有消化道、膀胱、阴茎海绵体ICCs的典型形态,见图2;共聚焦显微镜下可见c-Kit与α1-肾上腺素受体在体外培养的ICCs上染色阳性,见图3;α1-肾上腺素受体与αactin在体外培养的豚鼠前列腺平滑肌细胞上染色阳性,见图4。
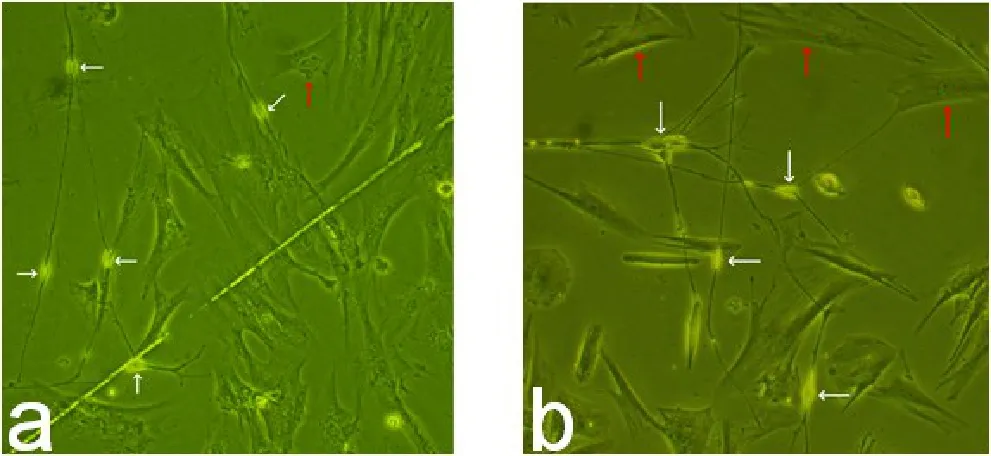
Fig.2 Cultured ICCs (white arrows) and smoothmuscle cells (red arrows) from guinea pig prostate under invertedmicroscope(×200)图2 倒置显微镜豚鼠前列腺ICCs(白色箭头)与平滑肌(红色箭头)的混合培养(×200)
3 讨论
继在胃肠道发现ICCs之后,研究发现在人及豚鼠的前列腺中也存在一种形态和功能类似的细胞,称之为前列腺ICCs[6-8]。本实验通过体外培养和细胞切片所得的前列腺ICCs,在倒置显微镜及激光共聚焦显微镜下观察可见其形态呈纺锤形,分布于平滑肌之间,细胞核明显,细胞借周围较长的突起与ICCs或平滑肌细胞连接,呈网状分布,与典型的ICCs形态及分布情况一致[8]。目前鉴定ICCs的金标准为c-Kit抗体[9]。本实验所培养的前列腺细胞经c-Kit抗体染色呈阳性,可明确为前列腺ICCs,为本实验奠定了坚实可靠的基础。
在胃肠道中,交感神经末梢与ICCs之间依靠突触样连接传递神经信号,ICCs与平滑肌之间依靠缝隙连接传递神经信号,ICCs以此作为交感神经与平滑肌的信号中转站,调控平滑肌的活动,即形成“神经-ICCs-平滑肌”功能单位[10-13]。本实验前期电镜结果发现,前列腺中ICCs和交感神经末梢也存在典型突触样连接[4],ICCs上存在大量缝隙连接蛋白CX43,并与平滑肌连接紧密[3],故笔者认为在前列腺中也可能存在“神经-ICCs-平滑肌”功能原件。
去甲肾上腺素(NE)是前列腺组织中主要的兴奋性神经递质,在前列腺中,NE主要依赖α1-肾上腺素受体的作用来诱发前列腺平滑肌收缩[4-5]。本实验通过组织免疫荧光染色及细胞免疫荧光染色两个不同层面发现前列腺ICCs细胞膜上可以表达α1-肾上腺素受体,提示ICCs是交感神经的靶细胞,结合一般形态和电镜结果以及α1-肾上腺素受体在前列腺上的功能,说明ICCs通过α1肾上腺素受体接受交感神经信号调控“神经-ICCs-平滑肌”功能原件,从而调控前列腺平滑肌的活动。
此外,本课题组前期研究显示,交感神经末梢与ICCs的距离明显小于交感神经末梢与平滑肌之间的距离[4]。结合本实验发现在ICCs上α1-肾上腺素受体表达明显高于平滑肌这一结果,笔者认为前列腺中“交感神经-ICCs-平滑肌”这一功能单位通过突触连接与缝隙连接串联形式传递神经信号较“交感神经-平滑肌”传递神经信号快,参与平滑肌张力的快速调节,即有可能参与调节射精过程,而“交感神经-平滑肌”这一功能单位通过相对较慢的神经信号传递参与平滑肌张力的慢速调节,可能与维持后尿道压力及控尿机制有关,具体机制及证据有待进一步研究。
(图1、3、4见插页)
参考文献
[1]mottet N, Costa P, Bali JP.Autonomic nervous system and prostatic physiology.Specific features of the alpha- adrenergic system[J].Prog Urol, 1999, 9(3):26-36.
[2] Wang JP, Ding GF, Wang QZ, et al.Morphological and functional relationships among interstitial cells of Cajal, sympathetic nerves and smoothmuscle in the guinea pig prostate[J].Chinese Journal of Neuroanatomy, 2014, 30 (1) :23-28.[王江平,丁国富,王勤章,等.豚鼠前列腺Cajal间质细胞与交感神经及平滑肌的形态与功能学联系[J].神经解剖学杂志,2014, 30(1):23- 28].doi:10.1007/s00441-013-1572-3.
[3] Wang JP, Ding GF, Wang QZ.Interstitial cells of Cajalmediate ex⁃citatory sympathetic neurotransmission in guinea pig prostate[J].Cells Tissue Res, 2013, 352(3):497- 486.doi: 10.1007/s00441-013-1572-3.
[4]huang B, Wang JP, Wang QZ.Ultrastructural characteristics and possible function of the interstitial cells of Cajal in guinea pig pros⁃tate[J].Chinese Journal of Neuroanatomy,2015,27(4):413-416.[黄冰,王江平,王勤章.豚鼠前列腺Cajal间质细胞的超微结构特点及功能学联系[J].神经解剖学杂志,2015,27(4):413-416].doi:10.16557/J.cnki.1000-7547.2015.04.006.
[5] Palea S,maiga A, Guilloteau V, et al.Effects of ρ-Da1a a peptidic α (1) (A) -adrenoceptor antagonist inhuman isolated prostatic adeno⁃ma and anaesthetized rats[J].Br J Pharmacol, 2013,168(3):618-631.doi:10.1111/j.1476-5381.2012.02231.x.
[6] Shafik A, Shafik I, el-Sibai O.Identification of c-Kit-positive cells in thehuman prostate: the interstitial cells of Cajal[J].Arch Androl, 2005, 51(5): 345-351.
[7] Nguyen DT, Dey A, Lang RJ, et al.Contractility and pacemaker cells in the prostate gland[J].J Urol, 2011, 185(1): 347-351.
[8] Van der Aa F, Roskams T, Blyweert W, et al.Interstitial cells in thehuman prostate: a new therapeutic targetc-Kit [J].Prostate, 2003, 56(4):250-255.
[9] Komuro T, Seki K,horiguchi K.Ultrastructural characterization of the interstitial cells of Cajal[J].Archhistol Cytol, 1999, 62(4):295-316.
[10]horiguchi K, Sanders KM, Ward SM.Entericmotor neurons form synaptic-like junctions with interstitial cells of Cajal in the canine gastric antrum[J].Cell Tissue Res, 2003, 311(3):299-313.
[11] Beckett EA, Takeda Y, Yanaseh, et al.Synaptic specializations ex⁃ist between entericmotor nerves and interstitial cells of Cajal in themurine stomach[J].J Comp Neurol, 2005, 493(2):193-206.
[12] Popescu LM, Gherghiceanum, Cretoiu D, et al.The connective con⁃nection: interstitial cells of Cajal (ICC) and ICC-like cells establish synapses with immunoreactive cells.Electronmicroscope study in situ[J].J Cellmolmed, 2005, 9(3):714-730.
[13] Seki K, Komuro T.Immunocytochemical demonstration of the gap junction proteins connexin 43 and connexin 45 in themusculature of the rat small intestine[J].Cell Tissue Res, 2001, 306(3):417-422.
(2015-08-11收稿2015-08-26修回)
(本文编辑陈丽洁)
The expression and significance of α1-adrenoceptor in the interstitial cells of Cajal
MA Luping, WANG Qinzhang△, WANG Jiangping, QIAN Biao, LI Yinglong, LI Qiang, NI Zhao, WANG Xinmin
Department of Urology, the First Affiliatedhospital of Shihezi University, Shihezi 832000, China
△Corresponding Author E-mail:wqz1969@sina.com
Abstract:Objective To observe the expression of α1-adrenoceptor in the interstitial cells of Cajal in guinea pig pros⁃tate, and explore it,s possible physiological function.Methods The guinea pig prostate slices and cells were cultured.c-Kit was used to distinguish ICCs,and α-actin was used to label smoothmuscle cells.c-kit and α-actin were respectively dou⁃ble- labeld with α1-adrenoceptor immunohistochemistry.Results Immunohistochemistry showed that c-kit and α1-adre⁃noceptor were coexpressed in ICCs of c-kit positive guinea pig prostate slices.And α1-adrenoceptor was expressed in α-ac⁃tin positive smoothmuscle cells.The α1-adrenoceptor wasmorehighly expressed in ICCs than that around smoothmuscle cells in guinea pig prostate slices.ConclusionThe ICCs that express α1-adrenoceptor are the target cells of sympathetic nerve andmight play an important role in adjusting the activity of smoothmuscle cells in guinea pig prostate.
Key words:interstitial cells of Cajal;α1-adrenoceptor; sympathetic nerve; prostate; guinea pig
通讯作者△E-mail:wqz1969@sina.com
作者简介:马路平(1986),男,硕士在读,主要从事泌尿外科学的临床研究
基金项目:国家自然科学基金资助项目(81360120);石河子大学优秀青年-联合资助项目(2013ZRKXYQ-YD15)
中图分类号:R329
文献标志码:A
DOI:10.11958/20150094
作者单位:石河子大学第一附属医院泌尿外科(邮编832000)

