动物胰蛋白酶的纯化、性质及其固定化研究进展
王卿惠,徐兴军,邵淑丽,田金波,张伟伟,王有祥,薛明强
(齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006)
动物胰蛋白酶的纯化、性质及其固定化研究进展
王卿惠,徐兴军,邵淑丽,田金波,张伟伟,王有祥,薛明强
(齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006)
根据近年国内外胰蛋白酶最新研究报道,综述了动物胰蛋白酶的研究进展,包括酶的纯化、特性以及酶的固定化,以期为胰腺蛋白酶的研究、开发和利用提供一定的参考.
动物;胰蛋白酶;纯化;固定化
胰蛋白酶(trypsin,EC3.4.21.4)广泛应用于轻工业、医药工业、食品加工业、畜牧业和现代生物技术等领域,日益成为研究热点.作为丝氨酸蛋白酶家族的成员之一,胰蛋白酶激活前常以酶原前体形式存在.胰蛋白酶原前体[1]含有一段由15个氨基酸组成的信号肽序列和一个由6~8个氨基酸组成的激活肽(TAP)序列.若信号肽序列被结合于内质网膜上的信号肽酶切除,则胰蛋白酶原前体转变成胰蛋白酶原;若其中的激活肽序列再被肠肽酶水解掉,最后转变为具有活性的胰蛋白酶.胰蛋白酶属于内肽酶,主要水解Arg或Lys赖氨酸羧基端的具有高度专一性的肽键.胰蛋白酶具有“双重”作用,它不仅可以消化普通蛋白质,还可以激活胰腺分泌的其它酶原[2],在蛋白质水解方面发挥重要的作用.大多数脊椎动物体内的胰蛋白酶以上述形式被活化,而对于在无脊椎动物(如昆虫及甲壳动物),其激活机制可能是“自我活化”[3].但Buettner K[4]研究发现,人类胰蛋白酶原的激活也存在“自我活化”现象.
1 胰蛋白酶活性测定
1.1 胰蛋白酶催化特点
胰蛋白酶一般存在于高等动物胰液和低等动物胃液中,也广泛存在于鸟类的肝脏、胰腺和肠道内.其催化特点为:(1)无需提供能量;(2)有高度的专一性;(3)底物与酶的活性中心结合是可逆的,这种结合使得蛋白质特定肽键因弯曲变形更易于受到水分子攻击.
1.2 胰蛋白酶活性测定
由于胰蛋白酶不仅能催化由碱性氨基酸(Arg,Lys)的羧基与其它氨基酸的氨基形成的肽键,还能催化由碱性氨基酸的羧基形成的酰胺键或酯键.因此,若以含有这些键的酰胺或酯类化合物作为底物,便可通过测定产物的变化来测定胰蛋白酶的活力.目前常用的底物包括苯甲酰-L-精氨酸-对硝基苯胺(BAPA,NAPNA)、苯甲酰-L-精氨酸-β-萘酰胺(BANA)、苯甲酰-L-精氨酸乙酯(BAEE)以及对甲苯磺酰-L-精氨酸甲酯(TAME).以BAEE为底物,在253 nm下测定反应产物的吸光值变化,一般吸光值每升高0.001即为一个胰蛋白酶酶活单位(1 μmol/min).张东裔[5]等选用TAME作为底物,由于该底物受胰蛋白酶作用后转变成对甲苯磺酞基精氨酸,使反应混合物的pH值下降;以酚红为指示剂,通过测定555 nm处光吸收值降低来监测pH值变化,在0.001~0.3 μg范围内,胰蛋白酶含量与光吸收值降低呈线性关系,从而可以用光吸收值降低值表示胰蛋白酶的相对酶活力.朱忠胜[6]等对菲牛蛭(Poecilobdella)不同生长阶段幼体组、亚成体和成体组及摄食前后的消化酶活性进行了测定,发现亚成体组胰蛋白酶活力最强.甘丽萍[7]等调查家蚕幼虫(Bombyx mori)胰蛋白酶活性,探讨了其与丝氨酸蛋白酶基因表达之间的关系.张建萍[8]等采用紫外线吸收法测定了塔里木兔(Lepus yarcandensis)和家兔(Oryctolagus curiculus)胰蛋白酶活力.结果表明,家兔胰腺和肠道胰蛋白酶活性高于塔里木兔.可见,胰蛋白酶活性的有效测定为研究动物生理和酶基因表达提供了前提条件.
福林酚试剂[9]在碱性条件下可以被酚类化合物还原为蓝色物质(钼蓝和钨蓝混合物),由于蛋白质含酚基氨基酸,因此可以利用此原理测定蛋白酶活力.
Dong M[10]最新采用7肽(CRRRRRR)底物建立一个简单敏感的胰蛋白酶测定的电化学方法.在方波内金属钌电极的伏安电流增加与胰蛋白酶活性在0.004 7~0.052 0 μmol/min/mL范围内成线性关系.可见,测定胰蛋白酶的关键是选择合适的底物,然后用胰蛋白酶催化,找出产物的变化规律与胰蛋白酶活性的相关性,用产物或产物引起的直接能测定的参数变化来表示胰蛋白酶的活性.
2 胰蛋白酶提取、纯化和酶学性质研究
2.1 胰蛋白酶提取
从动物胰脏中分离、提取胰蛋白酶时,一般需几个连续的步骤:(1)用稀酸将酶原从胰腺细胞中抽提出来;(2)调节pH值至等电点,去除酸性杂蛋白;(3)硫酸铵分级沉淀胰蛋白酶原;(4)酶原用极少量活性胰蛋白酶激活;(5)再次盐析除去糜蛋白酶及弹性蛋白酶;(6)收集胰蛋白酶组分获得粗品.
2.2 胰蛋白酶纯化
动物胰蛋白酶纯化方法改进的几个实例见表1.

表1 动物胰蛋白酶纯化方法改进的几个实例
由表1可见,为了获得更纯的酶,一般需要过色谱柱.在纯化胰蛋白酶时,可以先活化后层析;也可以先层析后活化[11]41-42.为避免糜蛋白酶等非特异性酶切,常需要对胰蛋白酶进行修饰[12].
表1在纯化猪胰蛋白酶时使用了反相层析.所谓正相和反相主要是由固定相和流动相极性大小决定的.正相柱的固定相极性大于流动相,反相柱则相反.因此,正相柱是极性小的先出峰,反相柱是极性大的先出峰[13]79-80.DEAE-纤维素柱层析属于阴离子交换层析,一般分离时碱性蛋白先出峰,酸性蛋白后出峰.苯甲脒类物质是胰蛋白酶的广谱抑制剂,苯甲脒类可以先偶联到琼脂糖凝胶6B上,然后对胰蛋白酶样品进行纯化.该方法流速高,非特异吸附少,填料粒度均匀,分离效果好,是纯化胰蛋白酶最适合的填料[14]3-8.另外采用先凝胶过滤后离子交换方法的顺序效果也很好[15]126-132.
2.3 胰蛋白酶的酶学性质
胰蛋白酶纯化方法的改进有重要意义,高纯度胰蛋白酶的获得是研究其酶学性质的关键.几种鱼类胰蛋白酶的纯化、性质及催化动力学研究见表2.比较Khangembam[14]8-12和Liu Chun-Hung[16]839-841研究的胰蛋白酶纯化结果可以发现,纯化的倍数越高,得率越小.因此,高纯度酶的获得是以“牺牲”胰蛋白酶为代价的.
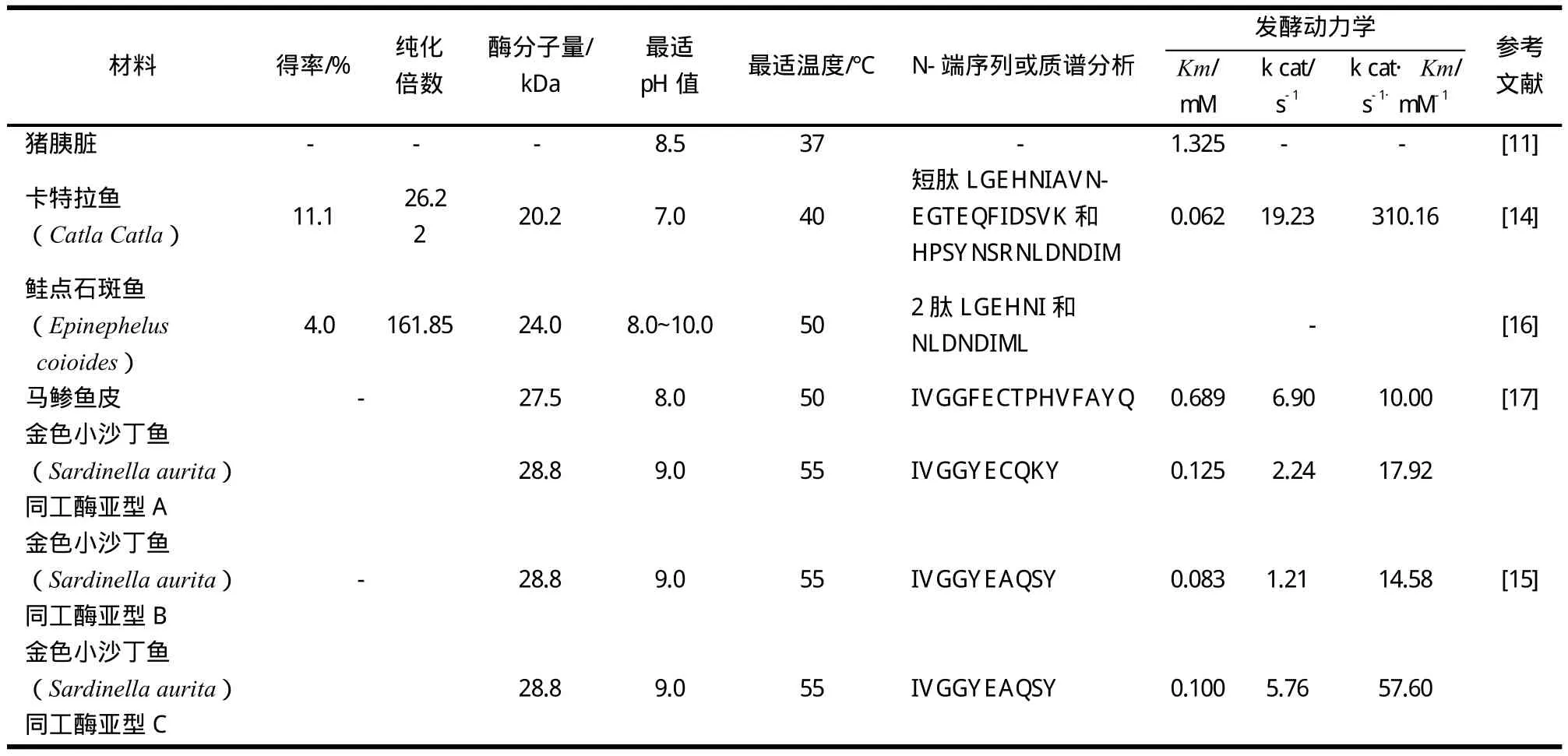
表2 几种鱼类的胰蛋白酶的纯化、性质及催化动力学研究
水产鱼类中胰蛋白酶分子量范围一般在20~30 kDa之间.根据文献[18]报道,2种不同鳕鱼(Gadus macrocephalus和Eleginus gracilis)的胰蛋白酶分子量均为24 kDa,与鲑点石斑鱼的胰蛋白酶分子量一致.陈荣昌[19]等纯化的2种青鱼分子量分别为44 kD和43.5 kD.研究发现,EDTA对青鱼胰蛋白酶的抑制作用很大,推测该酶可能为金属蛋白酶.对于哺乳动物而言,胰蛋白酶分子量大小也在20~30 kDa范围内,如牛胰蛋白酶分子量为23.3 kDa,猪胰蛋白酶为24.0 kDa[20].相比之下,鸟类胰蛋白酶的分子量可能要大一些,如岑亮[21]等从鸭肝中获得的胰蛋白酶相对分子量为35 kDa.
一般哺乳动物胰蛋白酶的最适温度接近体温,如丁凌霄[11]等研究的猪胰脏酶最适温度为37 ℃.然而鱼类的最适温度比较高,在40~55 ℃之间.吴志强[22]研究表明,日本新糠虾蛋胰蛋白酶最适反应温度为37 ℃,接近哺乳动物胰蛋白酶的最适温度.鱼类的最适pH值为7~10之间.但哺乳动物胰蛋白酶pI一般为8.0~9.0,属于碱性蛋白酶;鱼类胰蛋白酶的pI为4.5~6,属于酸性蛋白酶.虾类胰蛋白酶的pH值为2~6,酸性更加明显.
在使用SDS-PAGE电泳对获得的胰蛋白酶纯品进行初步验证的基础上,一般需要进一步采用埃德曼反应(Adman reaction)对蛋白质的N-端进行测序,从而更准确地通过比对(blast)来鉴定所得胰蛋白酶与其它胰蛋白酶的亲源关系.也可以对蛋白质样品作质谱(MS)分析,通过获得“小肽片段”对纯化的胰蛋白酶加以鉴定.
从表2中可知,大多数胰蛋白酶的蛋白质N-段都存在IVGG 4个氨基酸高度保守的序列,这可以作为鉴定胰蛋白酶的特异标记序列.根据文献[14]报道,填加2 mM CaCl2保温8 h能提高胰蛋白酶活力,可见Ca2+对胰蛋白酶有稳定作用.Liu Chun-Hung[16]842-846等使用BAEE为底物,发现胰蛋白酶活性随NaCl浓度(0~0.6 M)的增加而减小.Khaled[15]125-127使用BAPNA为底物,研究了金色小沙丁鱼胰蛋白酶的动力学.不同酶的Km值不同,同一种酶与不同底物反应Km值也不同.因此,在计算Km值时,要考虑到所选择的底物.Km值可近似反映出酶与底物亲和力的大小:Km值越大,表明酶与底物的亲和力越小.结合表2可知,卡特拉鱼(Catla Catla)胰蛋白酶对底物的亲合最大(Km=0.062).对于金色小沙丁鱼(Sardinella aurita)的胰蛋白酶而言,尽管有3种同工酶亚型A,B,C,而且分子量、最适pH值和温度都相同,但N-端氨基酸序列和动力学参数皆不相同,说明3种酶的催化效率不同.这可能是3种酶细微的氨基酸序列或种类不同所至.总之,在研究胰蛋白酶的酶学性质时,不仅要研究酶的分子量、最适温度、最适pH值以及酶的动力学参数变化,也要对酶的一级结构进行分析,从而研究酶的构效关系.
2.4 影响胰蛋白酶活性的因素
不同金属离子以及不同的理化处理可以改变胰蛋白酶的结构和催化性质.
2.4.1 重金属离子对胰蛋白酶的影响 金属离子(如Cd2+,Al3+,Zn2+,Cu2+,Pb2+,Hg2+)可能是胰蛋白酶的抑制剂.研究金属离子对酶的影响可使用多种技术和方法:(1)同步扫描荧光光谱技术(SFS);(2)紫外可见吸收;(3)圆二色(CD)光谱法;(4)等温滴定量热法(ITC);(5)酶活试验等.Zhang Tong[9]1805-1807等调查了Cu2+,Pb2+,Zn2+等离子对胰蛋白酶毒性产生的原因.研究发现,重金属的毒性效应应归于本身的特性而非所带有的电荷.Zn2+对胰蛋白酶没有明显影响;Cu2+和Pb2+直接损伤酶的结构和功能;Cu2+能够和胰蛋白酶结合,从而导致胰蛋白酶的荧光淬灭并使其疏水性增加;高浓度的Pb2+也能改变胰蛋白酶的结构,减少胰蛋白酶的活性.同时发现,对胰蛋白酶活性的影响按Cu2+>Pb2+>Zn2+的顺序逐渐减弱.等温滴定量热学分析表明,这些重金属离子与胰蛋白酶之间的相互作用是自发的和放热的,说明它们对胰蛋白酶具有抑制作用.
2.4.2 物理因素对胰蛋白酶的影响及原因 采用超高压技术处理胰蛋白酶可以改变其空间结构,从而可以研究酶空间结构变化与酶活力之间的关系.对胰蛋白酶二级结构变化的观察可以采用傅立叶红外光谱;对其三级结构的变化研究可以采用荧光光谱;测定酶活性的变化可以使用福林酚法.刘平[23]等对超高压(100~600 MPa)处理后的胰蛋白酶进行了研究.结果发现,与未处理的相比,超高压对胰蛋白酶活力影响显著.通过300 MPa处理,胰蛋白酶活力提高了0.386倍.此时胰蛋白酶的α-螺旋与β-转角的峰面积比值达到最大,荧光强度达到最高.超声波对胰蛋白酶也有影响.黄卓烈[24]等研究发现,超声波处理使胰蛋白酶活力普遍升高,Km值变小,Vmax值也降低,酶对底物的亲和力增大.
2.4.3 化学因素对胰蛋白酶的影响 张国文[25]等研究发现,邻苯二甲酸二丁酯(DBP)通过氢键和范德华力与胰蛋白酶形成基态复合物而淬灭胰蛋白酶的内源荧光.DBP与胰蛋白酶的结合使酶的α-螺旋、β-折叠和β-转角含量减少,使无规卷曲的含量增加,从而使蛋白质聚集.分子模拟结果表明,DBP结合于胰蛋白酶S1疏水空腔附近,与氨基酸His57,Ser195和Gly193形成氢键,从而抑制了胰蛋白酶活性.吐温(或聚山梨酯)为非离子型表面活性剂,是一系列聚氧乙烯去水山梨醇的部分脂肪酸酯.宋九华[26]等通过紫外和荧光光谱法研究了吐温与牛胰蛋白酶之间的相互作用.研究发现,吐温与牛胰蛋白酶主要表现为疏水作用力,对牛胰蛋白酶活性影响较少.但它们之间的相互作用能改变牛胰蛋白酶分子中的芳香族氨基酸残基在酶空间结构中所处的微环境,使微环境的疏水性增强.吐温对牛胰蛋白酶荧光淬灭效应起因于牛胰蛋白酶与吐温形成了复合物,能量转移作用较小,属于静态淬灭.
3 胰蛋白酶的固定化研究
由于液相胰蛋白酶存在严重自溶、解折叠作用,限制了胰蛋白酶在生产上的直接应用.而酶固定化技术能使胰蛋白酶稳定性增加并可重复利用,从而为胰蛋白酶在生产上更广泛地应用开辟了道路.固定化酶就是采用理化方法,使酶与载体结合或把酶包埋在其中,形成凝胶或半透膜微囊体.固定化酶的制备方法有物理法和化学法两大类,前者包括物理吸附法和包埋法等.安红[27]等采用吸附法对胰蛋白酶在磁性核壳介孔分子筛(Fe3O4·MCM-41)上的固定化进行了研究,发现与游离酶相比,固定化酶的耐温区间和pH值适应范围明显变宽,载体能保持良好介孔结构.孙俊[28]等通过静电相互作用,将胰蛋白酶固定于羧甲基壳聚糖磁性纳米颗粒(Fe3O4(PEG+CM-CTS))表面.结果表明,纳米颗粒对胰蛋白酶的吸附符合Langmuir等温吸附模型,载体对胰蛋白酶的最大固载量达117.6 mg/g,剩余的相对酶活性高达87.9%.固定化酶具有良好的操作稳定性和较高的储藏稳定性.Maciel[29]经Fe3+共沉淀以及采用聚苯胺将胰蛋白酶包裹合成磁性纳米颗粒,平均直径大约15 nm,以相对高自发磁化方式表现出磁化行为,主要以磁赤铁矿(γFe2O3)形式存在.固定化胰蛋白酶活性进一步提高,达到为原始活性的89%.化学法包括结合法和交联法,结合法又分为离子结合法和共价结合法.阮贵华[30]等以多孔介质材料Fe3O4·mSiO2·nSiO2为载体,采用γ-氨丙基三乙氧基硅烷接枝和戊二醛交联方法对胰蛋白酶进行了固定化.研究表明,φ(戊二醛)=1.875%,给酶量为0.3 mg/mL,反应时间为4 h时酶的固定化效率可达50.5%,酶保留了77.3%的活性.Song X[31]使用静电纺丝技术,将胰蛋白酶嵌入聚L-乳酸(PLLA)中,获得活性纳米纤维,可用于水解明胶.为改进被聚L-乳酸纳米纤维包合胰蛋白酶(NF-TR)稳定性和酶催化效率,在纤维表面使用戊二醛将胰蛋白酶分子交联起来形成(CL-TR).在严峻的条件(50 ℃)下,CL-TR比NF-TR显示了更好明胶水解能力,从而改善了CL-TR催化能力和稳定性.胰蛋白酶被PLLA纳米纤维表面交联而固定,胰蛋白酶的变性、自溶和沥滤受到抑制,从而使酶的性质得到改善.LI Valuev[32]最新研究发现,丙烯酰胺水凝胶固定化胰蛋白酶活性依赖于水溶胶膨胀率、孔径分布和酶结合方式.
影响胰蛋白酶固定化制备的因素很多,包括载体材料结构和性能、固定化方法、位点和条件等,其中载体选择和方法是固定酶制备的关键.酶固定化后一般稳定性增加,易从反应系统中分离,且易于控制,能反复多次使用,便于运输和贮存,有利于自动化生产.固定化酶是近十余年发展起来的酶应用技术,在工业生产、化学分析和医药等方面有较好的应用前景.但是活性降低,使用范围减小,技术还有发展空间.
总之,采取各种有效的层析方法对胰蛋白酶进行提取和纯化,是研究胰蛋白酶酶学性质的基础.在此基础上,研究各种理化因素对胰蛋白酶的影响为深刻认识胰蛋白酶结构和功能的“构效关系”提供了重要的科学数据.胰蛋白酶的固定化是提高胰蛋白酶稳定性的重要手段,将在工业上胰蛋白酶的开发和利用方面发挥重要作用,具有潜在的应用价值.随着固定化方法的改进,必将获得酶活性更高、稳定性更好的固定化胰蛋白酶,并应用于生产中以创造更高的经济价值.
[1]Psochiou E,Sarropoulou E,mamuris Z,et,al.Sequence analysis and tissue expression pattern of sparus aurata chymotrysinogens and trypsinogen[J].Comp Biochem Physiol,2007,147(3):367-377
[2]Darias M J,Murray H M,Gallant J W,et al.The spatiotemporal expression pattern of trypsinogen and bile salt-activated lipase during the larval development of red porgy(Pagrus pagrus,pisces,Sparidae)[J].Mar biol,2007,152(1):109-118
[3]王镜岩.生物化学[M].北京:高等教育出版社,2002
[4]Buettner K,Kreisig T,Sträte N,et al.Protein surface charge of trypsinogen changes its activation pattern[J].BMC Biotechnology,2014,14(1):960-960
[5]张东裔,唐建国,张龙翔.胰蛋白酶活性的定量测定方法[J].生物化学与生物物理进展,1996,23(6):511-513
[6]朱忠胜,安苗,姚俊杰,等.菲牛蛭消化酶活性的测定[J].贵州农业科学,2015,43(11):117-119
[7]甘丽萍,刘仁华,李彦杰,等.家蚕幼虫总蛋白酶和胰蛋白酶活性的测定[J].西南农业学报,2015,28(4):1847-1850
[8]张建萍,惠晓红,杨丽丽,等.塔里木兔和家兔的消化酶活性比较[J].动物学杂志,2016,51(1):33 -38
[9]Zhang Tong,Zhang Hao,Liu Guiliang,et al.Interaction of Cu2+,Pb2+,Zn2+with Trypsin:What is the Key Factor of their Toxicity[J].Journal of Fluorescence,2014,24(6):1803-1810
[10]Dong M,Qi H,Ding S,et al.Electrochemical determination of trypsin using a heptapeptide substrate self-assembled on a gold electrode[J].Microchimica Acta,2015,182(1):43-49
[11]丁凌霄,孟俊祥,龙峥,等.胰蛋白酶的提取纯化及酶学性质的研究[J].粮食与食品工业,2012,20(2):40-43
[12]冷春生,李庆伟.牛胰蛋白酶制备工艺的改进及其对基因工程人胰岛素前体的酶切作用[J].沈阳药科大学学报,2013,30(1):68-71
[13]喻峰,卢大儒,陈薇.测序级胰蛋白酶的制备工艺与质量检测[J].生物技术通讯,2014,25(4):76-81
[14]Khangembam B K,Yvr K S,Chakrabarti R.Purification and characterization of trypsin from the digestive system of carp Catla catla(Hamilton)[J].International Aquatic Research,2012,4(1):1-12
[15]Khaled H B,Jellouli K,Souissi N,et al.Purification and characterization of three trypsin isoforms from viscera of sardinelle(Sardinella aurita)[J].Fish Physiology and Biochemistry,2011,37(1):123-133
[16]Liu Chun-Hung,Shui Ya-Li,Hu Jue-liang.Purification and characterization of trypsin from the pyloric ceca of orange-spotted grouper,Epinephelus coioides[J].Fish Physiology and Biochemistry,2012,38(3):837-848
[17]Helane MS Costa,Augusto CV Freitas Júnior,Ian PG Amaral,et al.Metal-sensitive and thermostable trypsin from the crevalle jack(Caranx hippos)pyloric caeca:purification and characterization[J].Chem Cent J,2013(7):166
[18]Tomoyoshi Fuchise,Hideki Kishimura,Haruo Sekizaki,et al.Purification and characteristics of trypsins from cold -zone fish,Pacific cod(Gadus macrocephalus)and saffron cod(Eleginus gracilis)[J].Food Chemistry,2009,116(3):611-616
[19]陈荣昌,杜泓璇,马尧,等.青鱼胰蛋白酶的分离纯化及部分性质研究[J].安徽农业科学,2008(11):4541-4543
[20]黄烨,谢锐田,何建妹,等.罗非鱼胰蛋白酶和猪胰蛋白酶性质对比研究[J].食品工业科技,2011,32(5):215-222
[21]岑亮,张丽丽,邱慧,等.鸭肝蛋白酶的分离纯化及其部分性质研究[J].西南大学学报:自然科学版,2007,29(2):97-101
[22]吴志强.日本新糠虾消化系统组织学及胰蛋白酶样酶理化性质初步研究[J].中国海洋大学学报:自然科学版,2007,37(5):781-784
[23]刘平,胡志和,吴子健.超高压引发胰蛋白构象变化与酶活性间的关系[J].光谱学与光谱分析,2015,35(15):1335-1339
[24]黄卓烈,陈小丽,巫光宏,等.超声波对胰蛋白酶活力影响的机理研究[J].中国生化药物杂志,2009,30(4):230-238
[25]张国文,王亚萍.邻苯二甲酸二丁酯与胰蛋白酶的相互作用[J].吉首大学学报:自然科学版,2015,36(1):46-51
[26]宋九华,李琼,黄忠林,等.表面活性剂吐温与牛胰蛋白酶作用研究[J].皮革科学与工程,2009,19(2):22-30
[27]安红,宋伟明,高树刚.胰蛋白酶在磁性核壳介孔分子筛上的固定化研究[J].食品科学,2012,33(23):266-269
[28]孙俊,翁龙梅,刘孟,等.新型磁性纳米材料对胰蛋白酶的固定化[J].江苏大学学报:自然科学版,2015,36(3):343-347
[29]Maciel J C,Mercês AAD,Cabrera M,et al.Magnetic nanoparticles coated with polyaniline to stabilize immobilized trypsin[J].Hyperfine Interactions,2016,237(1):1-13
[30]阮贵华,刘玉花,陈正毅,等.Fe3O4磁性纳米粒子固定化胰蛋白酶[J].桂林理工大学学报,2012,32(4):569-574
[31]Song X,Wei L,Chen A,et al.Poly(L-lactide)nanofibers containing trypsin for gelatin digestion[J].Fibers and Polymers,2015,16(4):867-874
[32]LI Valuev,IL Valuev,LV Vanchugova,et al.Effect of the hydrogel carrier structure on the activity of immobilized trypsin[J].Applied Biochemistry and Microbiology,2015,51(5):618-620
Recent research advances of the purification,properties and immobilization in animals trypsin
WANG Qing-hui,XU Xing-jun,SHAO SHU-li,TIAN Jin-bo,ZHANG Wei-wei,WANG You-xiang,XUE Ming-qiang
(School of Life Science and Agriculture and Forestry,Qiqihar University,Qiqihar 161006,China)
According to the worldwide recent research reports on trypsin,reviewed the advances in animal trypsin,involving its purification,properties and immobilization,in order to provide some reference for the further study,exploitation and utilization of trypsin.
animal;trypsin;purification;immobilization;advances
Q955
A
10.3969/j.issn.1007-9831.2016.12.011
2016-10-09
黑龙江省教育厅科学技术研究项目(11541387;12511611)
王卿惠(1991-),女,山东肥城人,在读硕士研究生,主要从事鸟类生理代谢方面的研究.E-mail:36018346@qq.com
徐兴军(1969-),男,黑龙江甘南人,教授,硕士,主要从事动物生理生态学方面的研究.E-mail:xxj0605@163.com
1007-9831(2016)12-0039-06

