体外诊断试剂质量控制标准研究
郭世富 黄 颖 母瑞红 李静莉
体外诊断试剂质量控制标准研究
郭世富①国家食品药品监督管理总局医疗器械标准管理中心 中国食品药品检定研究院 北京 100050黄 颖①母瑞红①李静莉①

[摘要]目的:体外诊断试剂标准是监管的重要依据,完善质量控制标准,有效提高体外诊断试剂的质量,以保障大众用械安全有效。方法:调研国内体外诊断医疗器械产业和标准情况,对比国外标准的体系建设情况,对我国体外诊断试剂的国家标准、行业标准的分布及实施情况进行分析。结果:体外诊断产品种类数量多,各地分布不统一,虽然近年我国体外标准质量和数量有很大提升,但与国外相比标准体系有待完善。结论:借鉴国外先进经验,提出完善我国体外诊断试剂标准体系和强化标准宣传贯彻等措施,以提升我国体外诊断试剂质量控制标准水平。
[关键词]体外诊断试剂;标准;法规;质量控制
[First-author’s address] Center for Medical Device Standardization Administration, CFDA (National Institutes for Food and Drug Control), Beijing 100050, China.
目前,体外诊断产品在临床上用于疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价,公众对体外诊断试剂产品的质量评价越来越关注,政府监管越来越重视,质量评价标准的适宜性越来越重要[1-7]。为此,本研究结合参与国家食品药品监督管理总局“体外诊断试剂质量评估和综合治理”的实践,对我国体外诊断试剂的国家标准、行业标准的分布及实施情况进行调研探讨,对体外诊断试剂产品国家标准、行业标准及注册产品标准(产品技术要求)在上市后监管各个环节中的作用进行分析,为加强体外诊断试剂标准管理提供参考。
1 我国体外诊断试剂产业情况
近年来,我国诊断试剂产业发展迅猛,体外诊断试剂可分为生化诊断试剂、免疫诊断试剂、血液学诊断试剂、分子诊断试剂以及培养基等[8]。根据国际研究公司Kalorama Information在《China Healthcare Reform and Its Impact On IVD,Pharma and Device Markets》报告分析的数据,我国体外诊断产品种类分布比例如图1所示[9]。
我国各省、市体外诊断企业及产品数量差异显著,体外诊断产品种类数量多,总体而言,生化、免疫类占绝大部分,其他品类较杂,各省、市分布不同,其体外诊断产品种类统计见表1。
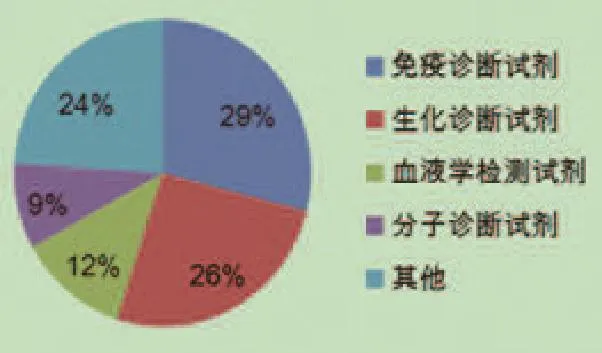
图1 我国体外诊断产品种类示意图

表1 我国相关省、市体外诊断产品种类分布
2 我国体外诊断试剂医疗器械标准
2.1 体外诊断试剂标准现状
体外诊断试剂标准在体外诊断试剂产品生产和行业监管中起着越来越重要的作用[10]。标准犹如大树之树干,是产品质量保证的基础,可谓牵一发而动全身[11-12]。为了满足行业监管需要,我国正在加快体外诊断产品国家标准及行业标准制订、修订工作。全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)负责组织起草体外诊断试剂医疗器械标准,为推动标准的制订、修订和贯彻实施做了大量工作[13-14]。国家食品药品监督管理总局成立医疗器械标准管理中心后,协调各方面资源,充足标准经费,加强标准制订、修订工作流程管理,保障标准制定质量。近年来,我国体外诊断试剂产品标准数量和质量均得到很大提升。截至2015年5月,体外诊断产品国家行业标准数量达到172项,其中国家标准16项,行业标准156项。
2.2 体外诊断国家行业标准体系
为了更好地研究体外诊断国家行业标准体系建设情况,对体外诊断标准进行了横向和纵向对比。根据《体外诊断试剂注册管理办法》和2013年国家食品药品监督管理总局公布梳理的体外诊断试剂产品分类子目录,在产品品种分类子目录中列出766种。在172项国家行业标准中,产品标准154项,占90%,其他(如溯源方法标准等)仅占10%。
在154项产品标准中,有基础标准和具体产品标准(包括21项体外诊断仪器标准)。其中基础标准10项,包括6项产品标示信息的标准、1项术语标准(生物芯片术语)、2项原材料(体外诊断用水、芯片用醛基基片)以及1项命名标准。具体产品标准包括21项体外诊断仪器标准和123项具体试剂标准。124项具体体外诊断试剂标准在各个分类学科中的分布见表2。

表2 体外诊断试剂标准分类统计
表2统计数据显示,免疫、生化领域标准修订比重比较大,而其他比重比则较小,这与体外诊断试剂发展历程以及在临床应用情况基本相符。其中,血液体液的常规产品包括血液分析、凝血分析、尿液分析、血流变分析及血型检测,目前制定的标准基本能够覆盖。生化类有生化试剂盒的通用技术要求标准,以及结合具体品种的产品标准。免疫类包括酶联免疫吸附、化学发光、时间分辨荧光、免疫层析、免疫组化及流式细胞技术等常见免疫学分析方法的标准;涉及到激素检测、血清蛋白检测、病原体检测及肿瘤标记物检测等试剂。微生物类制定有各类微生物培养基、微生物鉴定以及微生物药物敏感性测试纸片等标准。分子诊断类,近年来陆续制定了涉及聚合酶链式反应(polymerase chain reaction,PCR)、荧光原位杂交技术(fluorescence in situ hybridization,FISH)以及基因芯片技术的各类标准。
2.3 体外诊断产品标准与体外诊断分类子目录比较
体外诊断标准与体外诊断分类子目录进行比较,具体产品标准覆盖分类子目录中3个大类15个小类的97个产品,占分类子目录中产品总数的13%。未涉及到的6小类包括:①Ⅲ-4与遗传性疾病相关的试剂;②Ⅲ-5与麻醉药品、精神药品及医疗用毒性药品检测相关的试剂;③Ⅲ-8与变态反应(过敏原)相关的试剂;④Ⅱ-6用于维生素检测的试剂;⑤Ⅱ-8用于药物及药物代谢物检测的试剂;⑥Ⅱ-9用于自身抗体检测的试剂。这6小类产品的共同特点是临床用量小,生产厂商数量少,产品方法学繁杂,具体标准的制定尚在推进中。
3 国外体外诊断产品标准制订情况
(1)国际标准化组织(International Organization for Standardization,ISO)是国际标准化工作的权威机构,其中ISO/TC212(临床实验室检测和体外诊断试验系统)负责医学实验室和体外诊断试验系统方面的标准化和指南性工作,包括质量管理、检验前和检验后程序、分析性能、实验室安全、参考系统和质量保证。目前,ISO秘书处设在美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)[15-17]。
(2)ISO/TC 212下设5个工作组,即第1工作组(WG1,Quality and competence in the medical laboratory医学实验室质量和能力);第2工作组(WG2,Reference systems参考系统);第3工作组(WG3,In vitro diagnostic products体外诊断产品);第4工作组(WG4,Antimicrobial susceptibility test微生物敏感性测试);第5工作组(WG5,Laboratory biorisk management实验室生物安全管理)。
(3)ISO/TC 212在成立20年以来的时间里共发布24项标准,其中包括医学实验室质量和能力6项、参考系统5项、体外诊断产品10项以及微生物敏感性测试3项。在24项标准中ISO15189、ISO17511、ISO15193、ISO15194及ISO15195等均为具有很强影响力的关于医学实验室、溯源和参考测量系统的标准,在全世界得到广泛应用。
欧洲标准由欧盟标准化机构管理。欧洲标准化委员会(CEN)的CEN/TC140负责体外诊断医疗器械标准化工作体外诊断医疗器械技术委员会,负责体外诊断医疗器械标准化工作。CEN/TC140下设5个工作组:①CEN/TC 140/WG 3医学实验室质量管理,秘书处设在BSI(英国标准协会);②CEN/TC 140/WG 4参考系统,秘书处设在DS(丹麦标准协会);③CEN/TC 140/WG 5样本容器,秘书处设在DIN;④CEN/TC 140/WG 9外部质量评价方案的使用,秘书处设在DIN;⑤CEN/TC 140/WG 10抗菌剂敏感性试验,秘书处设在DIN,CEN/TC140发布7项标准。
(4)欧盟协调标准是指与欧盟法规相配套的标准,由各成员国转化为成员国标准,按协调标准生产的标准,可以假定是符合指令的基本要求。欧盟共发布了26项体外诊断医疗器械协调标准,其中有CEN的CEN/TC140制定的标准,也有CEN下其他医疗器械TC制定的标准,且认可ISO的部分标准。在26项标准中,有电气安全标准、软件标准、标示信息标准、方法标准、质量管理体系标准及样本容器标准等,关于产品标准只有2项,即培养基标准、自测血糖标准。
(5)美国CLSI是重要的标准化机构,涉及标准化9大领域:即自动化和信息、临床化学和毒理学、评价方案、血液学、免疫和配体分析、微生物学、分子生物学方法、POCT、质量体系和实验室操作。迄今为止,CLSI发布的标准为366项,按其内容主要分为两大类:①实验室检验程序的标准化,如检验前程序、检验中程序及检验后程序的标准化;②实验室所使用方法的标准化,如参考方法的定义、描述和发布。两大类标准的最终目的都是为了促进“检验结果的一致性”。CLSI的方法学评价标准(EP文件)被全球范围内的体外诊断产品制造商和监管机构广为接受,这些标准为体外诊断产品的性能评价提供了依据和参考。CLSI的许多标准被美国食品药品监督管理局(Food Drug Administration,FDA)认可和使用[18]。
4 我国体外诊断试剂医疗标准制(修)订及实施
通过对体外诊断试剂医疗标准制(修)订的调研,借鉴国际各标准权威机构体外诊断试剂标准的制定,提出完善我国体外诊断试剂标准体系和强化标准宣传贯彻措施,以提升我国体外诊断试剂质量控制标准水平[7-8]。
4.1 加大标准宣传贯彻力度 提高标准执行能力
充分利用网络信息技术,加强体外诊断标准的宣传,增加标准可获得时效性。同时,在管理部门、检验检测机构和生产企业等部门均需加强标准宣传贯彻和实际操作培训。随着标准数量和质量的提升,迫切需要统一对标准的理解,便于实施。目前的体外诊断试剂国家标准和行业标准多为推荐性标准,在监督抽验、生产体系考核及产品延续注册等监管环节执行时尚无充分的法律依据。在技术审评、监督抽验中不能强制性要求企业执行,企业对强制要求执行推荐性标准有较大疑义,从而造成各地检测尺度不一致、审评把握尺度不一致。因此,急需对标准进行宣传贯彻,统一适用性认识,统一检测尺度,以提高标准执行能力。
4.2 加强标准体系的研究 促进标准的制(修)订
体外诊断试剂产品项目种类、检测方法繁多,检测技术飞速发展,新的检测方法和平台不断推陈出新,在继续制定产品标准的同时应加大对国外体外诊断标准体系的研究,更加关注方法学(尤其是新兴技术方法学)标准,参考体外诊断系统、实验室质量控制标准的研究结果,制定通用的基础标准,形成体外诊断系统质量控制整体新思路,切实提高标准服务产业、服务监管的服务水平。及时收集监管机构、审评机构以及生产企业标准使用过程中发现的问题,加快组织问题标准的制(修)订。
4.3 统一标准物质管理 完善管理实施细则
体外诊断试剂标准的实施大多依赖标准物质(质控盘)完成。与此同时,产品开发、溯源、监督抽验和质量控制过程需要标准物质(质控盘),从法律法规角度而言,《体外诊断注册管理办法》规定了由中国食品药品检定研究院负责国家标准物质的管理和研发,但目前尚缺乏明确的实施细则。此外,其他机构也提供标准物质,标准物质管理不统一,造成标准物质信息不充分等问题。同时,标准物质的制备工艺复杂,有些原料的获得较为困难,导致标准物质数量缺口较大,对于某些标准物质的缺乏,已成为产品研发、临床检验测量方法标准化、试剂溯源和医学检验结果互认的瓶颈。因此,急需完善标准物质管理实施细则。
5 结语
应依据《体外诊断试剂注册管理办法》,细化标准物质管理细则,统一管理。国家食品药品监督管理总局需要加强与各部门的沟通,争取国家科技支撑资金支持,加大标准品研发力度,以提高体外诊断试剂产品的质量控制标准水平。
参考文献
[1]中华人民共和国国务院令.第650号.医疗器械监督管理条例[S].中华人民共和国国务院,2014-02-12.
[2]国家食品药品监督管理总局令.第5号.体外诊断试剂注册管理办法[S].国家食品药品监督管理总局, 2014-06-27.
[3]安抚东.我国医疗器械监管法规体系建设之思考[J].中国药事,2007,21(7):453-459.
[4]孙立魁,施燕平.我国体外诊断试剂质量现状分析[J].中国医疗器械信息,2011,17(3):1-3.
[5]李彬,李晓霞,刘春莉,等.体外诊断试剂监管分析[J].中国医药科学,2012,2(8):138-139.
[6]章宏法,张敏红.医疗机构体外诊断试剂使用管理现状调查及思考[J].中国医疗设备,2010,25(11):10-13.
[7]黄颖,郭世富,母瑞红,等.体外诊断试剂液体辅助试剂分类界定初步研究[J].中国药事,2013,22(11): 1250-1250.
[8]鄢盛恺.关于我国临床检验医学设备的现状与发展问题的思考[J].中华检验医学杂志,2005,28(12): 1327.
[9]China Healthcare Reform and Its Impact On IVD.Pharma and Device Markets[M].Kalorama Information,2011:20-30.
[10]梁洪,郭宝萍.体外诊断试剂(药品)经营质量管理现状、问题及解决方法[J].首都医药,2013,23(14): 10-11.
[11]王菲菲,王箐舟,张春涛.体外生物诊断试剂参考物质的现状与发展[J].中国药事,2013,27(3):318-323.
[12]戴捷,苏磊.体外诊断试剂有效管理与质量安全控制的探讨[J].中国医学装备,2011,8(11):80-81.
[13]刘艳,孙楠,王玉梅,等.体外诊断试剂行业标准制定工作的现状分析及展望[J].中国医疗器械杂志, 2014,38(6):448-450.
[14]仇保跃.探讨体外诊断试剂成本监管与检验设备性能评价体系的建立[J].中国医学装备,2014,11(8): 87-89.
[15]EU.European Standardization[S].EU,2015.
[16]ISO/TC 212.Clinical laboratory testing and in vitro diagnostic test systems[S].ISO/ TC212,2015.
[17]Clinical and Laboratory Standards Institute. CLSI Guidelines[S].Clinical and Laboratory Standards Institute,2015.
[18]FDA.Overview of Device Regulation[S].FDA,2015.
Research on the IVD quality control standard/GUO Shi-fu, HUANG Ying, MU Ruihong, et al// China Medical Equipment,2016,13(1):28-31.
[Abstract]Objective: The standard of In Vitro Diagnostic medical device(IVD) is an important basis for the supervision. To improve the quality control standards, effectively improve the quality of in vitro diagnostic reagents, and ensure the safety and effective of IVD. Methods: To study IVD industry and standard system in FDA, European and China. The analysis was carried out on the distribution and the implementation of the IVD standard. Results: Distribution of the type of IVD is different in different region. In recent years, the quality and quantity of our country’s standard has been greatly improved. The standard system needs to be improved compared with the standard systems of foreign countries. Conclusion: To reference standard regulation in FDA and European, some measures were put forward on the perfecting standard system and strengthening standard training to enhance the quality control standards in my country.
[Key words]In vitro diagnostic reagents; Standard; Regulation; Quality control
收稿日期:2015-10-23
DOI:10.3969/J.ISSN.1672-8270.2016.01.009
[文章编号]1672-8270(2016)01-0028-04
[中图分类号]R197.39
[文献标识码]A
作者简介
郭世富,男,(1977- ),博士,高级工程师。国家食品药品监督管理总局医疗器械标准管理中心 中国食品药品检定研究院,从事医疗器械监管及标准管理研究工作。
- 中国医学装备的其它文章
- 基于可编程逻辑控制器和分布式控制系统的医用电子直线加速器控制系统设计**基金项目:广东省引进创新科研团队计划(201001D0104732255)“电子加速器关键核心技术研发及产业化”
- 基于单片机的双通道静脉输液装置的设计
- 高频电刀输出功率的测试与分析
- 高频电刀的质量检测
- 我国医用耗材管理研究热点的文献计量学社会网络分析**基金项目:辽宁省教育厅(GXDJ2014-B057)“高校基层组织建设研究的文献计量学分析”;卫生计生委中国卫生经济学会招标课题(CHEA1011060301)“卫生装备技术的双向功能配置评估模式体系研究”;沈阳市科学技术项目(F12-264-4-01)“分子细胞计量学实验技术数字资源共享服务平台”*通讯作者:labczs@mail.cmu.edu.cn;wangfei@mail.cmu.edu.cn
- 基于风险、成本和收益视角的蒸汽灭菌器保养结果分析

