荷叶炒炭过程中金丝桃苷、异槲皮苷与槲皮素含量变化规律研究*
李 坤,王明芳,薛非非,国金铃,马俊楠,孟祥龙,张朔生
(山西中医学院制药与食品工程学院 晋中 030619)
荷叶炒炭过程中金丝桃苷、异槲皮苷与槲皮素含量变化规律研究*
李 坤,王明芳,薛非非,国金铃,马俊楠,孟祥龙,张朔生**
(山西中医学院制药与食品工程学院 晋中 030619)
目的:本研究主要探究不同炒炭程度对荷叶炭中金丝桃苷、异槲皮苷与槲皮含量变化的影响,并建立HPLC同时测定这3种物质的方法,通过模拟炮制来研究这3种物质转变的关系。方法:本实验采用Hypersil gold C18(4.6 mm×250 mm,5 μ)色谱柱;以乙腈(A)-0.1%磷酸(B)为流动相,梯度洗脱;流速:1.0 mL·min-1;检测波长:360 nm;柱温:35℃。结果:荷叶炒炭后,金丝桃苷与异槲皮苷含量随炮制时间呈现逐渐下降趋势;槲皮素含量随着炮制时间呈现先上升、后下降趋势,并在280±5℃温度下炒制10 min左右达到峰值;另外,在金丝桃苷和异槲皮苷模拟炮制样品中均检出槲皮素。结论:该实验说明不同炒炭程度对荷叶炭中金丝桃苷、异槲皮苷与槲皮素含量有显著影响,在加热炮制过程中金丝桃苷和异槲皮苷受热分解产生槲皮素。
荷叶 炒炭 黄酮 高效液相 模拟炮制 炮制机理
荷叶(Nelumbinis folium)为睡莲科植物莲(Nelumbo nucifera Gaertn.)的干燥叶,具有清暑化湿、升发清阳、凉血止血的功效,主治暑热烦渴、暑湿泄泻、脾虚泄泻、血热吐衄、便血崩漏等症[1]。目前广泛应用的饮片有生荷叶和荷叶炭2种,现代药理研究表明荷叶炭有明确的止血作用[2],但目前对荷叶炒炭饮片炮制程度的判断仅依靠外观性状,仍没有统一的质量控制指标。荷叶中主要含有生物碱、黄酮类、有机酸等成分,黄酮类成分主要有金丝桃苷、异槲皮苷、槲皮素,这3种化合物有着共同的母核结构,均为槲皮素[3],结构式见图1。荷叶炒炭之后生物碱类物质几乎损失殆尽,槲皮素含量增加[4],荷叶炭中主要有效成分为黄酮类化合物。
荷叶在炮制过程中,黄酮类物质的变化对荷叶炭饮片质量有显著的影响。为了更好地控制炮制程度和荷叶炭饮片质量,本实验通过研究建立HPLC同时测定饮片中金丝桃苷、异槲皮苷和槲皮素的含量;为了分析在炮制过程中这3种黄酮类化合物的变化规律,本实验对荷叶生品和8种不同炮制程度的荷叶炭样品进行含量测定和分析,希望能为荷叶炭饮片炮制标准的制订提供科学依据;同时该实验采用模拟炮制的方法对炮制过程中金丝桃苷、异槲皮苷和槲皮素转变机制做了进一步研究,旨在探讨荷叶炮制机理,并从分子水平研究角度为药饮片炮制机理研究提供新的思路和方法。
1 材料
实验采用UltiMate 3000高效液相色谱仪系统(美国Thermo Fisher Scientific公司),包括:在线真空脱气机、双三元梯度泵、自动进样器、柱温箱、DAD检测器和Chromeleon 7色谱工作站;SB25-12D型超声波清洗机(宁波新芝生物科技有限公司);DV215CD型十万分之一电子分析天平(美国奥豪斯仪器公司);Optris MS-C012005-B型红外测温仪(德国Optris仪器公司);娃哈哈纯净水,乙腈(色谱纯,德国Merck公司);其他试剂为分析纯。
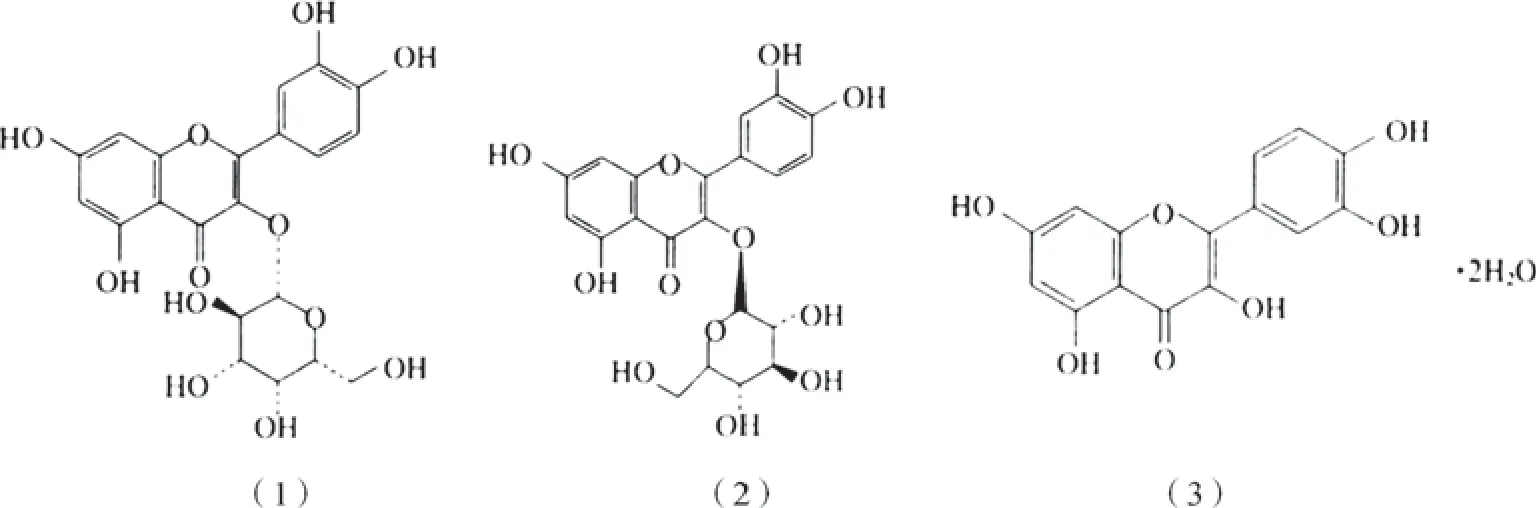
图1 3种荷叶黄酮类化合物结构式
药材:荷叶药材于2013年10月于山东济宁采集,由山西中医学院张朔生教授鉴定为睡莲科植物莲N. nucifera Gaertn.的叶。
对照品:金丝桃苷(批号:111521-201205)、异槲皮苷(批号:111809-201102)、槲皮素(批号:100081-200907)均购于中国食品药品检定研究院。
2 方法
2.1 荷叶炭样品制备
取荷叶去除杂质,切成丝,分别取净荷叶丝50 g,置于预热至280℃的炒锅内,分别炒制3、5、8、10、12、15、17和20 min,制备出不同炮制程度的荷叶炭饮片,分别编号为荷叶炭1-8号。炒制3-8 min的荷叶炭饮片颜色较浅,部分叶片颜色泛绿,未达到炭药的炮制标准,炒制10-15 min的荷叶炭饮片表面棕褐色或黑褐色,炒制17-20 min的荷叶炭饮片颜色焦黑已经碳化,边缘部分已经灰化。取各荷叶炭样品,粉碎,过40目筛,备用。
2.2 金丝桃苷、异槲皮苷和槲皮素含量测定
2.2.1 色谱条件
Hypersil gold C18(4.6 mm×250 mm,5 μm)色谱柱;以乙腈(A)-0.1%磷酸(B)为流动相,梯度洗脱(0-17 min,15%A;17-35 min,15%-50%A;35 min,15%A;35-40 min,15%A);流速1.0 mL·min-1;检测波长360 nm;柱温35℃;进样量10 μL。对照品、供试品色谱图见图2。
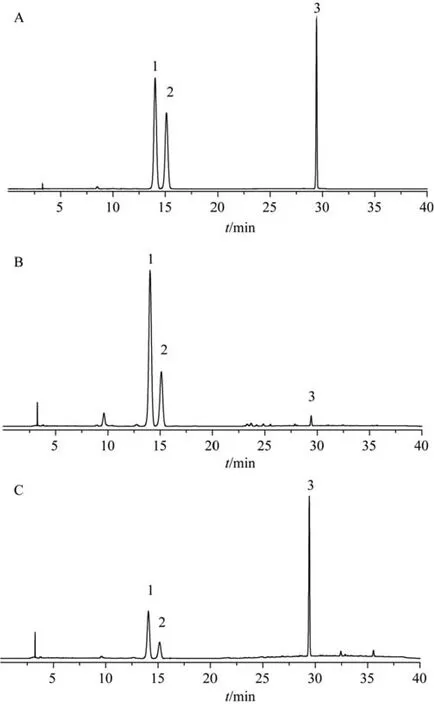
图2 对照品(A)、生荷叶样品(B)和荷叶炭样品(C)的HPLC图
2.2.2 对照品溶液制备
精密称取金丝桃苷、异槲皮苷、槲皮素分别置于5 mL容量瓶中,加入甲醇至刻度配成单一对照品储备液,质量浓度分别为:1.246、0.910、0.730 mg·mL-1;分别精密移取适量各单一对照品储备液于10 mL容量瓶中,用甲醇定容至刻度,制成1 mL含金丝桃苷0.373 8 mg,异槲皮苷0.273 mg,槲皮素0.219 mg的混合对照品溶液。
2.2.3 供试品溶液制备[5-7]
精密称取各样品粉末0.5 g于三角瓶中,精密加入60%乙醇50 mL,称定重量,水浴回流1 h,静置放冷,用60%乙醇补足重量,摇匀过滤,取续滤液,过0.45 μm微孔滤膜,即得。
2.2.4 线性关系考察
精密吸取混合对照品溶液0.1、0.2、0.4、0.8、1.6、2.0、4.0 mL分别置于5 mL容量瓶中,用甲醇定容至刻度,摇匀;分别精密吸取10 μL注入液相色谱仪,记录各被测成分峰面积,以各对照品浓度为横坐标(x),以各峰面积为纵坐标(y),进行线性回归,得回归方程分别为:金丝桃苷:y=239.13x-0.393 4(r=0.999 9);异槲皮苷:y=236.51x+0.111 (r=0.999 9);槲皮素:y=376.22x-1.830 6(r=0.999 9)。结果表明金丝桃苷、异槲皮苷、槲皮素分别在7.476-299.040、5.460-218.400、4.380-175.200 mg·L-1范围内呈良好的线性关系。
2.2.5 精密度试验
精密吸取2.2.4项下4号对照品溶液10 μL进样,连续进样6次,记录峰面积。结果金丝桃苷、异槲皮苷、槲皮素峰面积的RSD值分别为:0.32%、0.60%、0.23%,表明仪器精密度良好。
2.2.6 稳定性试验
取同一份供试品溶液,分别于0、4、8、12、24 h进样,记录峰面积,结果金丝桃苷、异槲皮苷、槲皮素的峰面积的RSD值分别为:1.7%、1.6%、0.9%,表明供试品溶液在24 h内稳定性良好。
2.2.7 重复性试验
平行称取荷叶炭4号样品粉末6份,每份0.5 g,精密称定,按2.2.3项下供试品溶液制备方法进行制备,并测定含量,计算得金丝桃苷、异槲皮苷、槲皮素三种物质含量的RSD值分别为1.5%、1.8%、1.2%,说明方法重复性良好。

表1 3种化合物回收率(n=6)
2.2.8 加样回收试验
取已知含量的得荷叶样品(荷叶炭4号样)粉末(3种物质含量分别为金丝桃苷4.273 8 mg·g-1,异槲皮苷1.319 8 mg·g-1,槲皮素7.164 0 mg·g-1),每份约0.25 g,平行6份,精密称定。分别依次加入用甲醇配制好的各对照品溶液适量,挥干甲醇,按2.2.3项下供试品溶液制备方法制备,测定含量,计算回收率,结果见表1。
2.2.9 供试品含量测定
分别取荷叶生品及不同炒制时间的炮制品粉末各约0.5 g,精密称定,依法制备成供试品溶液,精密吸取各供试品溶液10 μL,注入液相色谱仪,进行测定,并计算各成分含量结果见表2,各成分含量动态变化趋势见图3。
2.3 模拟炮制试验[8]
金丝桃苷、异槲皮苷和槲皮素具有共同的母核,从上述测定结果可见,炮制过程中金丝桃苷和异槲皮苷含量下降,而槲皮素含量呈现先上升后下降的趋势。金丝桃苷和异槲皮苷的苷元为槲皮素,所以作者推测金丝桃苷与异槲皮苷在炮制过程中受热分解产生槲皮素,从而导致自身含量下降,槲皮素含量升高。为进一步研究,取金丝桃苷及异槲皮苷对照品在模拟饮片炮制的条件下进行炮制,然后利用高效液相色谱进行分析。
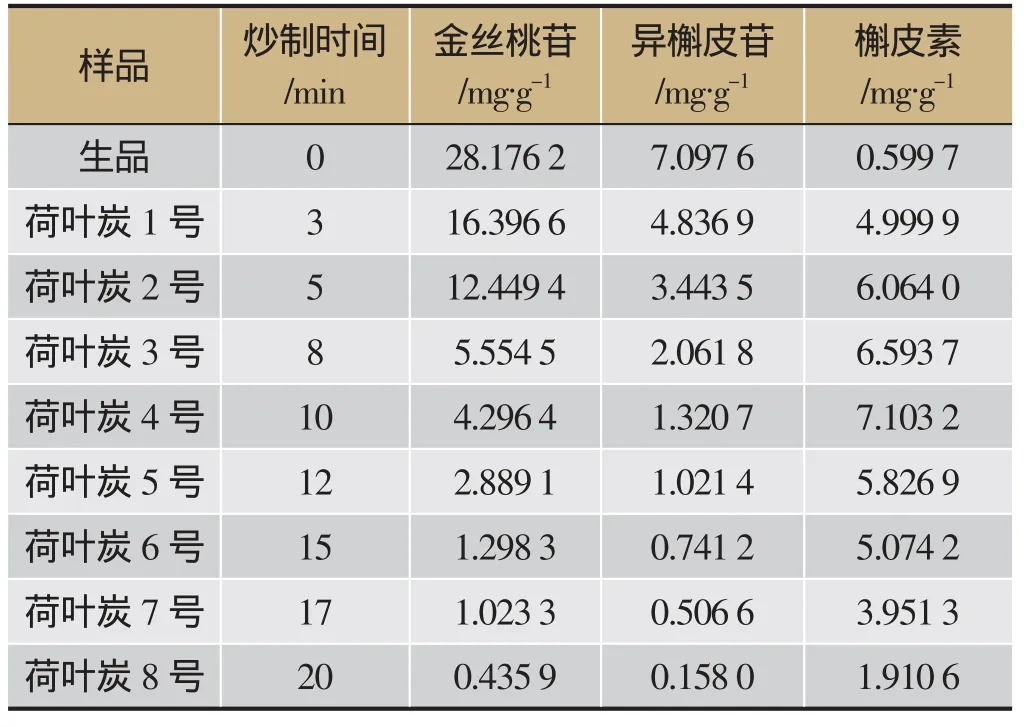
表2 供试品中3种成分测定结果
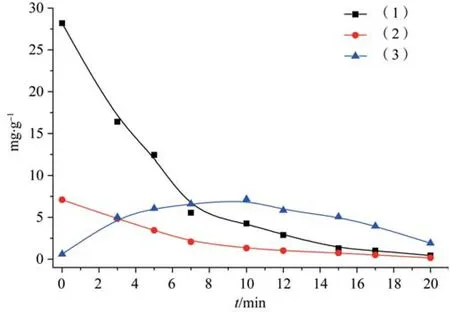
图3 三种物质随炮制时间变化趋势图
2.3.1 模拟炮制样品制备
精密称取金丝桃苷和异槲皮苷适量,分别置于坩埚中,将坩埚置于调温电热套中,用红外测温计实时监测坩埚底部温度,调节温度从室温升至280±5℃,并保持5 min,取出坩埚静置至室温,加入甲醇适量使其溶解,摇匀,过0.45 μm滤膜,即得。
2.3.2 定性分析
按2.2.1项下色谱条件,精密吸取模拟炮制样品溶液各10 μL注入液相色谱仪进行分析,色谱图见图4。
2.3.3 结果
从图4中可以看出,金丝桃苷和异槲皮苷模拟炮制产物中峰面积最大是槲皮素,其他峰面积较小,说明在加热炮制的过程中,金丝桃苷及异槲皮苷分解产生槲皮素,从而使得自身含量降低,槲皮素含量升高。
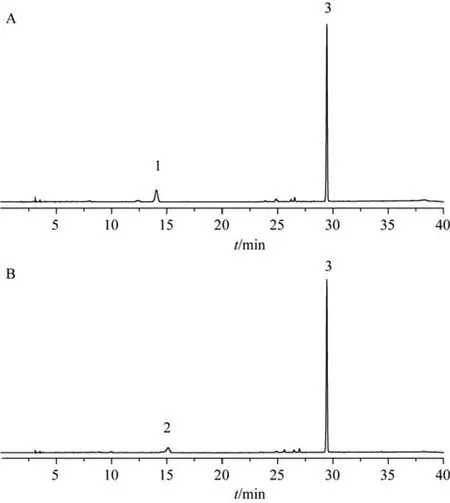
图4 金丝桃苷模拟炮制样品(A)、异槲皮苷模拟炮制样品(B)的HPLC图
3 讨论
3.1 炮制条件确定
在前期的研究中,本研究团队利用热分析技术,通过热重法及微商热重法对金丝桃苷、异槲皮苷和槲皮素在模拟空气气氛条件下进行加热失重实验[9]。研究发现金丝桃苷和异槲皮苷在温度升至280℃左右时失重速率明显增加,金丝桃苷重量降低19.52%,异槲皮苷失重18.33%;当温度升至320℃时,槲皮素失重速率开始增加,表明此时槲皮素呈现出热不稳定状态开始分解,基于此作者认为荷叶炒炭温度以280℃左右为宜,不宜超过300℃。
3.2 色谱条件的确定
由于金丝桃苷和异槲皮苷2种化合物结构相似,很难实现完全分离,有报道曾在荷叶黄酮测定中用磷酸盐缓冲液-乙腈为流动相[10],缓冲盐溶液为pH=4.0的0.2%的磷酸-10%氢氧化钠溶液,实现了金丝桃苷与异槲皮苷的分离,但流动相配制过程复杂,洗脱梯度长达70 min,因此本文作者重新考察了甲醇-水,乙腈-水,甲醇-冰乙酸水溶液,甲醇-磷酸水溶液,乙腈-冰乙酸水溶液,乙腈-磷酸水溶液等多组流动相系统,并对酸水溶液的浓度进行了考察,发现流动相为乙腈-0.1%磷酸水溶液时目标化合物峰形及分离度良好。另选择多种梯度洗脱程序进行比较,对出峰时间进行优化,最终确定本实验流动相条件。本实验所建立的方法,方便快捷、分离度好、测定结果稳定可靠,能够同时测定金丝桃苷、异槲皮苷和槲皮素3种黄酮类化合物,可以为荷叶药材品质鉴定以及饮片炮制过程中的质量控制提供借鉴。
3.3 结果分析
本实验对生荷叶及8种不同炒炭程度的荷叶炭饮片中金丝桃苷、异槲皮苷和槲皮素含量进行了测定,从测定结果及图3可知,荷叶炒炭之后金丝桃苷和异槲皮苷含量大幅降低,并随着炮制时间呈现逐渐下降趋势,最后几乎损失殆尽;槲皮素含量也出现大幅变化,随着炮制时间呈现先上升后下降趋势,在280±5℃温度下炒制10 min左右含量达到峰值,最高可达生品含量12倍之多,但是随着持续加热炮制使得槲皮素也呈现出不稳定的状态,逐渐开始分解,导致其含量下降。说明加热炮制对荷叶中金丝桃苷、异槲皮苷以及槲皮素含量有显著影响,炮制的温度和时间成为影响炮制品质量的关键因素。
金丝桃苷和异槲皮苷的苷元均为槲皮素,推测金丝桃苷与异槲皮苷在炮制过程中受热分解产生槲皮素,为探究3中黄酮类物质的含量转化关系,本实验进行了模拟炮制,图4结果可以看出在金丝桃苷和异槲皮苷模拟炮制样品中均检出槲皮素,说明金丝桃苷与异槲皮苷在炮制过程中受热分解产生槲皮素。有药理研究表明槲皮素可显著缩短兔血浆活化部分凝血活酶时间和凝血酶原时间,有较好凝血活性[11],炒炭之后槲皮素含量明显增加,这与荷叶制炭后用于出血症的传统用药经验是吻合的。
本实验选用的色谱条件能够同时测定荷叶中金丝桃苷、异槲皮苷和槲皮素3种黄酮类化合物,可以比较全面的分析在炒炭过程荷叶中黄酮类成分的含量变化;并借鉴模拟炮制方法,对金丝桃苷、异槲皮苷在模拟荷叶饮片炮制条件下的反应产物进行分析,更加明确了荷叶炒炭过程中这3种黄酮成分的变化规律。通过对药材中单体成分的模拟炮制,能够将复杂的炮制环境简单化,清晰的呈现模拟炮制与饮片炮制过程中成分变化的相关性,有助于明确炮制过程中成分的变化途径及其规律,对于阐明饮片炮制的科学内涵和从分子水平研究中药饮片炮制机理提供新的思路和方法。
1 国家药典委员会.2010年版中国药典(一部).北京:中国医药科技出版社, 2010: 258-259.
2 彭凯,张学兰,王莉,等.荷叶不同炮制品提取物对正常大鼠凝血功能影响的比较研究.中成药, 2013, 35(1): 140-143.
3 赵小亮,王智民,马小军,等.荷叶化学成分研究.中国中药杂志, 2013, 38(5): 703-708.
4 董春永,张学兰,李慧芬.炮制对荷叶中荷叶碱和槲皮素含量的影响.中成药, 2010, 32(6): 973-976.
5 王国华,张保献,聂其霞,等.星点设计——效应面法优选荷叶中荷叶碱与荷叶黄酮的提取工艺.中国中药杂志, 2008, 33(20): 2332-2335.
6 赵骏,高敏燕,李妍.荷叶中黄酮苷的微波提取研究.中草药, 2005, 36(8): 65-66.
7 蒋益虹.荷叶抑菌有效成分的提取优化工艺研究.中国中药杂志, 2005, 30(13): 1030-1031.
8 谭鹏.乌头碱型生物碱的模拟炮制研究.北京:北京中医药大学博士学位论文, 2012: 17.
9 马俊楠.基于热分析技术的荷叶、蒲黄、藕节炒炭共性规律研究.太原:山西中医学院硕士学位论文, 2015: 15-16.
10 朱滢涧,王新财. HPLC法同时测定荷叶中金丝桃苷、异槲皮苷和槲皮素.中成药, 2015, 37(6): 1276-1279.
11 刘洋,张学兰,李慧芬,等.荷叶不同饮片黄酮和生物碱类成分对兔体外凝血功能影响的比较.中成药, 2014, 36(4): 842-845.
Study on Content Variations of Hyperoside, Isoquercitrin and Quercetin in Fried Charcoal Lotus Leaf
Li Kun, Wang Mingfang, Xue Feifei, Guo Jinling, Ma Junnan, Meng Xianglong, Zhang Shuosheng
(College of Pharmaceutical and Food Engineering, Shanxi University of Traditional Chinese Medicine, Jinzhong 030619, China)
This study was aimed to analyze the content changes of hyperoside, isoquercitrin and quercetin in charred lotus leaf at different fried charcoal processing degrees. The simultaneous determination on 3 substances by HPLC was established. The material change relation among 3 substances was studied through the simulated processing. Hypersil gold C18column (4.6 mm × 250mm, 5 μm) was used in the study. The mobile phase was acetonitrile (A)-0.1% phosphoric acid (B) with gradient elution. The flow speed was 1.0 mL·min-1. The detection wavelength was 360 nm. The column temperature was 35℃. The results showed that after the lotus leaf was fried charcoal, the contents of hyperoside and isoquercitrin decreased gradually along with the processing time. The content of quercetin increased first and then decreased with the increase of processing time. The content of quercetin in lotus leaf achieved the highest when it was processed for 10 min at the temperature of 280 ± 5℃. Quercetin was detected in both the hyperoside and isoquercitrin simulated processing samples. It was concluded that different processing degrees of fried charcoal lotus leaf had remarkable effects on the contents of hyperoside, isoquercitrin and quercetin. During the heating process, quercetin was decomposed from both hyperoside and isoquercitrin.
Lotus leaf, fried charcoal, flavonoids, HPLC, simulated processing, processing mechanism
10.11842/wst.2016.01.019
R943.1
A
(责任编辑:朱黎婷 张志华,责任译审:王 晶)
2015-09-13
修回日期:2015-11-07
* 山西省研究生优秀创新项目(20133123):基于热分析技术对炒炭工艺与“炒炭存性”相关性研究,负责人:马俊楠;山西中医学院研究生创新基金(YCX-1408):荷叶不同炮制品药理作用与物质基础相关性研究,负责人:李坤。
** 通讯作者:张朔生,教授,硕士生导师,主要研究方向:中药炮制现代研究。

