应用DNA条形码技术对市场苦木药材的检测研究*
陈 影,张景景,汤 欢,王 俊,赵李龙,孙 伟**
( 1.中国中医科学院 中药研究所 中药鉴定与安全性检测评估北京市重点实验室 北京 100700;2.南阳理工学院张仲景国医国药学院 南阳 473000;3.四川农业大学林学院 成都 611130;4.武汉理工大学化学化工与生命科学学院 武汉 430070)
应用DNA条形码技术对市场苦木药材的检测研究*
陈 影1,张景景2,汤 欢3,王 俊4,赵李龙2,孙 伟1**
( 1.中国中医科学院 中药研究所 中药鉴定与安全性检测评估北京市重点实验室 北京 100700;2.南阳理工学院张仲景国医国药学院 南阳 473000;3.四川农业大学林学院 成都 611130;4.武汉理工大学化学化工与生命科学学院 武汉 430070)
目的:利用 DNA条形码技术对市场上中药材苦木进行检测,为其市场监管及用药安全提供保障。方法:对15份苦木药材(每份取样2个)共30个样品进行DNA提取,PCR扩增其ITS2序列并双向测序,应用CodonCode Aligner version 6.0.2软件对测序峰图进行校对拼接,将得到的所有序列与GenBank以及中药材DNA条形码鉴定系统分别进行比对,选择相似度最相近的物种在中国植物志网站上查询。在此基础上扩增其psbA-trnH序列以验证结果的可靠性。结果:市场购买的苦木样品中正品苦木Picrasma quassioides占70%、臭椿Ailanthus altissima占6.67%、板蓝Baphicacanthus cusia占13.33%、楝叶吴茱萸Tetradium glabrifolium占3.33%、柘Maclura tricuspidata占6.67%。结论:市场上苦木药材存在混伪品,DNA条形码技术能有效鉴别药材真伪。
苦木 DNA条形码 ITS2序列 psbA-trnH序列
中药材传统的鉴定方法主要是性状鉴别、显微鉴别和化学特征鉴别[1]。然而,性状鉴别受药材原植物的生长环境以及药材是否炮制加工的影响较大,由于组织特征的相似性且组织结构易受地理环境、生长期、储存条件诸多因素的影响[2]。化学特征受生长环境影响较大,加上中药大多数有效成分复杂且不明确,变异幅度大,同时其有效成分的含量受采收时间等诸多因素影响,因此难以规定一个合理的数值标准,从而影响到化学鉴定的准确性[2]。
近年来,由于限制性内切酶的发现、DNA重组技术的建立、DNA序列快速测定方法的发明,使得分子生物学及其技术以迅猛的速度发展,带动了生物学乃至整个科学的发展,鉴定中药材的真伪也随之有所改善[3,4]。DNA条形码分子鉴定技术首先于2003年由Hebert等[5]提出,即通过一段DNA序列,从基因水平对物种进行快速准确有效的鉴定。陈士林等[6]提出将ITS2序列作为通用序列来鉴定药用植物,并辅以psbA-trnH的补充序列,推动了中药DNA条形码鉴定技术。目前,DNA条形码技术已经稳定地应用于红景天[7]、冬虫夏草[8]、羌活[9]和灵芝[10]等中药材鉴定。
苦木为苦木科苦木属植物苦木Picrasma quassioides (D.Don) Benn.的干燥枝和叶。夏、秋两季采收,干燥[11]。苦木性寒,味苦,有清热解毒、祛湿的功效,用于风热感冒、咽喉肿痛、湿热泻痢、湿疹、疮疖、蛇虫咬伤等症。谷华[12]、赵文娜[13]等指出苦木具有多种药理作用以及具有很好的临床应用价值。胡小平[14]也指出穴位注射苦木注射液治疗小儿腹泻临床疗效较好,建议临床推广。因此,进行苦木的质量控制以及混伪品的鉴别尤为重要。然而目前关于苦木掺伪的现象报道较少,在市场上是否有伪品存在还有待鉴定。本研究利用DNA条形码技术对市场上的苦木进行系统鉴定,以保障中药材市场的药品安全性,维护消费者的合法权益[15,16]。
本研究运用基于ITS2和psbA-trnH序列的DNA条形码技术尝试对15份苦木市场样品(每份取样2份)进行鉴定,检测市场上苦木药材是否存在混伪品。
1 材料
通过药材市场购买以及淘宝店铺购买等方式收集了商品名为苦木的药材共15份,产地分别为广西玉林、河池、河北保定、石家庄、北京、安徽亳州、浙江温州和上海,每份取样2份。样本信息及形状见表1、图1。
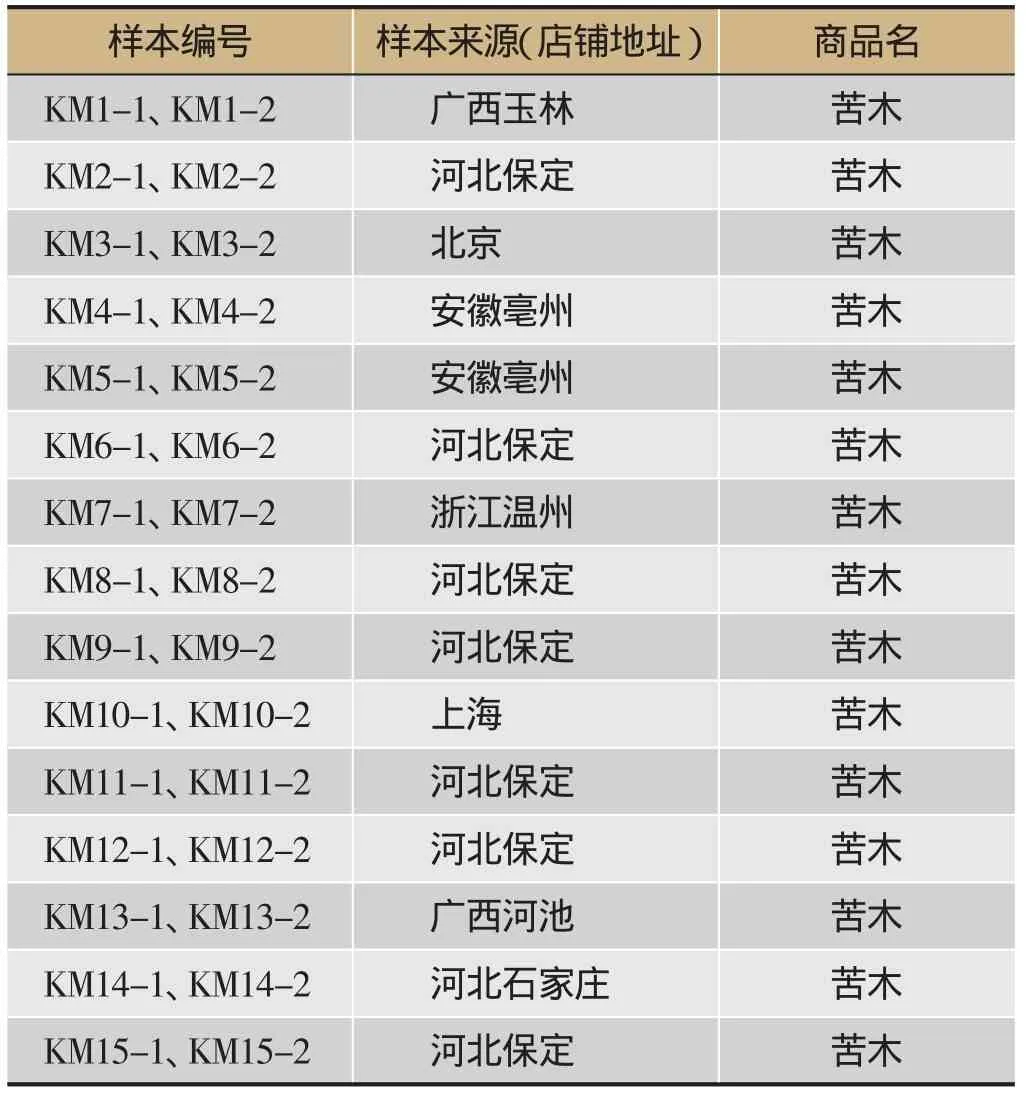
表1 样本信息

图1 样品图片
2 方法
2.1 样品的DNA提取
样品用浸有75%乙醇的酒精棉擦拭实验样品的表面以除去杂菌污染,取实验材料30 mg,用高通量组织研磨仪,在50 Hz频率下研磨120 s后呈粉末状态;随后加800 μL核分离液漂洗3次;使用百泰克新型快速基因组DNA提取试剂盒(BioTeke Corporation,中国),按其说明书提取样品总DNA,并参考“中药材DNA条形码分子鉴定指导原则”对提取步骤进行适当调整[17],如将水浴条件调整为56℃后水浴过夜以更有效地提取得到DNA。
2.2 样品DNA的PCR扩增和测序
ITS2序列扩增[18]正向引物为ITS2F:5'-ATGC GATACTTGGTGTGAAT-3',反向引物为ITS3R:5'-GACGCTTCTCCAGACTACAAT-3';psbA-trnH序列扩增[19]正向引物为:PA:5'-GTTATGCATGAAC GTAATGCTC-3',扩增反向引物为TH:5'-CGCGC ATGGTGGATTCACAATCC-3'。
PCR反应体系为25 μL,包括:2×Taq PCR MasterMix 12.5 μL,ITS2序列(或者psbA-trnH序列)的正向和反向引物(2.5 μmol·L-1)各1.0 μL,双蒸馏水8.5 μL,模板DNA 2.0 μL。
PCR扩增条件:ITS2序列扩增程序[18]为:94 ℃变性5 min;94 ℃变性1 min,55℃退火1 min,72℃延伸30 s(进行40个循环);72℃延伸10 min。psbA-trnH序列扩增程序[19]为:94℃变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1.5 min(进行30个循环);72℃延伸7 min。
电泳检查PCR扩增情况,经PCR扩增成功后的产物经纯化后进行双向测序。
2.3 数据处理
使用CodonCode Aligner version 6.0.2(Codon Co.,USA)对所获得的测序序列进行质量分析和剪切校对拼接,剪去低质量区,采用基于隐马尔科夫模型的HMMer[20]注释方法去除两端5.8S 和28S区段。将最终得到的所有序列与GenBank(http:// blast.ncbi.nlm.nih.gov/Blast.cgi)和中药材DNA条形码鉴定系统(http://tcmbarcode.cn)分别进行比对,然后选择比对的相似度最相近的物种在中国植物志网站(http://frps.eflora.cn/)上进行查询,得到相应的物种信息,与所做的样品进行比对。
3 结果与分析
3.1 DNA提取及PCR扩增结果分析
中药材DNA提取是开展中药材DNA条形码研究的首要环节[21]。在大部分中药材都含有大量的次生代谢产物,在本实验中采用核分离液洗涤3次,尽可能除去存在于细胞核中的多糖、多酚等物质,从而能有效地提高所提取的DNA的纯度;由于根茎类药材质地较为坚硬,不易提取,为了更有效地提取得到DNA,选择56℃条件下水浴过夜。15份样品,每份取样2个,提取得到的DNA进行PCR扩增,其PCR产物经电泳后均能显示单一目的条带(获得30条ITS2序列,28条psbA-trnH序列)。
3.2 序列比对分析
将最终得到的所有序列与GenBank(http:// blast.ncbi.nlm.nih.gov/Blast.cgi)以及中药材DNA条形码鉴定系统(http://tcmbarcode.cn)分别进行比对,然后选择比对的相似度最相近的物种在中国植物志(http://frps.eflora.cn/)网站上进行查询。
ITS2序列鉴定的结果为苦木P. quassioides (KM1-1、KM1-2、KM2-1、KM2-2、KM3-1、KM3-2、KM4-1、KM4-2、KM5-1、KM5-2、KM6-1、KM6-2、KM9-1、KM9-2、KM10-1、KM10-2、KM12-1、KM12-2、KM13-1、KM13-2、KM14-1)的占总取样量的70%,与两个库的相似度分别在99%和99.6%以上;臭椿A. altissima(KM7-1、KM7-2)占6.67%,与两个库的相似度分别在99% 和 99.6%以 上;板 蓝B. canthuscusia(KM8-1、KM8-2、KM11-1、KM11-2)占13.33%,与两个库的相似度分别在92%和91.8%以上;楝叶吴茱萸T. glabrifolium(KM14-2)占3.33%,与两个库的相似度分别在99%和100%;柘M. tricuspidata(KM15-1、KM15-2)占6.67%,与两个库的相似度分别是98%和98.3%。
psbA-trnH序列鉴定的结果为苦木P. quassioides(KM1-1、KM1-2、KM2-1、KM2-2、KM3-1、KM3-2、KM4-1、KM4-2、KM5-1、KM5-2、KM6-1、KM6-2、KM9-1、KM9-2、KM10-1、KM10-2、KM12-1、KM12-2、KM13-1、KM13-2、KM14-1)的占总取样量的70%,与两个库的相似度分别在98%和99.4%以上;臭椿A. altissima(KM7-1、KM7-2)占6.67%,与GenBank的相似度分别是100%,在DNA条形码鉴定系统暂未收录;板蓝B. canthuscusia(KM8-1、KM8-2、KM11-1、KM11-2)占13.33%,与两个的相度分别在99%和99.5%;楝吴茱萸T. glabrifolium(KM14-2)占3.33%,与GenBank的相似度分别是93%,在DNA条形码鉴定系统暂未收录;此实验中psbA-trnH序列并未做出KM15-1和KM15-2为何物。
ITS2序列和psbA-trnH序列在2个库中分别比对的相似度大部分在99%以上,由此可认为相对应样品鉴定结果可靠。而KM8-1、KM8-2、KM11-1和KM11-2的ITS2序列在GenBank 和DNA条形码鉴定系统的比对相似度较低,而其psbA-trnH序列在GenBank和DNA条形码鉴定系统的比对的相似度均在99%以上;KM14-2的ITS2序列在GenBank和DNA条形码鉴定系统的比对的相似度在99%以上,而其psbA-trnH序列在与GenBank比对的相似度仅为93%。这表明在库中相应的序列信息可能有识别错误的情况。虽然如此,通过得到的ITS2序列和psbA-trnH序列与数据库中比对得到的相似度,还是能够为市场上中药材苦木是否存在混伪品及混伪品类型提供一定参考。ITS2序列检测后不同结果占总取样量的百分比见图2,ITS2序列和psbA-trnH序列比对的具体相似度见表2。
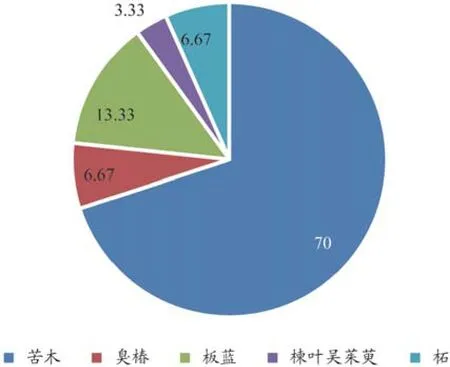
图2 ITS2序列检测后不同结果占总取样量的百分比
4 讨论
虽然目前暂未发现有关苦木混伪品的相关报道,但是通过此次研究发现,商品药材中存在混伪品,主要包括臭椿、板蓝、楝叶吴茱萸和柘,臭椿和苦木乃同一科(苦木科)的植物,其余的样品都不是苦木科植物。从外观上(见图1)观察,臭椿和苦木性状相似,但是臭椿的颜色较浅;板蓝的性状较苦木差距较大,而且质地更加坚硬;但是楝叶吴茱萸和柘的饮片较苦木差别不明显,这就对准确鉴别造成一定的影响。
陈士林团队经过近10年研究,对上千种中草药及其混伪品的DNA条形码进行研究,创建了“中药材DNA条形码生物鉴定体系”,从基因层面解决中药材与混伪品的物种识别问题,DNA分子鉴定技术依靠这种有差异的DNA片段来做分子鉴定,不会受到药材的外观和是否进行加工等造成的影响,而且鉴别快速、精确,在中药材鉴定上具有一定的准确性和优越性,应用前景很广阔[22-24]。陈士林等[25]指出:DNA分子鉴定具有准确性、方法通用性、可数字化、可重复性、样品处理简单性和实用性等优点,对于鉴定混伪品来说非常方便而且有效,在特定中药鉴定中将发挥重要作用。近些年来,Wu[26]、马孝熙[27]、凃媛[28]、樊佳佳[29]、熊超[30]、张雅琴等[31]所做的实验研究表明应用ITS2序列或psbA-trnH序列可以有效、准确稳定地鉴别远志、天仙子、竹茹、天竺黄、谷物芽类、石韦及其混伪品。本研究应用ITS2序列和psbA-trnH序列对市场销售的苦木商品进行检测,结果显示:ITS2序列和psbA-trnH序列可有效地鉴定苦木及其混伪品。在整个的实验过程中,获得高质量的DNA是进行DNA条形码研究的必要前提和关键环节,这是因为中药材中基本上都含有较多的次生代谢物质,往往会干扰植物DNA提取成功率,所以DNA提取方法应当进行相应改进[32,33]。
目前,传统鉴定与分子鉴定相互独立,如果能将二者有机整合起来,从“表型”和“遗传型”2个层次共同鉴定,不仅可以提高中药鉴定的准确性,而且将有利于中药鉴定学的发展[34]。

表2 基于ITS2和psbA-trnH序列的市售药材为苦木的比对相似度
1 罗焜,马培,姚辉,等.多基原药材秦艽ITS2 条形码鉴定研究.药学学报, 2012, 47(12): 1710-1717.
2 袁庆军,张文婧,姜丹,等.论中药分子鉴定的方法和原则.植物分类与资源学报, 2012, 34(6): 607-613.
3 成新跃,周红章,张广学.分子生物学技术在昆虫系统学研究中的应用.动物分类学报, 2000, 25(2): 121-133.
4 杨光明,蔡宝昌,王明艳,等.分子生物学技术在中药鉴定中的应用.世界科学技术-中医药现代化, 2001, 3(4): 29-35.
5 Hebert P D, Cywinska A, Ball S L, et al. Biological identifications through DNA barcodes. Proc Biol Sci, 2003, 270(1512): 313-321.
6 陈士林,庞晓慧,姚辉,等.中药DNA条形码鉴定体系及研究方向.世界科学技术-中医药现代化, 2011, 13(5): 747-754.
7 Xin T Y, Li X J, Yao H, et al. Survey of commercial Rhodiola products revealed species diversity and potential safety issues. Sci Rep. 2015, 5:8337.
8 Xiang L, Song J Y, Xin T Y, et al. DNA barcoding the commercial Chinese caterpillar fungus. FEMS Microbiol Lett. 2013, 347(2): 156-162.
9 辛天怡,姚辉,罗焜,等.羌活药材ITS/ITS2条形码鉴定及其稳定性与准确性研究.药学学报. 2012, 47(8): 1098-1105.
10 Liao B S, Chen X C, Han J P, et al. Identification of commercial Ganoderma (Lingzhi) species by ITS2 sequences. Chin Med. 2015, 10:22-30.
11 国家药典委员会.中华人民共和国药典(一部). 北京:中国医药科技出版社, 2015: 200.
12 谷华,王梅,王志阳.苦木的现代药理与临床应用. 中医研究, 2001, 14(5): 55-56.
13 赵文娜.苦木的化学成分及药理活性研究.西安:西北大学博士学位论文, 2013: 20-23.
14 胡小平.穴位注射苦木注射液治疗小儿腹泻80 例临床观察.医学信息(中旬刊), 2011, 7: 3099-3100.
15 陈士林,姚辉,宋经元,等.基于DNA barcoding(条形码)技术的中药材鉴定.世界科学技术-中医药现代化, 2007, 9(3): 7-12.
16 于俊林,赵莎,任明波,等.基于ITS2条形码鉴定柴胡与大叶柴胡.中国中药杂志, 2014, 39(12): 2160-2163.
17 陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则.中国中药杂志, 2013, 38(2): 141-148.
18 朱英杰,陈士林,姚辉,等.重楼属药用植物DNA 条形码鉴定研究.药学学报, 2010, 45(3): 376-382.
19 李西文, 凯撒·苏来曼,等. 伊犁贝母和川贝母的trnH-psbA序列鉴定研究.全国植物化学控制与化感作用交流研讨会. 2010: 102-104.
20 Keller A, Schleicher T, Schultz J, et al. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation. Gene, 2009, 430(1-2): 50-57.
21 段中岗,黄琼林,杨锦芬,等.适合中药材DNA条形码分析的DNA提取方法的研究.中药新药与临床药理, 2009, 20(5): 480-484.
22 丁洋. 中药材鉴定迈入基因时代. 中国中医药报, 2014年12月22 日(第002版).
23 焦明超,赵大显,欧阳珊,等. DNA 条形码技术在生物分类学中的应用前景.湖北农业科学, 2011, 50(5): 886-890.
24 郭艳丽,鞠爱霞,等. DNA 分子标记技术在中药鉴定学中的应用.黑龙江医药. 2012, 25(4): 545-547.
25 陈士林,郭宝林,张贵君,等.中药鉴定学新技术新方法研究进展.中国中药杂志, 2012, 37(8): 1043-1055.
26 Wu L, Sun W, Wang B, et al. An integrated system for identifying the hidden assassins in traditional medicines containing aristolochic acids. Sci Rep, 2015, 5: 11318-11327.
27 马孝熙,任伟超,孙伟,等.远志药材及其混伪品的DNA 条形码鉴定.世界科学技术-中医药现代化, 2014, 16(8): 1719-1723.
28 凃媛,熊超,师玉华,等.细小种子类毒性药材天仙子的DNA 条形码鉴定.世界科学技术-中医药现代化, 2014, 16(11): 2337-2342.
29 樊佳佳,张婉冰,向丽,等.探索psbA-trnH序列对竹茹、天竺黄及其近缘物种的鉴定.世界科学技术-中医药现代化, 2014, 16(11):2349-2354.
30 熊超,周红,贺海波,等.基于ITS2 序列鉴定谷物芽类药材及其混伪品.世界科学技术-中医药现代化, 2014, 16(11): 2343-2348.
31 张雅琴,石钺,宋明,等.蕨类药材石韦及其混伪品的psbA-trnH序列鉴定.中国中药杂志, 2014, 39(12): 2222-2226.
32 罗焜,马培,姚辉,等. 中药DNA条形码鉴定中的DNA提取方法研究.世界科学技术-中医药现代化, 2012, 14(2): 1433-1439.
33 Bi I V, Harvengt L, Chandelier A, et al. Improved RAPD amplification of recalcitrant plant DNA by the use of activated charcoal during DNA extraction. Plant Breeding, 1996, 115: 205-206.
34 崔占虎,龙平,王颖莉,等. DNA分子标记技术在中成药鉴定中的应用与展望.中药材, 2015, 38(1): 188-192.
DNA Barcoding for Identification of Picrasma quassioides and Its Adulterants on the Market
Chen Ying1, Zhang Jingjing2, Tang Huan3, Wang Jun4, Zhao Lilong2, Sun Wei1
(1. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Key Laboratory of Beijing for Identification and Safety Evaluation of Chinese Medicine, Beijing 100700, China; 2. Zhang Zhong-jing Traditional Chinese Medicine College, Nanyang Institute of Technology, Nanyang 473000, China; 3. College of Forestry, Sichuan Agricultural University, Chengdu 611130, China; 4. School of Chemical Engineering and Life Sciences, Wuhan University of Technology, Wuhan 430070, China)
DNA barcoding technology was employed for identifying commercial products called Picrasma quassioides on the market. This study provided a guarantee for the market supervision and drug safety.Genomic DNA (2 repeats for each sample) from 15 P. quassioides samples was extracted. The ITS2 sequences were amplified and bidirectionally sequenced. All sequences were assembled and obtained using the CodonCode Aligner version 6.0.2. All sequences were compared with sequences available in the GenBank and TCMBARCODE database. The highest similarity species were selected and searched on the website of Flora Reipublicae Popularis Sinicae. In addition, the psbA-trnH sequences were amplified to verify the reliability of the results. The results showed that P. quassioides (70%), Ailanthus altissima (6.67%), Baphicacanthus cusia (13.33%), Tetradium glabrifolium (3.33%) and Maclura tricuspidata (6.67%) were found in the commercial samples. It was concluded that there were some adulterants of P. quassioides on the market. DNA barcoding technology can effectively monitor the medicines from its adulterants.
Picrasma quassioides, DNA barcoding, ITS2 sequence, psbA-trnH sequence
10.11842/wst.2016.01.008
R931.5
A
(责任编辑:马雅静 张志华,责任译审:王 晶)
2015-06-16
修回日期:2015-12-07
* 科学技术部国家重大新药创制项目(2013ZX09301307):基于中医临床转化的中药创新品种研发,负责人:陈士林。
** 通讯作者:孙伟,男,博士,助理研究员,主要研究方向:中药资源与中药分子鉴定。

