基于中药材DNA条形码系统的泽泻种子鉴别研究*
(1.中国医学科学院 北京协和医学院 药用植物研究所 北京 100193;2.南京中医药大学药学院 南京 210046)
张娜娜1,辛天怡1,金 钺1,谷 巍2,宋经元1**
Zhang Nana1, Xin Tianyi1, Jin Yue1, Gu Wei2, Song Jingyuan1
(1. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China; 2. Nanjing University of Chinese Medicine, Nanjing 210046, China)
基于中药材DNA条形码系统的泽泻种子鉴别研究*
(1.中国医学科学院 北京协和医学院 药用植物研究所 北京 100193;2.南京中医药大学药学院 南京 210046)
张娜娜1,辛天怡1,金 钺1,谷 巍2,宋经元1**
目的:以泽泻种子为研究对象,利用中药材DNA条形码鉴定系统区分不同产地泽泻的基原物种。方法:采用植物基因组DNA提取试剂盒提取总DNA,扩增核内部转录间隔区ITS2序列并进行测序。利用软件CodonCode Aligner 6.0.2和MEGA 5.1对序列进行拼接,并用体式显微镜观察记录种子外观形态特征。结果:泽泻Alisma plantago-aquatica和东方泽泻Alisma orientale种子外观形态相似;两个物种的ITS2序列长度均为311 bp,GC含量为56.9%,ITS2序列在165 bp处存在T-A变异。该鉴定结果显示,20份四川产泽泻种子样本序列为泽泻A. plantago-aquatica,其他产区36份样本均为东方泽泻A. orientale。结论:中药材DNA条形码鉴定系统可为选择正确基原的泽泻种质提供指导,该系统在泽泻人工栽培生产中具有重要应用价值,可为其他中药材种子鉴定提供示范。
DNA条形码 泽泻 东方泽泻 种子鉴定 ITS2
常用中药泽泻主要含有四环三萜类化合物、挥发油、生物碱、天冬素、植物甾醇、脂肪酸、氨基酸等多种成分,性甘、淡、寒,归肾、膀胱经,具有抑制动脉粥样硬化、降血脂、利尿、降血压、抗脂肪肝的作用[1-4]。一般来说,泽泻商品药材包括泽泻Alisma plantago-aquatica和东方泽泻Alisma orientale,目前对两个物种并未进行明确的区分[5]。两者中文名称也比较混乱,《中国药典》规定泽泻药材为泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎,在《中草药大典》中也有相似记载[1,6]。但《中国植物志》对两个物种中文名称分别记载为泽泻A. plantago-aquatica和东方泽泻A. orientale[7]。本文中的泽泻药材为广义上各类泽泻药材的统称,其基原包括:泽泻A. plantago-aquatica和东方泽泻A. orientale两个物种。泽泻药材栽培产区主要分布于四川、福建、江西等地,通常分为建泽泻、川泽泻和江泽泻,其中建泽泻和川泽泻分布较广泛[8]。不同产地不同种质的泽泻药材其微量元素、氨基酸及泽泻醇等成分的含量存在差异[9]。目前,泽泻科植物的常规分类方法主要依赖于其植物的形态和生理特性,鉴别难度较大。近年来,分子鉴定技术逐渐受到药材鉴定人员的广泛关注,如黄琼林等[10]从GenBank下载泽泻科植物序列 进行分析,发现核内部转录间隔区ITS2序列对泽泻科植物有较好区分作用;马晓冲等[11]以泽泻块茎和叶片为材料对此进行研究和验证。但到目前为止,对泽泻种子的鉴别研究尚未见报道。泽泻A. plantago-aquatica和东方泽泻A. orientale两者的成熟种子外观差别很小,传统的性状鉴别难以区分,在药材生产加工和临床应用中极易出现品种混杂现象,影响泽泻的药材品质和临床疗效。
药用植物资源是中药材生产的源头,种质影响药材的最终质量,选择正确种源对中药育种和资源保护具有重要意义[12]。然而,在药材栽培的实际生产中,种质混杂现象十分严重,例如川牛膝,由于其种子量不足,部分不良商家将麻牛膝混入川牛膝种子中,使药材原植物发生天然杂交,致使药材品质的退化[13]。再如半夏种茎中经常夹杂天南星、虎掌半夏,由于三者性状差异较小,肉眼难以准确识别,只能待植株长到一定高度才能辨别[12]。另外,由于植物性状的相似性,一些细小种子(如菟丝子、沙苑子、地肤子、天仙子等)也经常被混淆[14]。因此,寻找一种适用于种质的准确鉴定方法成为解决以上问题的关键。
药用植物DNA条形码鉴定技术从基因层面解决了药材品种鉴别问题。近年来,该技术得到了迅速发展,与二维码技术的结合应用使该方法的应用更加便捷和广泛[15,16]。大量实验研究证明,该鉴定方法具有稳定性和可靠性,成为传统鉴定的一个有力补充,为中药材的鉴定工作提供了科学指导[17]。该技术通过核基因组中一段特定的DNA序列,以中草药DNA条形码鉴定数据库为依据,对不同的物种进行区分,为解决中草药的品种考证和中药材常见混伪品问题奠定技术基础[15,17]。为区分不同产地泽泻的基原物种,本研究通过DNA条形码技术,以ITS2序列对来自不同产区的泽泻种子进行鉴定研究。
1 实验材料
本研究共收集泽泻种子样品56份。其中,20份分别来自四川主产区眉山市彭山县义和镇、谢家镇、公义镇、凤鸣镇和白马镇;8份收集自泽泻主要种植栽培区福建省建瓯市;13份样品来自江西省抚州市广昌县;在云南省红河州(红河哈尼族彝族自治州)、江苏省南京市和北京市共收集到样品15份。采集过程中,由当地种植人员提供样品(名称均为泽泻)。对实验样品进行统一编号,样品具体信息见表1。
2 实验方法
利用体式显微镜(SZX9)观察种子的形态特征并拍照记录。用酒精棉擦拭药匙,取泽泻种子约20 mg(大约20粒),用MM400混合型碾磨仪(Retsch Co.,德国)30次/s研磨2 min,采用植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取总DNA。本研究的操作步骤依照该试剂盒说明书并做了适当修改:(1)65℃水浴4 h,水浴过程中注意颠倒混匀数次;(2)以预冷的异丙醇替代缓冲液GP2,取500 μL加入上清液中后颠倒混匀,-20℃放置20 min;(3)用100 μL灭菌双蒸水洗脱DNA[15]。PCR扩增后进行双向测序,PCR扩增引物及反应条件参照马晓冲等的研究[11]。
3 数据处理
利用CodonCode Aligner 6.0.2对测序结果进行校对拼接,去除低质量区。利用隐马尔可夫模型HMMer对拼接好的序列进行5.8S和28S区域剪切,得到ITS2序列。将所得样品ITS2序列在中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn/ china/)中进行物种鉴定。利用软件MEGA5.1对样本序列进行分析,并且根据K2P模型计算遗传距离,确定单倍型,比较种内种间变异大小。
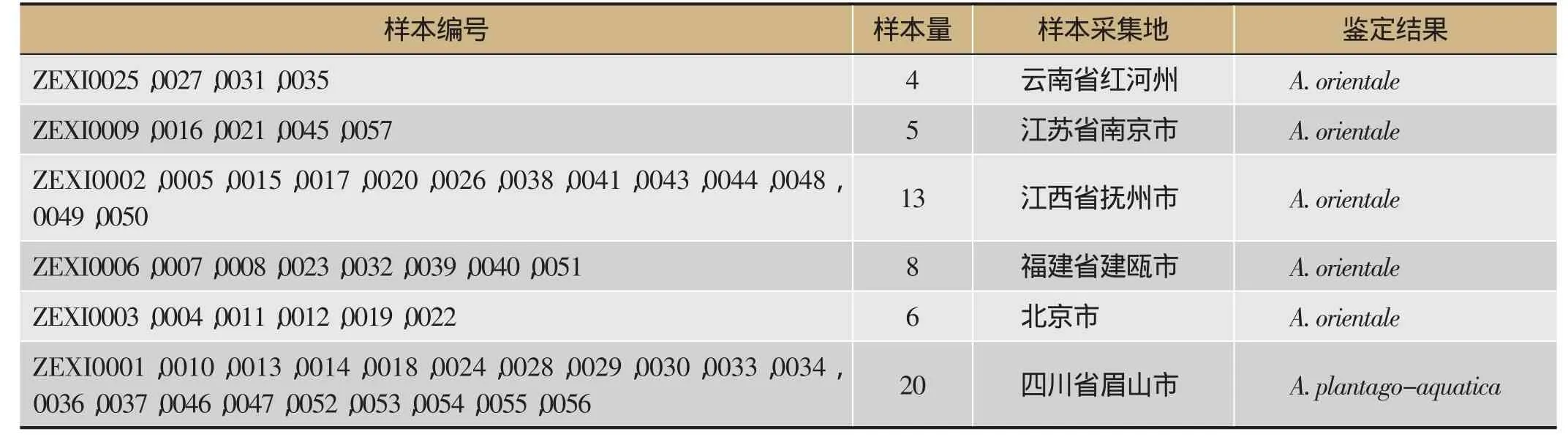
表1 样品采集地信息
4 结果与分析
4.1 不同产地泽泻种子分子鉴定结果和表观形态分析
来自全国不同产地泽泻种子样品,经过ITS2序列比对分析显示全部样品共分为两个物种,四川产20份样本为泽泻A. plantago-aquatica,其他36份样本均为《中国药典》(2010年版)规定的基原物种东方泽泻A. orientale,而种子采集地对两个物种并未进行区分。形态观察显示,单粒种子两侧扁,先端钝圆,表面灰黄色,长约为2 mm,宽约1 mm,背部有1-2浅沟,与文献描述一致[18]。如图1所示,泽泻A. plantago-aquatica和东方泽泻A. orientale种子形态差异较小,且体积微小,肉眼辨别难度很大。
4.2 不同泽泻种子峰图质量
DNA样品为来自约20粒种子的混合模板,经PCR扩增后测序,泽泻A. plantago-aquatica和东方泽泻A. orientale样品ITS2序列峰图质量很高,无套峰出现。56次重复实验结果显示图谱均如图2所示,标志着两个物种内部无变异,遗传稳定。
4.3 ITS2序列特征和种间种内变异分析
泽泻A. plantago-aquatica种子样本ITS2序列长度为311 bp,GC含量为56.9%,东方泽泻A. orientaleITS2序列长度和GC含量与其相同。两个物种序列在第165个碱基处存在A-T变异,来自四川产区的泽泻A. plantago-aquatica样本序列表现为T,其他产区东方泽泻A. orientale测定结果为A。基于K2P模型计算遗传距离,东方泽泻A. orientale种内平均K2P为0,泽泻A. plantago-aquatica种内平均K2P为0,种间遗传距离为0.003 2,成功区分两个物种。此结果说明:DNA提取所用的20粒种子混合样品,测序峰图质量很好,无其他变异。

图1 体式显微镜下种子的形态特征
5 讨论
5.1 泽泻种子DNA提取、PCR以及测序
种子类实验材料细胞壁较难分解[14,19]。因此,与叶片类相比,泽泻种子样品加裂解液GP1后的水浴时间需要延长为4 h。参考文献[20]的标准操作流程进行DNA提取、PCR扩增以及测序按照种子类药材DNA条形码鉴定,提取过程中未出现疑难点。因为物种内部可能存在高水平的种内遗传多态性,实验结果可能存在多模板干扰,研究者曾在唐古特大黄Rheum tanguticum中发现在ITS2序列500-550 bp处存在高频率碱基颠倒现象[21]。本研究取样时多个体同时进行DNA提取,分析结果显示峰图质量很好,未出现套峰、乱峰现象,这证实泽泻基因组内的ITS2主导变异占绝对优势,这与人参等物种的情况一致[22]。多批次样品的实验结果显示,ITS2序列对泽泻种子的鉴定具有重复性强、稳定性高的特点。
5.2 DNA条形码对泽泻种子及中药材种子种苗鉴定的意义

图2 泽泻种子的高质量ITS2序列峰图
种质的优劣决定中药的产量和质量,种质鉴定是确定药材基原植物,确保药效和合理利用种质资源的基础[23]。传统形态学鉴定方法在种质表观形态差别较小的情况下,鉴定难度较大,易出现偏差。而从分子生物学角度,即基因层面进行研究,比较DNA序列上的差异,不受样品形态限制,减少了人为主观因素影响,使鉴定结果更加准确。理想的DNA条形码要有足够的种间变异和较小的种内变异[24,25]。黄琼林等[10]通过对GenBank中泽泻科植物泽泻属、毛茛泽泻属、泽薹草属、慈姑属4个属鉴定序列的适用性筛选发现,在ITS2、rbcL、matK3个候选序列中,rbcL和matK序列种间和种内变异重叠较多,鉴定效率低,而ITS2序列种间变异程度高,与种内变化水平差异显著,在泽泻科鉴定中有明显优势,其中泽泻属研究样本涵盖了泽泻A. plantagoaquatica和东方泽泻A. orientale两个物种。以泽泻块茎、叶片为材料,ITS2序列能区分泽泻和药材的混伪品[11]。本研究首次以泽泻种子样品为研究对象发现2个物种ITS2序列长度均为311 bp,同一物种内部无变异现象,种间存在一个稳定变异位点,与马晓冲等[11]的研究结果一致,可有效区分两个物种,同时验证ITS2序列在泽泻鉴定应用的稳定性。中药材DNA条形码鉴定系统能够为正确基原泽泻种质的选择提供强有力指导,在泽泻人工栽培生产中具有重要应用价值,也为其他中药材种子种苗鉴定提供了参考。
致谢
感谢南京中医药大学耿超博士在样本收集上提供的帮助,感谢中国医学科学院药用植物研究所濒危药材繁育国家工程实验室协助完成此项工作。
1 中华人民共和国药典委员会.中国药典(一部).北京:中国医药科技出版社, 2015: 229.
2 汪春飞,成旭东,顾俊菲,等.泽泻化学物质基础及其毒性研究进展.中国中药杂志, 2015, 40(5): 840-846.
3 丁琛一,谭擎英,施宁川.泽泻与格列齐特对原发性糖尿病大鼠治疗作用的评价.中国医学科学院学报, 2015, 37(4): 451-455.
4 许文,罗奋熔,赵万里,等.泽泻降糖活性提取物化学成分研究.中草药, 2014, 45(22): 3238-3245.
5 张龙辉,陈宝钢,刘克强,等.泽泻资源的开发利用研究概况.亚热带农业研究, 2013, 9(3): 158-161.
6 陈士林,林余霖.中草药大典.北京:军事医学科学出版社, 2006:458.
7 中国科学院编委会.中国植物志.北京:科学出版社, 1992, 8: 141.
8 赵万里,张方方,黄小强,等.一测多评法测定泽泻中4种三萜类成分的含量.中国药学杂志, 2015, 50(15): 1347-1352.
9 陈菁瑛,苏海兰,黄玉吉,等.泽泻不同种质资源特性比较研究.中国中药杂志, 2009, 34(21): 2713-2717.
10 黄琼林,马新业,梁凌玲,等.泽泻科植物DNA条形码的筛选研究.中华中医药杂志, 2013, 28(5): 1402-1406.
11 马晓冲,姚辉,辛天怡,等.基于DNA条形码SNP鉴别东方泽泻、泽泻及市售泽泻药材.中国药学杂志, 2015, 50(17): 1474-1478.
12 李婷.不同产地半夏种质初步评价研究.成都:成都中医药大学硕士学位论文, 2008: 16-17.
13 官宇.川牛膝(Cyathula officinalis Kuan.)种质资源遗传多样性的初步研究. 成都:四川农业大学硕士学位论文, 2009: 3.
14 凃媛,熊超,师玉华,等.细小种子类毒性药材天仙子的DNA条形码鉴定.世界科学技术-中医药现代化, 2014, 16(11): 2337-2342.
18 Chen S L, Yao H, Han J P, et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species. Plos One, 2010, 5(1): 8613.
16 辛天怡,李西文,姚辉,等.中药材二维DNA条形码流通监管体系研究.中国科学:生命科学, 2015, 45(7): 695-702.
17 钱忠直,林瑞超,肖培根.中药鉴定与标准研究.中国中药杂志, 2014, 39(12): 2153-2154.
18 陈瑛.实用中药种子技术手册.北京:人民卫生出版社, 1999:607-608.
19 宋明,张雅琴,林韵涵,等.基于ITS2和psbA-trnH序列对细小种子类药材车前子的鉴定比较.中国中药杂志, 2014, 39(12): 2227-2232.
20 陈士林.中国药典中药材DNA条形码标准序列.北京:科学出版社, 2015:35.
21 Ma X C, Xie C X, Guan M, et al. High levels of genetic diversity within one population of Rheum tanguticum on the Qinghai-Tibet plateau have implications for germplasm conservation. Pharmaceutical Crops, 2014, 5(1): 1-8.
22 Song J Y, Shi L, Li D, et al. Extensive pyrosequencing reveals frequent intra-genomic variations of internal transcribed spacer regions of nuclear ribosomal DNA. Plos One, 2012, 7(8): 43971.
23 高宁,程玉鹏,王振月等.药用植物种质资源鉴定中的分子技术.中医药学报, 2008, 36(3): 61-64.
24 Song J Y, Yao H, Li Y, et al. Authentication of the family Polygonaceae in Chinese Pharmacopoeia by DNA barcoding. J Ethnopharmacol, 2009, 124(3): 434–439.
25 Chen S L, Pang X H, Song J Y, et al. A renaissance in herbal medicine identification:from morphology to DNA. Biotechnol Adv, 2014, 32(7):1237-1244.
Identification of Alisma plantago-aquatica Seeds Based on Traditional Chinese Medicine DNA Barcoding System
This study was aimed to authenticate the Alisma plantago-aquatica seeds from different producing areas with the Traditional Chinese Medicine (TCM) DNA barcoding system. The total genomic DNA was extracted using plant DNA extraction kit. The internal transcribed spacer 2 (ITS2) regions were amplified and sequenced. The sequences were assembled by the CodonCode Aligner 6.0.2 and analyzed by MEGA5.1. The morphological characteristics of seeds were observed using microscope. The results showed that the morphological characteristics of Alisma plantago-aquatica seeds and Alisma orientale seeds were similar. The ITS2 sequence lengths of both species were 311 bp. The GC content was 56.9%. One stable SNP (T-A) was detected at 165 bp in the ITS2 sequence. The identification results showed that 20 samples collected in Sichuan province were identified as A. plantago-aquatica, while 36 samples from other producing regions were A. orientale. It was concluded that the TCM DNA barcoding system can provide guidance for the accurate selection of Alisma plantago-aquatica seeds. This system had important application value in the cultivation of Alisma plantago-aquatica. It also provided demonstration for the identification of other TCM seeds.
DNA barcoding, Alisma plantago-quatica, Alisma orientale, seed identification, ITS2
Zhang Nana1, Xin Tianyi1, Jin Yue1, Gu Wei2, Song Jingyuan1
(1. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China; 2. Nanjing University of Chinese Medicine, Nanjing 210046, China)
10.11842/wst.2016.01.003
R931.5
A
(责任编辑:马雅静 张志华,责任译审:王 晶)
2015-06-16
修回日期:2015-12-07
* 国家自然科学基金委面上项目(81373922):基于ITS2互补碱基变化分析的中药基原物种鉴定研究,负责人:宋经元。
** 通讯作者:宋经元,本刊编委,研究员,博士生导师,主要研究方向:中药资源学。

