环境水体中甲状腺激素干扰物的研究进展*
艾 扬 王亚飞 李 剑
(北京师范大学水科学研究院,地下水污染控制与修复教育部工程研究中心,北京 100875)
甲状腺是脊椎动物体内重要的内分泌腺,其分泌的甲状腺激素在人类和动物的生理过程中发挥着重要的作用,包括调节生长、能量代谢、组织分化和发育以及维护大脑功能等[1]。MORREALE DE ESCOBAR等[2]认为在胎儿和幼儿期,生长发育高度依赖正常的甲状腺激素水平,尤其在妊娠期间正常的甲状腺激素水平对于中枢神经系统的发育是至关重要的,甲状腺激素的缺乏会造成大脑的不正常发育,导致智力低下和运动失调[3-4]。因此,维持正常的甲状腺激素水平对于机体生长发育是必需的。
甲状腺激素干扰物(TDCs)已成为继环境雌激素之后最重要的一类内分泌干扰物。TDCs能伴随人类生产、生活进入环境水体,对水生生态系统和人类健康造成威胁。ZHOU等[5]研究指出,TDCs不仅会干扰甲状腺激素的合成、甲状腺激素代谢相关酶的活性、甲状腺调节基因的表达,还可与甲状腺转运蛋白竞争性结合以及通过下丘脑-垂体-甲状腺轴的反馈调节途径干扰甲状腺激素的作用。目前,已被证实或已有证据怀疑为TDCs的环境化学物质达数百种之多。
鉴于甲状腺激素在人类生长发育中所起的重要作用以及TDCs对人类健康的重要影响,因此对TDCs的研究越来越受到国内外学者的重视,这里主要综述了环境水体中TDCs的研究进展。
1 TDCs的分类
1.1 多氯联苯(PCBs)
PCBs由于具有优良的热稳定性和绝缘性,曾作为一种工业产品大量生产并广泛应用于电力、化工等领域。但是,PCBs又是环境持久性污染物,由于其具有高毒性和高持久性,发达国家已于20世纪70年代禁止生产和使用,但是在人体组织中包括母乳、脐带和血液中仍然能检测到PCBs的存在[6]。SCHUUR等[7]的研究显示,PCBs会通过抑制甲状腺激素硫化作用而影响外周甲状腺激素代谢。人体研究实验同样显示,PCBs可引起外周甲状腺激素水平的降低,或者增加促甲状腺激素水平[8]。由于PCBs具有和甲状腺激素类似的结构,因而能影响甲状腺激素水平。BOAS等[9]604的研究显示,PCBs能与甲状腺激素竞争结合甲状腺转运蛋白,从而减少甲状腺激素的水平,干扰甲状腺激素的代谢。
1.2 邻苯二甲酸酯类(PAEs)
PAEs作为聚氯乙烯的增塑剂,已被广泛应用于玩具、食品包装材料、医用血袋和胶管、塑料瓶和个人护理品等数百种产品中。研究表明,PAEs能通过多种机制对甲状腺功能产生干扰作用[10]。吴皖珂[11]63-64的研究表明,PAEs的暴露会改变母体血清甲状腺激素水平,可能对胎儿发育造成损伤,如发生在孕早期,则会对中枢神经系统产生永久性的损伤。BREOUS等[12]研究显示,邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸二正辛酯(DNOP)会干扰钠碘转运体的转录活性,使甲状腺的碘摄取增加。另外,PAEs可和甲状腺激素竞争性结合转甲状腺激素蛋白(TTR),同时抑制TR-β基因的表达[13],[14]367。PAEs对甲状腺系统的作用机制非常复杂,仍需要更多的离体、活体实验来探索其具体的作用模式。
1.3 酚 类
壬基酚(NP)是各种洗涤剂、塑料和杀虫剂的添加剂,具有持久性和生物蓄积性。蛋白质提取物的体外实验显示,NP能抑制甲状腺过氧化物酶(TPO)的活性[15]99。奚悦等[16]发现,NP可损伤甲状腺滤泡上皮细胞的内质网和线粒体,同时可造成甲状腺功能降低。
五氯酚(PCP)主要来自生物杀虫剂、木材行业的防腐剂和皮革行业的抗真菌剂。此外,PCP也是杀虫剂六氯苯的主要代谢产物。PCP能降低母羊的四碘甲状腺原氨酸(T4)浓度[17]。在刚出生的幼儿体内,发现脐带血浆里的PCP与三碘甲状腺原氨酸(T3)、血清游离甲状腺激素(FT4)和T4结合球蛋白(TBG)呈明显的负相关关系,表明PCP能改变新生儿的甲状腺激素水平[9]602。
双酚A(BPA)主要用于生产光盘、黏合剂、粉漆、牙齿密封剂和聚碳酸酯等,已有多个国家明令禁止在婴儿奶瓶中添加BPA。目前关于BPA对于甲状腺功能影响的研究较少,且已有研究结果不统一。NIEMINEN等[18]未观察到暴露于BPA的大鼠甲状腺发生病理改变,却发现质量增加;但是,暴露于BPA污染场地的田鼠和臭鼬的甲状腺激素水平并未发生显著变化。ZOELLER等[19]发现:暴露于BPA的孕鼠所产的幼鼠的T4浓度会显著增加;BPA的暴露剂量与尿苷二磷酸葡萄糖醛酸转移酶(UDPGT)的活性呈明显的正相关关系,而UDPGT的活性增加会加快甲状腺激素的代谢。
1.4 二噁英(PCDD/Fs)
PCDD/Fs是多氯二苯并-对-二噁英和多氯二苯并呋喃的合称,共有210种化合物。它们是工业燃烧和除草剂生产过程中产生的持久性、剧毒性的环境污染物。研究表明,PCDD/Fs会干扰甲状腺激素的代谢,导致细胞异常[20]。在动物实验中,AHMED[21]发现,PCDD/Fs会降低血清甲状腺激素水平,特别是对T4的作用最明显;NISHIMURA等[22]73研究显示,PCDD/Fs会诱导成年鼠及其子代的UDPGT活性增加,同时降低肝脏脱碘酶的活性。人体实验发现,大量暴露于四氯二苯并-对-二噁英(TCDD)的越南战争退伍军人体内的促甲状腺激素水平明显高于人群平均水平[23]。目前的实验数据表明,PCDD/Fs主要通过干扰甲状腺激素的转运和代谢过程对甲状腺产生不利影响。
1.5 溴阻燃剂(BFRs)
BFRs是一种重要的化学阻燃剂,具有良好的耐热性,主要应用于塑胶及纺织品的防火。BFRs包括多种不同种类的化合物,如四溴双酚A(TBBPA)、多溴联苯醚(PBDEs)和多溴联苯(PBBs)等。TBBPA、PBDEs与PCBs相比,结构更加类似于T4。TBBPA是BPA的卤代衍生物,作为阻燃剂广泛用于诸如电视机、计算机、复印机和激光打印机等电气设备中。一般认为TBBPA是安全的阻燃剂,因为它不会在环境中积累,也不具有高毒性,但KITAMURA等[24]发现,TBBPA在一定浓度范围内表现出拟甲状腺激素活性。幼鼠在5 mg/kg的TBBPA中暴露16 d后,血清中促甲状腺激素明显上升,但甲状腺激素没有显著变化[25]。PBDEs是广泛用于塑料、涂料、电器部件和合成纺织品里的阻燃剂。居颖[26]发现,暴露于PBDEs中可引起血清中FT4浓度降低,促甲状腺激素水平升高,而且PBDEs还可能影响人体甲状腺激素受体(TR)的表达。由于BFRs种类繁多并在世界范围内广泛使用,因此其对人体特别是胎儿和婴幼儿的甲状腺功能影响还需要进一步研究。
1.6 其他TDCs
环境中的TDCs除上述5类外,还包括其他一些有机化合物,如有机氯农药(OCPs)、丙硫氧嘧啶、盐酸胺碘酮(AH)、某些烷烃及卤代烷烃等。此外,一些无机离子也会抑制T3和TR的结合,如Zn2+、Cu2+、Cd2+等[27]。FREAKE等[28]报道,Zn2+对于调节TR介导的基因转录具有至关重要的作用。由于环境中污染物种类繁多,目前已发现的TDCs非常有限,特别是对于无机化合物的TDCs活性研究较少,仍需要进一步深入研究。
2 TDCs的作用机制
甲状腺通过下丘脑和垂体的微调负反馈机制来维持血清中相对稳定的甲状腺激素水平[11]71。环境中的TDCs可引起下丘脑-垂体-甲状腺轴功能异常,而下丘脑-垂体-甲状腺轴是维持甲状腺激素动态平衡的关键控制系统,从而导致甲状腺激素的合成、分泌和代谢过程失调[29]824。根据现有研究进展,将TDCs干扰机制归纳为以下几种主要方式。
2.1 干扰甲状腺激素的合成和分泌
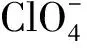
2.2 干扰甲状腺激素的转运过程
TTR是唯一一种在大脑中合成的甲状腺激素结合蛋白,在机体内的主要作用是作为转运蛋白参与甲状腺激素的转运,维持甲状腺激素的正常水平[35]。由于BFRs、PCBs、酚类和PAEs等TDCs与甲状腺激素结构类似,因而能与TTR发生竞争性结合,阻止T4与TTR结合,使血液中的FT4浓度增大,从而导致T4吸收代谢增强,降低血液中的T4浓度,最终干扰甲状腺激素的运载过程[36]。MEERTS等[37]的体外实验证实,部分BFRs与TTR有很强的结合能力,其在体内可能通过与血清TTR竞争性结合而引起甲状腺激素水平的变化,其中,TBBPA与TTR的结合能力是BFRs中最强的。王艳萍等[38]的研究证实,PCBs也可与血浆TTR结合,导致胎儿发生甲状腺激素缺乏引起的发育障碍,羟基化的PCBs则可与TTR完全结合,导致血液内游离甲状腺激素大大增多,引起甲状腺激素的循环水平降低[39]35-36。
2.3 干扰TR基因的表达
在大脑中,甲状腺激素参与少突胶质细胞的生长、髓鞘形成以及浦肯野细胞树突的延长,甲状腺激素必须与细胞内的TR结合才能实现信号的转导[40],但是TDCs的存在对机体内TR的表达有明显的干扰作用。SEIWA等[41]的研究显示,用BPA处理48 h后,少突胶质前体细胞和少突细胞中的TR-β1水平显著下降,表明BPA抑制了T3诱导少突胶质前体细胞的分化。另外,二环己基、BBP和PCP都能抑制TR-β基因的表达[14]370,从而干扰中枢神经系统的发育。
JANOSEK等[42]发现,TDCs可影响T3与TR的结合和信号传递过程,主要的作用方式包括与TR结合、与TR共调节蛋白相互作用、改变TR磷酸化3种。例如,PBDEs能与TR发生竞争性结合;PCBs能干扰TR/维甲酸X受体(RXR)复合物与甲状腺激素反应元件(TRE)结合,从而抑制TR介导的转录过程[29]827;AH会干扰甲状腺激素与TR结合,抑制甲状腺激素功能的发挥,从而引起甲状腺功能的紊乱[43]671。
2.4 干扰甲状腺激素的代谢
甲状腺激素在体内代谢的主要方式是脱碘,而脱碘酶在这一过程中发挥着重要的作用。脱碘酶能控制甲状腺激素在不同器官的转换,并能催化体内甲状腺激素的代谢过程[11]72,同时脱碘酶能有效地控制甲状腺组织内T3和T4的浓度以及T3/T4。近年来的研究发现,环境中的TDCs会干扰脱碘酶的活性从而干扰甲状腺激素的代谢过程。WADE等[44]通过体外实验证实,OCPs、Pb和Cd的混合物能抑制5’-脱碘酶的活性。吴源等[45]的研究发现,Hg能抑制脱碘酶的活性使体内T4浓度明显增加。TBBPA可抑制红鲫(Carassiusauratus)血清中甲状腺激素与TTR的结合,从而引起甲状腺激素代谢加快,导致肝脏DI2和DI3活性的升高[39]42。NISHIMURA等[22]78-81的研究表明,TCDD能增强成年大鼠和子代幼鼠体内UDPGT的活性,降低肝脏和肾脏中5’-脱碘酶的活性,并具有剂量依赖性。刘园园[46]发现,六溴环十二烷(HBCD)和PBDEs的复合物能通过改变脱碘酶的活性来影响甲状腺激素的代谢过程从而影响机体内甲状腺激素水平的稳态。
3 环境水体中TDCs的生物检测方法
环境水体中TDCs的检测方法通常包括化学分析法和生物检测法。化学分析法主要适用于已知TDCs的检测,如LUKS BETLEJ等[47]利用固相微萃取、气相色谱/质谱联用(GC/MS)法来检测水体中的PAEs。化学分析法测试精准,但仪器昂贵,操作复杂,而且不能直接给出环境水体甲状腺激素干扰活性。生物检测法具有简捷、经济、快速、高效的优点,并且能直接表征环境水体甲状腺激素干扰活性,评价潜在的生态和健康毒性效应。因此,重点论述生物检测法在环境水体中的应用。根据测试对象不同,生物检测法又可分为活体检测法和离体检测法两种。
3.1 活体检测法在环境水体TDCs检测中的应用
活体检测法主要通过测定暴露生物体内甲状腺激素水平、观察甲状腺组织改变等来表征甲状腺激素干扰活性。目前的研究对象主要集中在鱼类,通过观察其形态学、组织病理学、生殖和特定生化指标的变化对TDCs进行检测和评价。
除鱼类实验外,有研究报道采用两栖动物的变态实验来检测水体中的TDCs。MITSUI等[50]于2006年建立了热带爪蟾(X.tropicalis)变态实验检测TDCs的方法;OKA等[51]利用日本粗皮蛙(Ranarugosa)的变态实验来检测TDCs。两栖动物的变态过程依赖于甲状腺激素的调控,因此对TDCs非常敏感,可以用来检测环境水体中的TDCs水平。然而目前关于两栖动物的活体实验开展还较少,有待进一步的发展。
3.2 离体检测法在环境水体TDCs检测中的应用
目前对环境水体中TDCs的离体检测法主要有基于细胞的检测方法和基于双杂交酵母系统的检测方法两种。相比于活体检测法,离体检测法具有更快速、高效的特点。
3.2.1 基于细胞的检测方法
细胞增殖实验中所用的细胞系富含TR,具有甲状腺激素依赖性增殖的特点,可应用于环境水体中TDCs的检测。目前主要采用大鼠垂体瘤细胞GH3的增殖实验来检测TDCs。研究显示,PAEs、NP、BFRs等化合物可以通过与T3的作用干扰GH3的细胞增殖[52]。除了GH3细胞株,大鼠甲状腺瘤细胞系中的FRTL-5、WRT、PCC13也被用于检测水中的TDCs。潘红梅[53]研究发现,FRTL-5细胞的甲状腺激素合成相关基因、蛋白和细胞摄碘能力等均有可用于甄别环境中的TDCs干扰活性。
将细胞进行改造后应用于TDCs的检测被称为受体报告基因实验。SUN等[54]的研究表明,受体报告基因实验不仅能检测TDCs与受体的结合能力,还可以反映结合后引起的生物学效应,而且能区分诱导剂和抑制剂,因此现在已经成为环境水体TDCs筛选的有力工具。王晓祎等[55]将水源水与5 nmol/L T3共同作用于非洲绿猴肾CV-1细胞受体报告基因,在25~100的浓缩倍数下,检测到了显著的拟甲状腺激素活性。SHI等[56]通过CV-1细胞受体报告基因实验发现,在长江三角洲地区所采集的14个地下水样中,有12个地下水样显示出明显的TR抑制活性,邻苯二甲酸二正丁酯(DNBP)、邻苯二甲酸二异丁酯(DIBP)和DNOP为主要的致毒化合物。
3.2.2 基于双杂交酵母系统的检测方法
双杂交酵母系统主要包括TR-TIF2双杂交酵母测评系统和TR-GRIP1双杂交酵母测评系统两种[57]528。双杂交酵母系统的构建是将TR基因和受体共激活因子基因共转导进入酵母细胞中,形成重组TR基因双杂交酵母。以TR-GRIP1双杂交酵母为例,其共激活因子蛋白为GRIP1,该蛋白能参与TR介导的基因表达,而且能更真实地模拟生物体内的效应[58]。
双杂交酵母系统检测环境水体中TDCs干扰活性的原理如下:TDCs与TR结合形成复合物,该复合物结合受体共激活因子蛋白,从而启动报告基因表达,通过测定报告基因LacZ表达产物β-半乳糖苷酶活性表征TDCs的干扰活性[59]。李剑等[57]528发现,T3对TR-GRIP1双杂交酵母酶活性诱导的半数致死浓度(EC50)为1.1×10-7mol/L,最大效应摩尔浓度为5.0×10-6mol/L。CHEN等[60]利用双杂交酵母系统对54个地表水样进行监测,发现只有1个水样显示出TR诱导活性,而13个水样显示出强烈的TR抑制活性。通过对北京地区污水处理厂TDCs的活性研究发现,污水处理的整个过程中都有TR抑制活性,其中高碑店污水处理厂AH当量摩尔浓度为2.35×10-8~6.19×10-7mol/L,卢沟桥污水处理厂AH当量摩尔浓度为3.76×10-8~8.75×10-8mol/L,但是没有发现TR诱导活性[43]673-674。同样,在北京官厅水库水样中也未发现TR诱导活性,但是官厅水库的水样均有TR抑制活性,AH当量质量浓度为21.2~313.9 μg/L[61]。
由于基于双杂交酵母系统的检测方法操作简单、经济、高效,目前已广泛应用于环境水体中TDCs的筛选和TDCs干扰效应检测。
4 展 望
甲状腺激素在人和动物的生长发育过程中起着重要的作用,但释放到环境中的TDCs会干扰甲状腺系统的正常生理功能,对人和动物的生存和健康及物种的繁衍构成巨大的威胁。虽然目前国内外已经对TDCs的致毒机制开展了一些工作,但是尚不深入,而且环境中有越来越多的TDCs被发现。今后应该从以下几个方面开展更深入的研究工作:
(1) 由于TDCs的种类多样性和作用机制的复杂性,TDCs对甲状腺激素的干扰机制仍不明确,因此其作用机制的研究将是未来一段时间内研究的重点和难点。
(2) 对于环境中的TDCs的检测现在仍以复杂、昂贵的仪器分析方法为主,缺乏快速、灵敏、经济、高效的生物检测法。
(3) 由于环境中的TDCs呈现低剂量长期暴露的特征,导致TDCs的表征和评价十分困难,因此在低剂量条件下进行风险评价将是另一个重点研究方向。
(4) 进行大范围的流行病学调查,以进一步确定TDCs的暴露与有关疾病的相关程度。
[1] ROSE C S.Integrating ecology and developmental biology to explain the timing of frog metamorphosis[J].Trends in Ecology & Evolution,2005,20(3):129-135.
[2] MORREALE DE ESCOBAR G,OBREGON M J,ESCOBAR DEL REY F.Role of thyroid hormone during early brain development[J].European Journal of Endocrinology,2004,151(3):25-37.
[3] AHMED O M,EL GAREIB A W,EL BAKRY A M,et al.Thyroid hormones states and brain development interactions[J].International Journal of Developmental Neuroscience,2008,26(2):147-209.
[4] NANDI MUNSHI D,TAPLIN C E.Thyroid-related neurological disorders and complications in children[J].Pediatric Neurology,2015,52(4):373-382.
[5] ZHOU Jingming,QIN Zhanfen,LIN Cong,et al.Research progress of the endocrine disrupting activities of polychlorinated biphenyls[J].Chinese Science Bulletin,2004,49(3):215-219.
[6] 杨方星,徐盈.多氯联苯的羟基化代谢产物及其内分泌干扰机制[J].化学进展,2005,17(4):740-748.
[7] SCHUUR A G,BROUWER A,BERGMAN Å,et al.Inhibition of thyroid hormone sulfation by hydroxylated metabolites of polychlorinated biphenyls[J].Chemico-Biological Interactions,1998,109(1/2/3):293-297.
[8] SCHELL L M,GALLO M V,DENHAM M,et al.Relationship of thyroid hormone levels to levels of polychlorinated biphenyls,lead,p,p’-DDE,and other toxicants in Akwesasne Mohawk youth[J].Environmental Health Perspectives,2008,116(6):806-813.
[9] BOAS M,FELDT RASMUSSEN U,SKAKKEBK N E,et al.Environmental chemicals and thyroid function[J].European Journal of Endocrinology,2006,154(5).
[10] 陈晨,孙增荣,汤乃军.邻苯二甲酸酯类化合物对男性生殖健康影响的研究进展[J].环境与健康杂志,2009,26(10):934-937.
[11] 吴皖珂.孕妇血清邻苯二甲酸单酯水平与甲状腺功能关联研究[D].合肥:安徽医科大学,2014.
[12] BREOUS E,WENZEL A,LOOS U.The promoter of the human sodium/iodide symporter responds to certain phthalate plasticisers[J].Molecular and Cellular Endocrinology,2005,244(1/2):75-78.
[13] IWASAKI T,MIYAZAKI W,TAKESHITA A,et al.Polychlorinated biphenyls suppress thyroid hormone-induced transactivation[J].Biochemical and Biophysical Research Communications,2002,299(3):384-388.
[14] SUGIYAMA S,SHIMADA N,MIYOSHI H,et al.Detection of thyroid system-disrupting chemicals using in vitro and in vivo screening assays inXenopuslaevis[J].Toxicological Sciences,2005,88(2).
[15] SCHMUTZLER C,HAMANN I,HOFMANN P J,et al.Endocrine active compounds affect thyrotropin and thyroid hormone levels in serum as well as endpoints of thyroid hormone action in liver,heart and kidney[J].Toxicology,2004,205(1/2).
[16] 奚悦,李德华,单伟.壬基酚对大鼠甲状腺功能和超微结构的影响[J].毒理学杂志,2010,24(5):401-404.
[17] BEARD A P,RAWLINGS N C.Thyroid function and effects on reproduction in ewes exposed to the organochlorine pesticides lindane or pentachlorophenol (PCP) from conception[J].Journal of Toxicology and Environmental Health,Part A,1999,58(8):509-530.
[18] NIEMINEN P,LINDSTRÖM SEPPP,JUNTUNEN M,et al.In vivo effects of bisphenol A on the polecat (Mustelaputorius)[J].Journal of Toxicology and Environmental Health,Part A,2002,65(13):933-945.
[19] ZOELLER R T,BANSAL R,PARRIS C.Bisphenol-A,an environmental contaminant that acts as a thyroid hormone receptor antagonist in vitro,increases serum thyroxine,and alters RC3/neurogranin expression in the developing rat brain[J].Endocrinology,2005,146(2):607-612.
[20] 杨永滨,郑明辉,刘征涛.二噁英类毒理学研究新进展[J].生态毒理学报,2006,1(2):105-115.
[21] AHMED R G.Early weaning PCB 95 exposure alters the neonatal endocrine system:thyroid adipokine dysfunction[J].Journal of Endocrinology,2013,219(3):205-215.
[22] NISHIMURA N,MIYABARA Y,SATO M,et al.Immunohistochemical localization of thyroid stimulating hormone induced by a low oral dose of 2,3,7,8-tetrachlorodibenzo-p-dioxin in female Sprague-Dawley rats[J].Toxicology,2002,171(2/3).
[23] PAVUK M,SCHECTER A J,AKHTAR F Z,et al.Serum 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) levels and thyroid function in Air Force veterans of the Vietnam War[J].Annals of Epidemiology,2003,13(5):335-343.
[24] KITAMURA S,JINNO N,OHTA S,et al.Thyroid hormonal activity of the flame retardants tetrabromobisphenol A and tetrachlorobisphenol A[J].Biochemical and Biophysical Research Communications,2002,293(1):554-559.
[25] 陈玛丽,刘青坡,施华宏.四溴双酚-A的甲状腺激素干扰活性研究进展[J].环境与健康杂志,2008,25(10):937-939.
[26] 居颖.电子垃圾污染对当地居民内分泌干扰效应研究[D].武汉:华中科技大学,2008.
[27] SURKS M,RAMIREZ I J,SHAPIRO L E,et al.Effect of zinc(Ⅱ) and other divalent cations on binding of 3,5,3’-triiodo-L-thyronine to nuclear receptors from cultured GC cells[J].The Journal of Biological Chemistry,1989,264(17):9820-9826.
[28] FREAKE H C,GOVONI K E,GUDA K,et al.Actions and interactions of thyroid hormone and zinc status in growing rats[J].The Journal of Nutrition,2011,131(4):1135-1141.
[29] 杨皓月,李丕鹏,陆宇燕.环境污染物对脊椎动物甲状腺及甲状腺激素影响的研究现状[J].环境化学,2012,31(6).
[30] RYU K Y,SENOKOZLIEFF M E,SMANIK P A,et al.Development of reverse transcription-competitive polymerase chain reaction method to quantitate the expression levels of human sodium iodide symporter[J].Thyroid,2009,9(4):405-409.
[31] BRAVERMAN L E,HE Xuemei,PINO S,et al.The effect of perchlorate,thiocyanate,and nitrate on thyroid function in workers exposed to perchlorate long-term[J].The Journal of Clinical Endocrinology & Metabolism,2005,90(2):700-706.
[32] TONACCHERA M,PINCHERA A,DIMIDA A,et al.Relative potencies and additivity of perchlorate,thiocyanate,nitrate,and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter[J].Thyroid,2004,14(12):1012-1019.
[33] 彭开良,蒋芸,赵素丽,等.过氯酸铵对大鼠甲状腺的毒作用[J].中华劳动卫生职业病杂志,2003,21(6):404-407.
[34] BROWN S B,ADAMS B A,CYR D G,et al.Contaminant effects on the teleost fish thyroid[J].Environmental Toxicology and Chemistry,2004,23(7):1680-1701.
[35] 彭晨.转甲状腺素蛋白在肿瘤研究中的进展[D].蚌埠:蚌埠医学院,2014.
[36] 严茂胜.PCB153、p,p’-DDE单独及联合对新生期大鼠甲状腺激素的干扰作用及机制探讨[D].武汉:华中科技大学,2013.
[37] MEERTS I A T M,VAN ZANDEN J J,LUIJKS E A C,et al.Potent competitive interactions of some brominated flame retardants and related compounds with human transthyretin in vitro[J].Toxicological Sciences,2000,56(1):95-104.
[38] 王艳萍,洪琴,郭凯,等.多氯联苯暴露对斑马鱼胚胎发育的毒性效应[J].南京医科大学学报(自然科学版),2010,30 (11):1537-1541.
[39] 瞿璟琰,施华宏,刘青坡,等.四溴双酚-A和五溴酚对红鲫甲状腺激素和脱碘酶的影响[J].环境科学学报,2008,28(8).
[40] 刘浩华.农药内分泌干扰物对鲫鱼血清激素的影响研究[D].上海:上海交通大学,2008.
[41] SEIWA C,NAKAHARA J,KOMIYAMA T,et al.Bisphenol A exerts thyroid-hormone-like effects on mouse oligodendrocyte precursor cells[J].Neuroendocrinology,2004,80(1):21-30.
[42] JANOSEK J,HILSCHEROVA K,BLAHA L,et al.Environmental xenobiotics and nuclear receptors - interactions,effects and in vitro assessment[J].Toxicology in Vitro,2006,20(1):18-37.
[43] LI Na,MA Mei,RAO Kaifeng,et al.In vitro thyroid disrupting effects of organic extracts from WWTPs in Beijing[J].Journal of Environmental Sciences,2011,23(4).
[44] WADE M G,PARENT S,FINNSON K W,et al.Thyroid toxicity due to subchronic exposure to a complex mixture of 16 organochlorines,lead,and cadmium[J].Toxicological Sciences,2002,67(2):207-218.
[45] 吴源,周群芳.甲基汞对幼年大鼠认知及甲状腺激素的干扰效应[J].环境与健康杂志,2010,27(10):853-856.
[46] 刘园园.六溴环十二烷及其复合污染脑发育期暴露对大鼠甲状腺激素代谢过程的影响[D].上海:东华大学,2012.
[47] LUKS BETLEJ K,POPP P,JANOSZKA B,et al.Solid-phase microextraction of phthalates from water[J].Journal of Chromatography A,2001,938(1/2):93-101.
[48] LIU Fujun,WANG Jiasheng,THEODOTAKIS C W.Thyrotoxicity of sodium arsenate,sodium perchlorate,and their mixture in zebrafishDaniorerio[J].Environmental Science & Technology,2006,40(10):3429-3436.
[49] 陈玛丽.四溴双酚-A对鱼类的毒性效应[D].上海:华东师范大学,2008.
[50] MITSUI N,FUJII T,MIYAHARA M,et al.Development of metamorphosis assay usingSiluranatropicalisfor the detection of thyroid system-disrupting chemicals[J].Ecotoxicology and Environmental Safety,2006,64(3):281-287.
[51] OKA T,MIYAHARA M,YAMAMOTO J,et al.Application of metamorphosis assay to a native Japanese amphibian species,Ranarugosa,for assessing effects of thyroid system affecting chemicals[J].Ecotoxicology and Environmental Safety,2009,72(5):1400-1405.
[52] GHISARI M,BONEFELD JORGENSEN E C.Impact of environmental chemicals on the thyroid hormone function in pituitary rat GH3 cells[J].Molecular and Cellular Endocrinology,2005,244(1/2):31-41.
[53] 潘红梅.应用FRTL-5细胞建立环境化学物的甲状腺激素干扰活性甄别方法及其干扰机制研究[D].成都:四川大学,2007.
[54] SUN Hong,XU Xiaolin,QU Jianhua,et al.4-Alkylphenols and related chemicals show similar effect on the function of human and rat estrogen receptor α in reporter gene assay[J].Chemosphere,2008,71(3):582-588.
[55] 王晓祎,张哲海,胡伟,等.利用报告基因试验检测饮用水源水的内分泌干扰活性[J].生态毒理学报,2009,4(5):669-674.
[56] SHI Wei,ZHANG Fengxian,HU Guanjiu,et al.Thyroid hormone disrupting activities associated with phthalate esters in water sources from Yangtze River Delta[J].Environment International,2012,42(4):117-123.
[57] 李剑,饶凯峰,马梅,等.核受体超家族及其酵母双杂交检测技术[J].生态毒理学报,2008,3(6).
[58] DING Xiufen,ANDERSON C M,MA Han,et al.Nuclear receptor-binding sites of coactivators glucocorticoid receptor interacting protein 1 (GRIP1) and steroid receptor coactivator 1 (SRC-1):multiple motifs with different binding specificities[J].Molecular Endocrinology,1998,12(2):302-313.
[59] 李剑,任姝娟,马梅,等.改进型重组基因酵母TR-GRIP1检测化合物甲状腺激素干扰活性[J].环境科学研究,2011,24(10):1172-1177.
[60] CHEN C H,CHOU P H,KAWANISHI M,et al.Occurrence of xenobiotic ligands for retinoid X receptors and thyroid hormone receptors in the aquatic environment of Taiwan[J].Marine Pollution Bulletin,2014,85(2):613-618.
[61] 李剑,任姝娟,李沫蕊,等.北京官厅水库水体甲状腺激素干扰效应检测及特征[J].中国环境科学,2014,34(7):1884-1889.

