两种石油烃降解菌的鉴定及其对石油烃底物的降解*
刘 虹 杨元元 刘 娜# 宋清泉 温 钢 付 净 翦英红(.吉林化工学院资源与环境工程学院,吉林 吉林 0;.吉林大学环境与资源学院,吉林 长春 00;.吉林化工学院生物与食品工程学院,吉林 吉林 0)
人类在石油生产、贮运、炼制加工及使用过程中,不可避免地造成石油烃的溢出和排放,使得土壤及水体环境受到石油烃污染[1-2]。石油烃污染的环境修复越来越成为人们关注的问题。其中,物理、化学方法修复石油烃污染虽然可以得到较好的效果,但因造价高、二次污染等问题使其应用受到限制[3]。石油中含有的绝大部分烃类均可被微生物代谢降解,因此石油烃的微生物降解成为石油烃污染修复的主要手段之一[4-5]。
石油烃是一种复杂的混合物,含有多种烃类,主要有烷烃类(正烷烃、支链烷烃)、芳香烃、脂环烃等[6]。在实际石油烃污染环境的微生物修复中,不同种属的微生物对石油烃的降解能力不同,且降解的石油烃成分也不尽相同。目前已报道的烷烃降解细菌主要有假单胞菌[7-8]、不动杆菌[9]、诺卡氏菌[10]、红球菌[11]等,而关于木糖氧化无色杆菌降解石油在国内鲜有报道[12],且木糖氧化无色杆菌与其他石油降解菌的混合菌协同降解石油烃方面的报道也未多见。本研究对石油污染场地筛选出的两种单菌进行16S rDNA碱基序列分析及系统发育分类鉴定,并研究了铜绿假单胞菌和木糖氧化无色杆菌及其混合菌对石油烃底物的降解,为石油烃污染环境的微生物修复提供基础数据和理论支持。
1 实验部分
1.1 主要仪器设备
气/质联机2014型(日本岛津)、HYG-A全温振荡器、手提式压力蒸汽灭菌器、LD4-2A型医用离心机、SP-DJ系列垂直净化工作台、LRH-25A型生化培养箱、pH计、PTC-200型聚合酶链反应(PCR)仪等。
1.2 实验菌株
对松原油田石油污染土壤(表层0~30 cm)进行采样,然后以石油烃为唯一碳源,经富集筛选、分离培养后所得实验菌株,分别命名为A6菌和A10菌。
1.3 培养基
无机盐液体培养基:(NH4)2SO42 000 mg/L,K2HPO41 550 mg/L,NaH2PO4850 mg/L,MgCl2·6H2O 100 mg/L,乙二胺四乙酸(EDTA) 10 mg/L,FeSO4·7H2O 5.0 mg/L,ZnSO4·7H2O 2.0 mg/L,MnCl2·2H2O 1.0 mg/L,CaCl2·2H2O 1.0 mg/L,CoCl2·6H2O 0.4 mg/L,NaMoO4·2H2O 0.2 mg/L,CuSO4·5H2O 0.2 mg/L。
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.2。
1.4 石油烃测定分析方法
参考美国环境保护署8270C方法,采用液-液萃取—气相色谱/质谱联用技术(GC/MS)进行石油烃浓度定性、定量分析。GC条件:汽化室温度为280 ℃;色谱柱为RTX-5MS石英毛细柱(30 m×0.32 mm×0.25 μm)。升温程序:50 ℃保持3 min,以3 ℃/min速率升至100 ℃,以5 ℃/min速率升至200 ℃,以8 ℃/min速率升至290 ℃,保持10 min。载气为氦气(纯度为99.999%),流量为2.0 mL/min,压力为31.2 kPa,隔膜吹扫3.0 mL/min。
MS条件:电子轰击(EI)离子源;电子能量为70 eV;传输线温度为230 ℃;离子源温度为200 ℃;检测电压为0.85 kV;扫描范围(质核比)为30~500;灯丝开启2.5 min;记录范围为30~60 min。
1.5 实验方法
1.5.1 生理生化特性测定及DNA提取方法
生理生化特性测定方法参考文献[13],DNA提取方法参考文献[14]。
1.5.2 16S rDNA引物、PCR扩增及序列测定
16S rDNA基因的PCR扩增引物:上游引物5’-CAGAGTTTGATCCTGGCT-3’;下游引物5’-AGGAGGTGATCCAGCCGCA-3’。
PCR扩增条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共进行30个循环,最后72 ℃延伸 10 min。取5 μL反应液与1 μL缓冲液混合,在1%(质量分数)的琼脂糖凝胶中150 V电压下电泳检测。
引物合成及PCR产物测序由上海生工生物工程技术有限公司完成。
1.5.3 石油烃的降解
于19个锥形瓶中分别加入50 mL的无机盐液体培养基、200 mg 0#柴油。其中1个样品不加菌做空白对照,其余18个样品每6个加入10 mL同种石油烃降解菌(A6菌、A10菌、混合菌(A6菌和A10菌质量比为1∶1))培养液(吸光度(OD600)约为0.6),于120 r/min、30 ℃下振荡培养6 d。每隔1天取3个加入菌株后的样品,分别加入10 mL正己烷进行萃取。萃取后的有机相经无水硫酸钠干燥后,用GC测定石油烃残留量,计算石油烃降解率。
其中,两种单菌及其混合菌对石油烃降解第6天的样品经取样、萃取及无水硫酸钠干燥后,进行GC/MS全扫描,与空白样品进行对照,并利用标准谱图和工作站中overlay chromatograms功能对两种单菌及其混合菌降解污染物进行识别。
2 结果与讨论
2.1 菌株生理生化特性
对A6菌、A10菌进行13项生理生化特性测试,结果见表1。
2.2 菌株16S rDNA系统发育及鉴定
菌株16S rDNA经PCR扩增后,得到长度为1 500 bp左右的基因片段,测序后将菌株16S rDNA序列输入GenBank,以Blast软件进行序列同源性比较,选择同源性大于98%的基因序列,采用Bioedit和MEGA5.0软件对A6菌和A10菌进行系统发育分析,用Neighbor-joining法构建系统发育树,500次重复检测,计算自引导值以估计系统发育树的置信度,其结果如图1、图2所示。
由图1、图2可知,A6菌与铜绿假单胞菌(Pseudomonasaeruginosa,SNP0614)进化距离较近,A10菌与木糖氧化无色杆菌(Achromobacterxylosoxidans,A22)进化距离较近,并结合生理生化特性,判定A6菌在分类学属性为假单胞菌属(Pseudomonassp.),A10菌在分类学属性为无色杆菌属(Achromobactersp.)。

表1 菌株生理生化特性测试结果1)Table 1 Physiological and biochemical characteristics of bacteria
注:1)“+”表示阳性,“-”表示阴性。

注:该比例尺为核苷酸替代率,如0.100 0就表示100个核苷酸中有10个是不同的,用来表示两个菌种的遗传距离。图2同。图1 A6菌基于16S rDNA序列的系统发育树Fig.1 Phylogenetic tree based on 16S rDNA series of A6
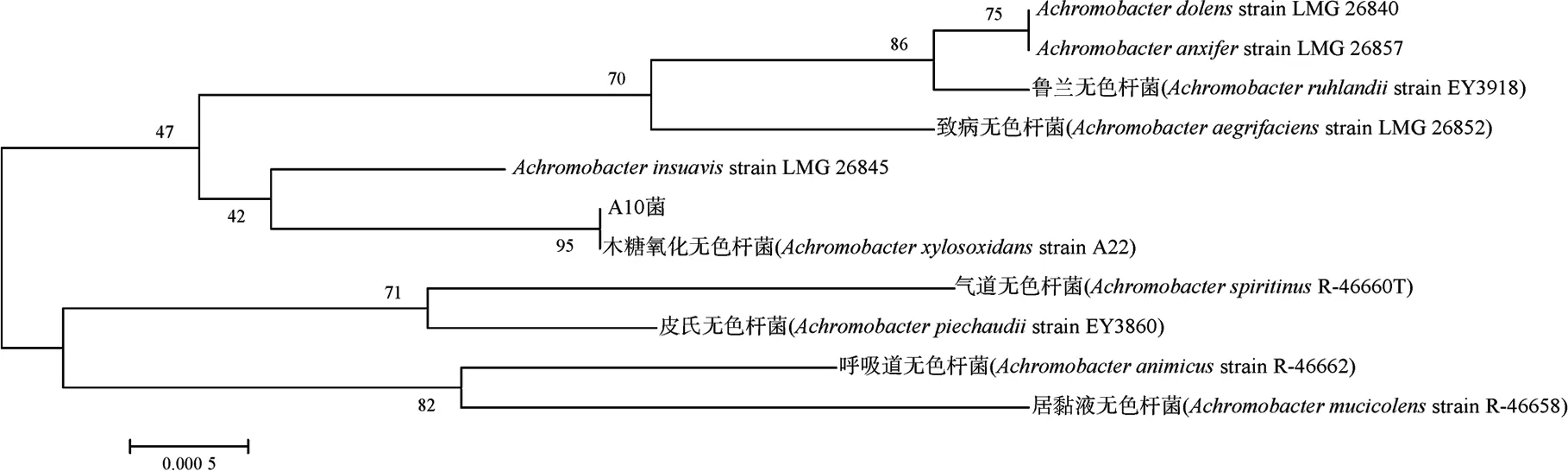
图2 A10菌基于16S rDNA序列的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA series of A10
Pseudomonasaeruginosa可产生鼠李糖脂、吩嗪类色素绿脓菌素及各种蛋白酶等胞外活性物质。其中,产生的鼠李糖脂能加快疏水性有机物的传质速度,促进菌株对分子量较大的C26~C33正构烷的降解;吩嗪类色素绿脓菌素也可促进菌株对烃类的降解。在石油烃污染环境修复中具有潜在的应用价值[15]。Achromobacterxylosoxidans是一种高效广谱降解石油烃并产生生物表面活性的菌株。目前,关于Achromobacterxylosoxidans降解石油烃在国内鲜有报道,因而,本研究鉴定并分析其降解石油烃效果拓宽了降解石油烃菌株的种类。
2.3 两种单菌及其混合菌对石油烃的降解效果
石油烃初始质量浓度为4 000 mg/L时,两种单菌及其混合菌对石油烃的降解率曲线如图3所示。
由图3可见,两种单菌及其混合菌对石油烃的降解率在初始的2 d增加较快,3 d后降解较为缓慢。这与菌株的生长相关,菌株在刚开始降解的2 d左右处于对数生长期,菌株生长较快,酶活性也较高,菌株以石油烃为唯一碳源,因此对石油烃的降解率高;3 d后,菌株生长较为缓慢,因而,降解能力逐渐降低;6 d时,两种单菌及其混合菌对石油烃的降解率分别达到90.48%、84.34%和96.90%。说明两种单菌及其混合菌对石油烃污染环境具有很强的生物修复潜力。混合菌对石油烃的降解率高于单菌,表明A6菌和A10菌可以在一定程度上互相促进,对石油烃具有协同降解能力。推测原因是菌株之间能互相利用各自合成的酶类和代谢产物,促进彼此生长,在整体上提高对石油烃的降解能力。

图3 两种单菌及其混合菌对石油烃的降解率曲线Fig.3 Petroleum hydrocarbon degradation rate curve of two single strains and mixed strain
由于石油烃是一种复杂的混合物,含有多种烃类(正烷烃、支链烷烃、芳烃、脂环烃等)。一种微生物通常只对特定的石油成分具有较强降解能力[16],往往需通过接种混合的微生物群落,以提高微生物的降解效果。因此,混合菌对石油烃的协同降解对采用微生物群落修复环境中石油烃提供了理论支持。
2.4 两种单菌及其混合菌对石油烃底物的降解
将空白组和各单菌及其混合菌降解石油烃6 d后的样品进行GC/MS全扫描后,利用标准谱图和工作站中overlay chromatograms功能对两种单菌及其混合菌降解污染物进行识别,所得空白对照和A6菌、A10菌及其混合菌降解后的石油烃样品全扫描定性对比结果如图4至图7和表2所示。
由图4至图7和表2的对比结果可知,A6菌和A10菌对石油烃底物降解的组分大致相同,两者均能完全降解大部分直链烷烃、环烷烃和支链烷烃,部分降解C9~C27正构烷烃,对难生物利用的姥鲛烷和植烷等也有一定程度的降解。说明两种单菌均具有较宽的烷烃降解谱。从降解程度来看,A6菌优于A10菌;混合菌在降解石油烃底物时,具有协同降解作用,因此混合菌对石油烃底物降解程度均优于两种单菌。混合菌除了能完全降解大部分直链烷烃、环烷烃和支链烷烃外,还对单菌不能彻底降解的支链烷烃(3,8-二甲基癸烷和2-甲基-十二烷)完全降解。上述单菌、混合菌对石油烃及底物的降解能力,为其在石油烃污染环境的生物修复提供了新的参考。

图4 石油烃色谱图(空白对照)Fig.4 Chromatograph chart of petroleum (blank control)

图5 A6菌降解石油烃色谱图Fig.5 Chromatograph chart of petroleum degraded by A6
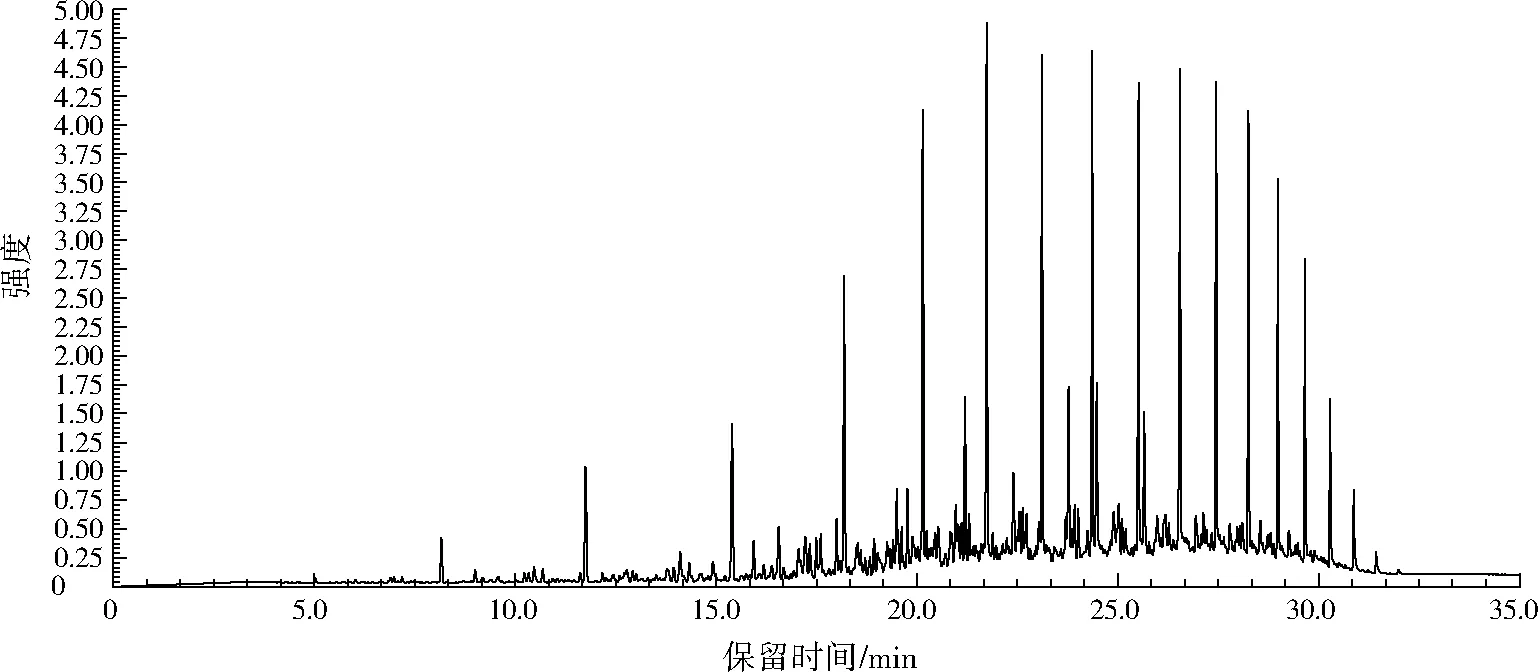
图6 A10菌降解石油烃色谱图Fig.6 Chromatograph chart of petroleum degraded by A10
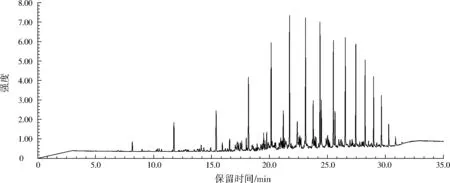
图7 混合菌降解石油烃色谱图Fig.7 Chromatograph chart of petroleum degraded by mixed strain
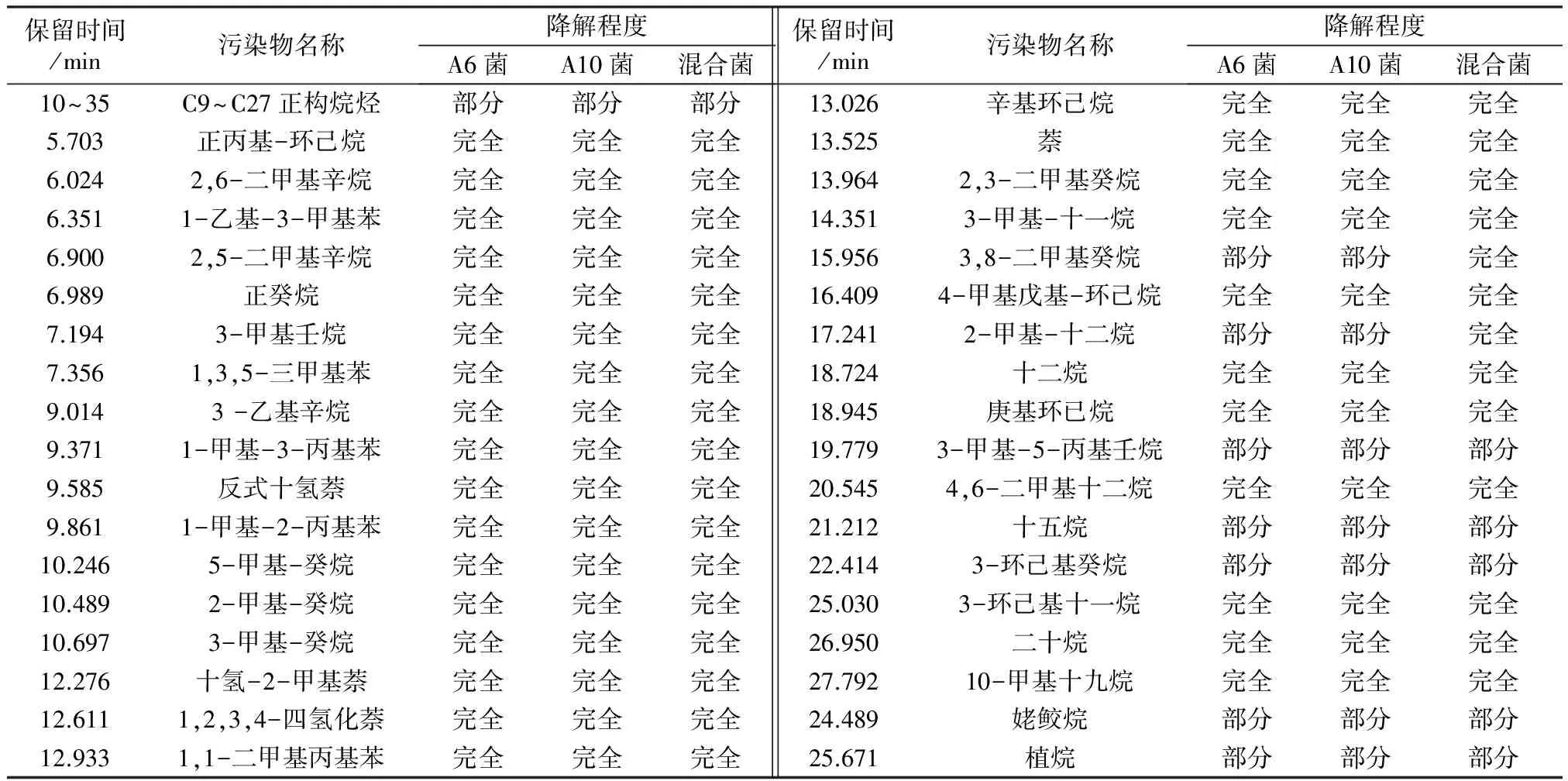
表2 两种单菌及其混合菌降解石油烃全扫描定性对比结果Table 2 The two single strains,mixed strain degradation of petroleum hydrocarbons scanning qualitative comparison results
3 结 论
(1) 采用16S rDNA技术对石油污染场地筛选出的两种单菌进行鉴定,经生理生化特性及16S rDNA鉴定两种单菌在分类学上分别属于Pseudomonassp.和Achromobactersp.。
(2) A6菌和A10菌及其混合菌对石油烃的降解率(6 d)分别达到90.48%、84.34%和96.90%,其降解效果为混合菌>A6菌>A10菌。说明Pseudomonassp.和Achromobactersp.对石油烃具有协同降解能力,同时,也显示了两种单菌及其混合菌对石油烃污染环境具有很强的生物修复潜力。
(3) A6菌和A10菌均能完全降解大部分直链烷烃、环烷烃和支链烷烃,部分降解C9~C27正构烷烃,对难生物利用的姥鲛烷和植烷等也有一定程度的降解。两种单菌的混合菌在降解石油烃底物时,具有协同降解作用,混合菌还对单菌不能彻底降解的支链烷烃(3,8-二甲基癸烷和2-甲基-十二烷)完全降解。
[1] 杨明星,杨悦锁,曹玉清,等.包气带土壤对石油烃的截留作用研究[J].环境污染与防治,2011,33(3):52-57.
[2] NADIM F,HOAG G E,LIU S,et al.Detection and remediation of soil and aquifer systems contaminated with petroleum products:an overview[J].Journal of Petroleum Science and Engineering,2000,26(1/2/3/4):169-178.
[3] 宋志文,夏文香,曹军.海洋石油污染物的微生物降解与生物修复[J].生态学杂志,2004,23(3):99-102.
[4] 刘虹,刘娜,吕静,等.3种石油烃降解菌对石油烃的降解效果及其细胞表面疏水性[J].环境污染与防治,2015,37(7):13-18.
[5] DIEZ S,SABATE J,VINAS M,et al.The prestige oil spill.Ⅰ. biodegradation of a heavy fuel oil under simulated conditions[J].Environmental Toxicology and Chemistry,2005,24(9):2203-2217.
[6] 李习武,刘志培.石油烃类的微生物降解[J].微生物学报,2002,42(6):764-767.
[7] 程守强,梁凤来,顺晓波,等.烷烃降解基因alk研究进展[J].中国生物工程杂志,2004,24(3):30-34.
[8] NORMAN R S,FRONTERA SUAU R,MORRIS P J.Variability inPseudomonasaeruginosalipopolysaccharide expression during crude oil degradation[J].Applied and Environmental Microbiology,2002,68(10):5096-5103.
[9] SAKAI Y,MAENG J H,TANI Y,et al.Use of long-chain n-alkanes (C13-C44) by an isolate,Acinetobactersp. M-1[J].Biosci. Biotechnol. Biochem.,1994,58(11):2128-2130.
[10] 曹微寰,徐德强,张亚雷,等.烷烃降解菌的筛选及其降解能力[J].中国环境科学,2003,23(1):25-29.
[11] WHYTE L G,HAWARI J,ZHOU E,et al.Biodegradation of variable-chain-length alkanes at low temperatures by a psychrotrophicRhodococcussp.[J]Applied and Environmental Microbiology,1998,64(7):2578-2584.
[12] 司美茹,赵云峰,苏涛,等.高效降解烷烃的无色杆菌XL株的分离鉴定及其降解特性[J].土壤通报,2011,42(3):562-567.
[13] 马放,任南琪,杨基先.污染控制微生物实验[M].哈尔滨:哈尔滨工业大学出版社,2002.
[14] 黄磊,李丹,孙丹,等.1株低温石油烃降解菌的分类鉴定及降解特性研究[J].环境科学,2007,28(9):2101-2105.
[15] 马霞.铜绿假单胞菌NY3胞外活性物对其降解石油烃的作用研究[D].西安:西安建筑科技大学,2014.
[16] IJAH U J J.Studies on relative capabilities of bacterial and yeast isolates from tropical soil in degrading crude oil[J].Waste Manage.,1998,18(5):293-299.

