关于SO2学习中的一些问题(2)
关于SO2学习中的一些问题(2)
◇北京王笃年
5SO2与CO2有哪些异同点?
从酸碱反应的视角看,SO2和CO2都是气态酸性氧化物,它们对应的酸都是二元酸,所以SO2与CO2在和碱反应时显示出极其相似的化学性质.比如与烧碱溶液反应,会因酸碱比例不同形成正盐、酸式盐:

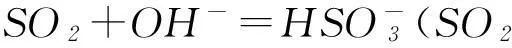

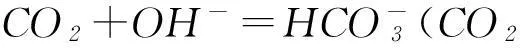
通入石灰水时,都可以先形成白色沉淀,气体过量时则因形成溶解度大的酸式盐而致沉淀溶解:
SO2+Ca2++2OH-=CaSO3↓+H2O,
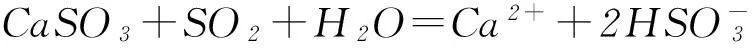
CO2+Ca2++2OH-=CaCO3↓+H2O,

不同的是,SO2对应的酸亚硫酸(Ka1=1.3×10-2,Ka2=6.3×10-8)为中强酸,而CO2对应的碳酸(Ka1=4.2×10-7, Ka2=5.6×10-11)为弱酸,前者可以把后者从其盐溶液中置换出来:


所以可利用饱和NaHCO3溶液除去混在CO2气体中的SO2气体.
(思考:NaHSO3能不能与NaHCO3溶液反应放出CO2呢?H2CO3能不能与Na2SO3溶液反应将其转化为NaHSO3呢?请根据二者的电离平衡常数作出判断.)
从氧化还原的视角来看,2种气体都具有弱的氧化性,如:
SO2+2H2S=3S↓+2H2O,


但是二者的还原性差异很大,SO2具有强的还原性:



而CO2一般情况下难以显示还原性(尽管理论上-2价的氧可以显示还原性).
6如何除去混合在其他气体中的SO2杂质?
这个问题看似简单,其实要分很多种情况分别进行处理.如前面所述,一般情况下除去混在CO2中的SO2时,采用饱和碳酸氢钠溶液洗气的方法即可,这样可以在除去杂质的同时增加主体物质CO2的量,可谓一举两得.
但是在有些特别的情境下,则不宜采用NaHCO3溶液洗气的办法.比如木炭与热的浓硫酸作用,产生CO2、SO2的混合物,要想检验确认CO2,则需要先行除去其中的SO2,因为检验CO2只能利用石灰水,而SO2也会使石灰水变浑浊.此时若采用NaHCO3溶液洗气的方法,SO2会与NaHCO3反应生成CO2,无法判断使石灰水变浑浊的是原来的CO2还是由反应生成的CO2了.这种情况下,我们可以利用SO2的还原性,使用KMnO4溶液除去,如图1所示.

图1
有机化学实验中,采用浓硫酸使乙醇脱水制取乙烯时,硫酸被乙醇还原产生的副产物SO2对乙烯的性质有非常强的干扰作用(使溴水、KMnO4溶液褪色,而检验乙烯往往正是利用溴水或KMnO4溶液),因此需要将其除去.这里办法倒是简单,根据SO2的酸性,采用一定浓度的烧碱溶液洗气即可.
需要说明的是,SO2可以与品红溶液反应使其褪色,于是有人设想能否利用品红溶液除去SO2气体,答案是否定的.实际操作中一般不用品红溶液除SO2,这是因为品红与SO2的反应十分缓慢,很难在短时间内除尽,当然,也与该反应具有可逆性有关.
7为什么SO2通入CaCl2溶液不易形成沉淀?SO2通入任何钙盐、钡盐溶液都不会产生沉淀吗?
这个问题与“为什么CO2和CaCl2溶液不形成沉淀?”相似.有些人给出的解释是“假设产生CaSO3,由于反应生成盐酸,而CaSO3溶于盐酸,会反应回去”.这种解释有些牵强,没有揭示出问题的本质.因为没有说明为什么CaSO3会溶于盐酸.如果说因为CaSO3是弱酸盐,就一定会溶于强酸溶液的话,是没有道理的,因为CuS、HgS、Ag2S等也属于弱酸盐,但不能溶解于一般的强酸溶液.反应H2S+CuSO4=CuS↓+H2SO4可以顺利发生.


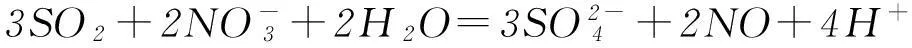
那么,能不能根据SO2通入CaCl2溶液不产生沉淀就简单推论说“SO2通入一切可溶性强酸盐溶液中都不会产生沉淀”呢?或者说,把SO2通入BaCl2溶液是否也不会产生BaSO3沉淀呢?已知BaSO3的Ksp=8.0×10-7,请读者自己推算、验证.
(作者单位:北京十一学校)
宇宙中的未解之谜——暗物质
美国女天文学家葳拉·罗宾依据已经发现的一些天文现象及人类已知的一些科学规律,提出宇宙中应该存在大量的暗物质,否则许多现象都无法解释.暗物质可能是黑洞和矮星,但暗物质中的绝大多数应该是一些不发光、不反光、不挡光的透明物质,科学家们有的说是重子物质,有的说是光子,有的说是中微子,总之,宇宙间的暗物质还是个未解之谜.

