构建一种分离培养原代小鼠肺泡Ⅱ型上皮细胞改良方法
严玉玲,周园红,叶红
(三峡大学第一临床医学院妇产科,湖北 宜昌 443000)
构建一种分离培养原代小鼠肺泡Ⅱ型上皮细胞改良方法
严玉玲,周园红,叶红
(三峡大学第一临床医学院妇产科,湖北 宜昌 443000)
目的 建立可靠稳定的小鼠肺泡Ⅱ上皮细胞(AECⅡ)的分离、原代培养技术,为进一步研究AECⅡ转分化分泌生长转化因子β1(TGF-β1)等物质与乳腺癌休眠细胞激活的相关机制奠定基础。方法采用传统的方法和改良后方法分别提取20只小鼠AECⅡ,将其所提取的细胞数量进行对比。结果传统组小鼠可获得(4.21±2.31)×106个,改良组小鼠可获得(13.0±2.20)×106个,差异有统计学意义(P<0.05),而两组小鼠在体质量、年龄以及肺组织重量方面比较差异均无统计学意义(P>0.05)。结论此改良方法可成功获得大量稳定的AECⅡ,为进一步研究AECⅡ转分化分泌TGF-β1等物质与乳腺癌休眠细胞激活的相关机制奠定基础。
小鼠肺泡Ⅱ上皮细胞;传统方法;改良方法;原代培养
肺泡Ⅱ型上皮细胞(typeⅡ alveolar epithelial cells,AEC II)是肺上皮细胞的重要组成部分,具有合成和分泌表面活性物质、参与免疫反应以及转分化等多种功能[1]。在胚胎及胎儿时期AECⅡ可增殖,但在成人期AECⅡ呈高度分化状态,正常情况下是不分裂增殖的[2]。当AECI细胞数量减少时,发现AECⅡ可转分化为肺泡Ⅰ 型上皮细胞(type I alveolar epithelial cells,AECⅠ),整个过程可能与TGF-β1传导的信号通路有关[3],目前还没有能完全替代AECⅡ的细胞株,为进一步研究AECⅡ转分化分泌TGF-β1等物质与转移乳腺癌休眠细胞激活相关机制,需分离纯化AECⅡ。
1 材料与方法
1.1 材料 健康雄性昆明种小鼠体质量约20 g,共40只(三峡大学实验动物中心)。DMEM培养基、血清(GIBCO);胰蛋白酶、Ⅰ型胶原酶、肝素钠、Dnase I (Solarbio);小鼠IgG(Beyotime);红细胞裂解液(谷歌生物);100、200目细胞筛;倒置显微镜。
1.2 方法 40只昆明种小鼠随机分为传统组与改良组,每组各20只,分别采用传统方法与改良方法分离提取并纯化AECⅡ。
1.2.1 传统方法
1.2.1.1 小鼠IgG包被培养皿 用磷酸盐缓冲液(PBS)溶液稀释小鼠IgG溶液1 mg/mL,将溶液平铺六孔板并轻晃使其完全覆盖板底(浓度0.1 mg/cm2),于37℃培养3~4 h,吸出小鼠IgG溶液,备用[4]。
1.2.1.2 小鼠AECⅡ的分离 昆明种小鼠经腹腔注射10%水合氯醛0.2~0.3 mL,麻醉后将小鼠全身浸泡于75%酒精中(避免头部以免进入肺部),在超净台中尽快打开小鼠的胸腔分离出气管,打开腹腔剪断腹主动脉放血,放血完成后止血钳夹闭近端气管,进行气管插管PBS 1 mL灌洗,反复3次,完整取下肺组织,调整重量约0.05 g,然后将0.25%胰蛋白酶跟Ⅰ型胶原酶各3 mL灌入肺泡腔(未能完全灌入的溶液浸泡肺组织即可),于37℃水浴20 min,为中止消化,随即加入与消化液等体积的DMEM培养基(含体积分数为10%胎牛血清)并混匀,尽量除去气管、血管组织、支气管,然后用剪刀将肺组织剪成1 mm×1 mm×1 mm小块(剪碎过程中加入100µL双抗);移入50 mL离心管,向悬液加入100µL Dnase I酶,混匀后37℃水浴5 min,分别经100、200目细胞筛网过滤,800 r/min离心10 min去上清,然后用红细胞裂解液3 mL重悬细胞,室温静置5~10 min后800 r/min离心5 min去上清,用DMEM培养基5 mL重悬细胞。
1.2.1.3 小鼠AECⅡ纯化与培养 将细胞悬液接种至已包被小鼠IgG备用的孔板中,置于体积分数为5%CO2、37℃培养箱内培养1 h,吸出培养基(未贴壁的细胞),800 r/min离心10 min后去上清,用DMEM培养基5 mL重悬细胞,细胞计数后接种于六孔板中,置于相同条件的培养箱内培养24 h后换液,在倒置显微镜下观察贴壁细胞的生长情况。
1.2.2 改良方法
1.2.2.1 小鼠IgG包被培养皿 用PBS溶液稀释小鼠IgG溶液1 mg/mL,将溶液平铺六孔板并轻晃使其完全覆盖板底(浓度0.1 mg/cm2),于37℃培养3~4 h,吸出小鼠IgG溶液,备用[4]。
1.2.2.2 小鼠AECⅡ的分离 昆明种小鼠经腹腔注射10%水合氯醛0.2~0.3 mL,麻醉后将小鼠全身浸泡于75%酒精中(避免头部以免进入肺部),在超净台中尽快打开小鼠的胸腔分离出气管,打开腹腔剪断腹主动脉放血,放血完成后止血钳夹闭近端气管,进行气管插管PBS 1 mL灌洗,反复3次,然后完整取下肺组织,调整重量约0.05 g,将组织浸没于预冷的PBS液中,尽量去除气管、血管组织、支气管,PBS液冲洗组织数遍后将肺组织剪成1 mm×1 mm×1 mm小块(剪碎过程加入100µL双抗);移入50 mL离心管,分别按1:1加入0.25%胰蛋白酶跟Ⅰ型胶原酶各3 mL,枪头吹打混匀后37℃水浴震荡20 min,为中止消化,向消化好的细胞悬液中加入与消化液等量的DMEM培养基,再向悬液加入Dnase I酶100µL,用枪头充分吹打混匀后37℃水浴震荡5 min,分别经100、200目细胞筛网过滤,400×g低温离心10 min弃上清,然后用红细胞裂解液3 mL重悬细胞,室温静置5~10 min后400×g低温离心5 min弃上清,用DMEM培养基5 mL重悬细胞。
1.2.2.3 小鼠AECⅡ的纯化与培养 将细胞悬液接种至已包被小鼠IgG备用的孔板中,置于体积分数为5%CO2、37℃培养箱内培养1 h,吸出培养基(未贴壁的细胞),800 r/min离心10 min后去上清,用DMEM培养基5 mL重悬细胞,细胞计数后接种于六孔板中,置于相同条件的培养箱内培养24 h后换液,在倒置显微镜下观察贴壁细胞的生长情况。
1.3 统计学方法 应用SPSS18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组小鼠一般资料比较 传统组小鼠与改良组小鼠在体质量、年龄及肺组织重量方面比较差异均无统计学意义(P>0.05),见表1。
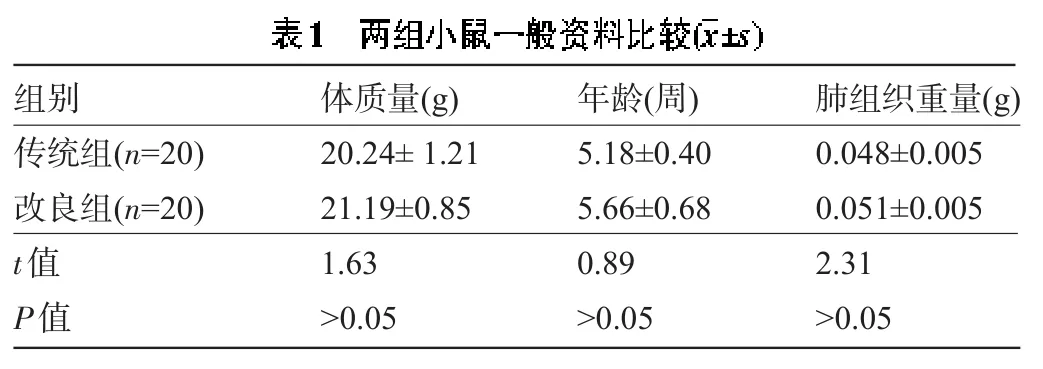
组别传统组(n=20)改良组(n=20) t值P值体质量(g) 20.24±1.21 21.19±0.85 1.63>0.05年龄(周) 5.18±0.40 5.66±0.68 0.89>0.05肺组织重量(g) 0.048±0.005 0.051±0.005 2.31>0.05
2.2 两种方法提取小鼠AECⅡ数量比较 传统组小鼠可获得(4.21±2.31)×106个,改良组小鼠可获得(13.0±2.20)×106个,差异有统计学意义(P<0.05)。
2.3 光镜观察细胞 培养的AECⅡ约16 h贴壁,细胞呈圆形或椭圆形,24 h后逐渐聚集成岛状生长,AECⅡ胞浆丰富,核仁明显,内含大量反差明显的细小颗粒(见图1)。培养约48 h后,细胞逐渐融合成细胞单层。培养大约72 h后,细胞逐渐较前变得扁平,胞内细小颗粒明显减少。培养5~6 d后,无法辨认Ⅱ型肺泡上皮细胞。

图1 倒置显微镜下培养24 h的昆明小鼠AECⅡ细胞(×100)
3 讨 论
目前酶消化法是提取原代AECⅡ的主要方法,查阅国内外文献,常用于原代细胞消化的酶有胰蛋白酶、弹性蛋白酶、胶原酶[4-5]。虽然弹性蛋白酶对AECⅡ损伤小且具有消化选择性,但因这种酶的有效作用时间有限、活性不够稳定、容易降解等问题,故本实验选择的是胰蛋白酶联合胶原酶消化法提取原代AECⅡ。
与其他原代细胞分离、培养相似,酶消化法分离AECⅡ也存在细胞聚集成团、杂细胞污染、细菌污染等问题,本实验就此做了如下改进:
在分离AECⅡ过程中,由于剪碎组织及酶对细胞的损伤会使细胞释放DNA。为防止细胞释放出来的DNA与细胞外基质形成DNA蛋白复合物,本实验采用脱氧核糖核酸酶(DnaseⅠ)来避免细胞聚集成团。
肺组织中有40多种不同的细胞。由于胰蛋白酶消化没有选择性,除AECⅡ外,还含有巨噬细胞、红细胞、成纤维细胞等杂细胞。为达到实验研究要求需将提取的AECⅡ进一步纯化。目前纯化AECⅡ的方法很多,如密度梯度离心、免疫粘附、滤膜分离、流式细胞技术。Zeng等[6]使用一种新型的微流体磁性细胞分选系统来分选肺多能干细胞,结果较为理想。本实验纯化AECⅡ的方法如下:①差速离心法去除成纤维细胞,利用AECⅡ和细胞之间的比重差异,当转速在400×g时,可使部分成纤维细胞仍悬浮于培养基而无法沉淀,从而能将部分成纤维细胞去除。传统的方法离心力转数太低,部分Ⅱ型上皮细胞无法完全沉淀,将导致细胞得率低。②免疫粘附法纯化AECⅡ,因为巨噬细胞和其他大多数非Ⅱ型细胞表面都有IgG上的Fc片段的受体,因其含有Fc片段的受体而与小鼠IgG抗体结合,吸附到板底上,不粘附的AECⅡ则不贴板底[7]。红细胞裂解液去除红细胞,虽然取肺组织之前进行了放血处理,但是AECⅡ中仍然混有红细胞,故使用红细胞裂解液裂解红细胞,但对AECⅡ并无影响。
细菌污染是原代细胞培养中普遍存在的问题。在前5次试验中,尽管采取了常规的动物消毒及无菌操作,但由于没有在剪碎组织过程中加入双抗,每次均出现细菌污染问题。为此,本实验在剪碎组织过程中加入双抗,克服了细胞被污染的难题。
此外,为进一步提高AECⅡ数量,本实验通过先剪碎组织再用酶消化(水浴震荡)方法来增加酶接触组织面积,达到充分消化的作用。Ⅱ型肺泡上皮细胞比较脆弱,在体外环境下易损伤,故整个实验过程时间最好不超过4 h,实验过程中最好使用新的剪刀,使用枪头吹打细胞时动作应轻柔,保持低温条件也是实验成功的关键[5]。
[1]Herzog EL,Brody AR,Colby TV,et al.Knowns and unknowns of the alveolus[J].Proceedings o the American Thoracic Society,2008, 5(7):778-782.
[2]Lee J,Reddy R,Barsky L,et al.Contribution of proliferation and DNA damage repair to alveolar epithelial type 2 cell recovery from hyperoxia[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2006,290(4):L685-L694.
[3]Bhaskaran M,Kolliputi N,Wang Y,et al.Trans-differentiation of alveolar epithelial typeⅡcells to typeⅠcells involves autocrine signaling by transforming growth factor β1through the Smad pathway [J].Journal of Biological Chemistry,2007,282(6):3968-3976.
[4]郑金旭.构建原代分离培养与鉴定小鼠肺泡Ⅱ型上皮细胞的方法及模型[J].中国组织工程研究与临床康复,2010,14(15): 2761-2762.
[5]Gonzalez RF,Dobbs LG.Isolation and culture of alveolar epithelial TypeⅠand TypeⅡcells from rat lungs[M].Second Edition.Epithelial Cell Culture Protocols,2013:145-159.
[6]Zeng L,Qiu L,Yang XT,et al.Isolation of lung multipotent stem cells using a novel microfluidic magnetic activated cell sorting system[J].Cell Biology International,2015,39(11):1348-1353.
[7]Chen J,Chen Z,Narasaraju T,et al.Isolation of highly pure alveolar epithelial typeⅠand typeⅡcells from rat lungs[J].Laboratory Investigation,2005,85(9):1181.
An improved method for the isolation and primary culture of mouse AECⅡ.
YAN Yu-ling,ZHOU Yuan-hong,YE Hong.Department of Gynaecology and Obstetrics,First School of Clinical Medicine,China Three Gorges University,Yichang 443000,Hubei,CHINA
ObjectiveTo establish a reliable and stable mouse typeⅡalveolar epithelial cells(AECⅡ)isolation and primary culture technology for further study in the mechanism of trans-differentiation of AECⅡto TGF-β1and to other substances associated with the activation of dormant cells of breast cancer.MethodsThe amount of mouse AECⅡextracted from both conventional group and improved group were compared.ResultsA total of(4.21±2.31)× 106mouse AECⅡwere obtained from the conventional group,while only(13.0±2.20)×106were obtained from the improved group.The difference was statistically significant(P<0.05).However,there were no statistically significant difference in the weight,age,and weight of the lung tissue between the conventional group and improved group(P>0.05).ConclusionThe improved method could gain a large quantity of stableAECⅡ,which offers a foundation for further study in the mechanism of trans-differentiation of AECⅡto TGF-β1and to other substances associated with the activation of dormant cells of breast cancer.
AECⅡ;Conventional methods;Improved method;Primary culture
R-332
A
1003—6350(2016)20—3280—03
2016-03-18)
国家自然科学基金青年基金项目(编号:81402404)
叶红。E-mail:yehong998@126.com

