人肺腺癌细胞系中肿瘤干细胞的分离培养及鉴定*
杨佳 方志红 吴建春 徐静 殷晓聆 赵凡尘 李雁
人肺腺癌细胞系中肿瘤干细胞的分离培养及鉴定*
杨佳方志红吴建春徐静殷晓聆赵凡尘李雁
摘要目的:从人肺腺癌细胞系A549及H1299中分离富集含肿瘤干细胞的细胞球并鉴定其生物学特性。方法:用无血清悬浮培养的方法从人肺腺癌A549及H1299细胞株中富集得到肿瘤细胞球。将肿瘤细胞球传代扩增,体外利用CCK-8法、平皿克隆以及Transwell小室实验,研究细胞球的增殖情况、自我更新和侵袭转移能力;通过RT-PCR检测干细胞特异性转录因子Oct4、Nanog基因表达情况;体内利用裸鼠移植瘤形成实验研究肺癌细胞球的成瘤能力。鉴定细胞球的肿瘤干细胞特性。结果:在无血清悬浮培养下,A549及H1299细胞株3~6天后能形成稳定传代的肿瘤悬浮球,悬浮球的体外自我更新、克隆形成和侵袭转移等能力均高于其亲本细胞(P<0.05);干细胞核心基因Oct4和Nanog的mRNA表达水平明显升高(P<0.05);A549悬浮球可以明显提高裸鼠体内成瘤能力。结论:通过无血清悬浮培养法可有效富集A549及H1299细胞系中的干细胞成分,该法可成为快速易行构建肺腺癌干细胞模型的方法。
关键词肺腺癌肿瘤干细胞无血清培养分离鉴定
作者单位:上海中医药大学附属上海市中医医院肿瘤科(上海市201203)
*本文课题受国家自然基金面上项目(编号:81473627)和上海市卫生局科研项目(编号:20124078)资助
肺癌是世界上最常见的恶性肿瘤之一,其中肺腺癌的比例占40%以上,尽管近些年在肺癌防治和分子靶向研究方面有了较大突破,但肺癌患者的5年生存率仍未超过17%[1]。肿瘤干细胞学说在越来越多的肿瘤中被证实和认可,该理论认为肺癌干细胞是导致肺癌快速进展、耐药和复发转移的根源,其为肺癌组织中一群数量极少但具有高致瘤性、自我更新、分化潜能和耐药性的细胞[2]。因此,研究肺癌干细胞将对肺癌的治疗产生重要意义,其第一步就是分离和富集肺癌干细胞。目前,肺癌干细胞的构建方法主要有通过特定标记物(流式或免疫磁珠)分选或功能学(SP、EMT、无血清悬浮)分选[3]等,尚无公认的针对肺癌干细胞的特异性干细胞标记物[4]。
本研究采用无血清非黏附培养法对肺腺癌细胞系A549及H1299进行分离和富集,并对富集的悬浮球进行一系列体、内外肿瘤干细胞相关实验鉴定;旨在建立一种适用于体外快速构建肺腺癌干细胞的通用方法,为肺癌干细胞的深入研究提供基础。
1 材料与方法
1.1材料
1.1.1细胞及动物人肺腺癌细胞株A549和H1299购自上海生命科学院细胞库(ATCC)。4~5周龄雄性BALB/c裸鼠购自中科院上海生命科学研究院斯莱克实验动物有限公司,生产许可证号[SCXK(沪)2012-0002],体质量18~22 g,雄性,于上海中医药大学实验动物中心SPF级实验室饲养。
1.1.2主要试剂RPMI 1640培养基、胎牛血清(FBS)、DMEM/F12培养基均购自美国Gibco公司,0.25%胰酶-EDTA(美国HyClone公司),重组人表皮生长因子(EGF)、重组人碱性成纤维生长因子(bF⁃GF)均购自美国PeproTech公司,B27(美国Invitrogen公司),重组人胰岛素购自美国Sigma公司;鼠抗人Oct4和Nanog单克隆抗体(美国Abcam公司),PVDF膜(美国Millipore公司),兔抗人GAPDH单克隆抗体(美国CST公司);鼠抗兔IgG(美国CST公司);四甲基偶氮唑盐(MTT)、DMSO(美国Sigma公司);Transwell小室(美国BD公司),Matrigel胶(美国BD公司),低黏附培养板(美国Corning公司);逆转录试剂盒及RTPCR试剂盒购自日本Takara公司。
1.2方法
1.2.1细胞培养实验分为A549及H1299贴壁细胞组和A549及H1299悬浮球组。A549及H1299贴壁细胞培养,在37℃、5%CO2培养箱内培养,培养基为含10%FBS的RPMI 1640,实验取对数生长期的细胞。
1.2.2悬浮球培养采用0.25%胰酶将对数生长期的A549和H1299细胞消化制成单细胞悬液,100 rpm/min离心5 min后弃上清,将细胞按3×104个/孔的密度,平铺到超低黏附6孔板中;每孔加无血清培养液3~4 mL,无血清培养液DMEM/F12中含20 ng/mL bFGF、20 ng/mL EGF、20 μL/mL B27,重组人胰岛素4 μg/mL。每隔2~3 d半量换液,每隔4~6 d传代,显微镜下分别观察A549及H1299细胞的成球情况,实验用第3代以后的悬浮球。
1.2.3CCK-8增殖实验分别将两种贴壁细胞和悬浮球胰酶消化后制成单细胞悬液,以细胞2×103个/孔的密度加入96孔板中,用完全培养基(RPMI 1640加10%FBS)培养,以单一培养液组作为空白组,在37℃、5%CO2条件下培养。于接种后连续6天,每隔24 h测细胞数。加入10 μL/孔CCK-8,上酶标仪检测光密度值。纵坐标为A490平均数,横坐标为天数,绘制细胞生长曲线。
1.2.4平皿克隆形成实验将A549、H1299贴壁细胞及其悬浮球胰酶消化后制成单细胞悬液,按细胞200个/孔的密度分散铺于普通6孔板中,每组3个复孔,每孔加入2 mL含血清的RPMI 1640培养基,2~3 d换液。在培养箱内培养10 d,弃培养液,加入4%多聚甲醛固定10 min后,用1%的结晶紫染色。观察形成的克隆数目,其中以>50个细胞的克隆为阳性克隆。1.2.5 Transwell侵袭小室实验将Matrigel胶和无血清培养液按1:5比例混匀成80 μL,平铺于小室底部,避免气泡产生,置于37℃培养中孵育4~5 h;取对数生长期的A549、H1299贴壁亲本细胞和A549、H1299悬浮球细胞制备单细胞悬液并计数,按每孔1×105/ 100 μL接种于Transwell小室上层,用无血清的DMEM/F12培养,下室用含15%胎牛血清的RMPI 1640培养基,放入培养箱中24 h后取出。用棉棒轻轻擦去小室上层细胞,染色固定漂洗后,于显微镜下随机取中央区的5个视野,计算浸润细胞数[5],统计结果。实验重复3次。
1.2.6RT-PCR检测收集A549、H1299贴壁细胞及其悬浮球,用Trizol法提取总RNA,按照Takara逆转录及RT-PCR试剂盒说明书操作,用2-ΔΔCT法对检测结果进行分析。实验重复3次。引物由上海生工生物工程有限公司合成。实验所需引物序列见表1。
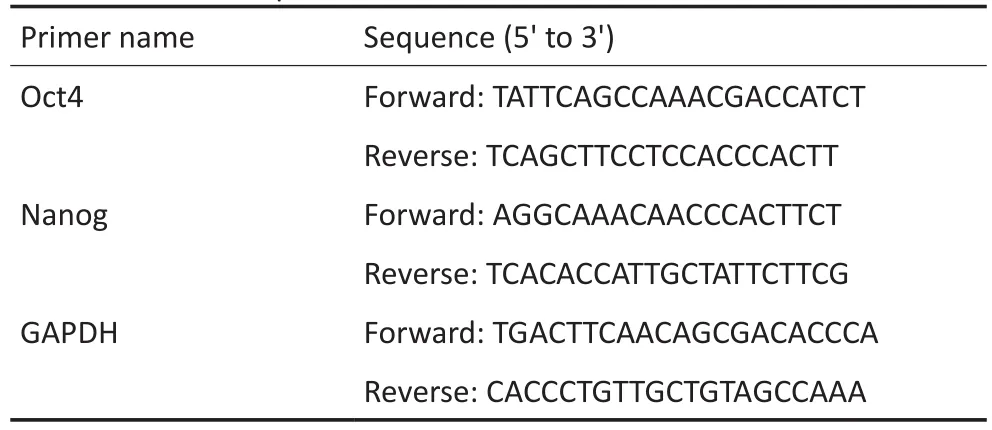
表1 引物序列Table 1 Primer sequences
1.2.7裸鼠成瘤实验4~5周龄雄性BALB/c裸鼠(购自中科院上海生命科学研究院斯莱克实验动物有限公司,生产许可证号[SCXK(沪)2012-0002],测定质量后随机分组,每组5只,将收集好的A549、H1299贴壁细胞和A549 sphere、H1299 sphere细胞悬液按照每只1×106个/200 μL(重悬于无血清DMEM/ F12培养液中)分别注射于裸鼠背部皮下的左、右两侧,左侧接种贴壁细胞,右侧接种悬浮球细胞。注射后3 d起观察移植瘤形成情况,每3天测量一次肿瘤体积[V=a×b2/2(a为长径,b为短径)],连续4周。28 d后处死裸鼠,剥取肿瘤称重、测量瘤体积,并绘制移植瘤生长曲线。
1.3统计学处理
实验采用SPSS18.0统计软件进行数据分析,两组样本比较采用独立样本t检验,数据均以±s表示,P<0.05为差异具有统计学意义。
2 结果
2.1细胞悬浮球培养
A549及H1299细胞株在含10%FBS的培养液中呈梭形贴壁生长(图1A、B),而在含各种刺激因子的无血清培养液中细胞1~3 d后悬浮分散于低黏附培养板中,形成若干大小、形态不等的悬浮球,其余散在细胞逐渐凋亡(图1C、D),6~8 d培养后,细胞呈球形或椭圆形立体生长,平均直径增大,悬浮球数目增多,球内细胞结合紧密,球体饱满,折光性强(图1E、F)。表明在连续无血清培养基和无黏附板条件下能成功诱导A549及H1299细胞株形成具有自我更新能力的干细胞球。
2.2细胞增殖能力和克隆形成能力
用CCK-8法分别检测A549、H1299及其悬浮球细胞随天数增加的增殖情况,并绘制生长曲线。观察发现A549及H1299悬浮球细胞大约从第4天开始进入对数生长期,第8天进入平台期,而普通A549及H1299细胞直到第6天才开始进入对数生长期。表明无论在A549还是H1299细胞系中,悬浮球的增殖能力均明显高于亲代贴壁细胞(P<0.05,图2A、B)。进一步通过平皿克隆实验检测悬浮球克隆形成能力,将A549、H1299及其悬浮球细胞以同等数目分别接种于普通6孔板,每组做3个复孔。经过10 d的培养,计数发现悬浮球形成的克隆数[A549悬浮球(87± 3)、H1299悬浮球(92±6)]显著高于贴壁亲代细胞[A549(17±5)、H1299(32±3),(P<0.05,图2C、D)]。通过上述实验说明,A549及H1299悬浮球均比其贴壁亲代细胞具有更强的干细胞特性—自我更新能力;同时,发现由于细胞系之间的差异,在相同培养条件和天数下,H1299悬浮球细胞生长速度要比A549悬浮球更快,克隆形成的数目更多。
2.3细胞侵袭能力
A549细胞球穿过微孔膜的细胞数为(94±14)个/视野,多于A549贴壁细胞的(38±5)个/视野(t=6.71,P<0.01,图3A、B);H1299细胞球穿过微孔膜的细胞数为(117±19)个/视野,多于H1299贴壁细胞的(38± 5)个/视野(t=5.74,P<0.01,图3C、D)。随机取中央区的5个视野,实验重复3次,做统计图3E,显示培养的悬浮球细胞比贴壁亲代细胞具有更强的干细胞特性—侵袭转移能力。
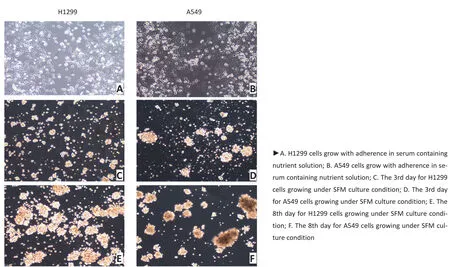
图1 显微镜下观察细胞及细胞球生长情况(×200)Figures 1 The cell growth under microscope (×200)
2.4干性相关基因表达的比较
通过qPCR检测在A549、H1299贴壁细胞及其悬浮细胞球中的干性转录因子Nanog和Oct-4表达差异:A549贴壁细胞vs悬浮细胞球组中Nanog[(1.00± 0.34)vs(25.61±1.21),P<0.005]、Oct-4[(2.35±0.70)vs (7.22±0.37),P<0.05];H1299贴壁细胞vs悬浮细胞球组中Nanog[(1.00±0.34)vs(27.32±0.54),P<0.005]、Oct-4[(1.59±0.67)vs(4.22±0.37),P<0.05]。提示在mRNA水平,悬浮球中干细胞核心调控基因Nanog和Oct4的表达明显升高,而大量实验已经证实,这两个因子在多种肿瘤干细胞中均表达增高,提示所培养的悬浮球细胞具有干细胞特性(图3F)。
2.5体内致瘤能力
能否在体内成功建立肿瘤移植瘤模型是检验CSC的一个“金标准”[4,6]。在BALB/c裸鼠背部皮下的左、右两侧分别接种1×106个细胞(正常A549细胞系裸鼠皮下成瘤,每只接种细胞数为4×106~8×106个细胞),左侧接种贴壁细胞,右侧接种悬浮球细胞。结果发现,在1×106个细胞的情况下,H1299细胞系无论是贴壁细胞还是悬浮球细胞,均难以形成瘤块,可能与H1299细胞系本身有关。A549细胞系中的悬浮球细胞成瘤能力要明显强于贴壁细胞组,成瘤潜伏期要短于贴壁细胞组,A549悬浮球细胞在第3~5天时,一组的5只裸鼠皮下均可见一明显包块,而贴壁细胞组直至第12天时,才均陆续长出肉眼可见瘤体;且瘤块体积随天数迅速增大,相对应的细胞球组瘤体重量也较后者要重(图4)。说明A549细胞球在较少的细胞数下,具有更强的体内致瘤能力。
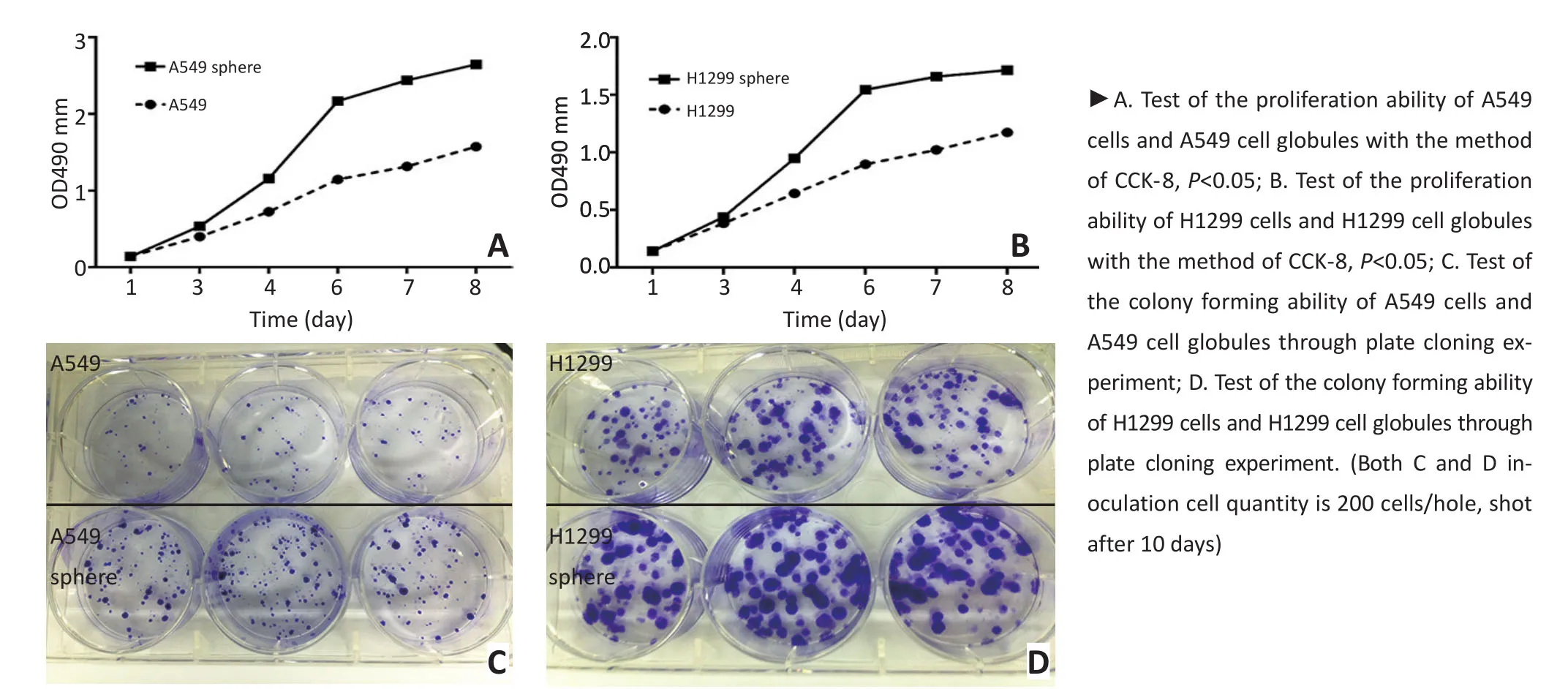
图2 细胞增殖能力和克隆形成能力比较Figure 2 The ability of cell proliferation and colony formation
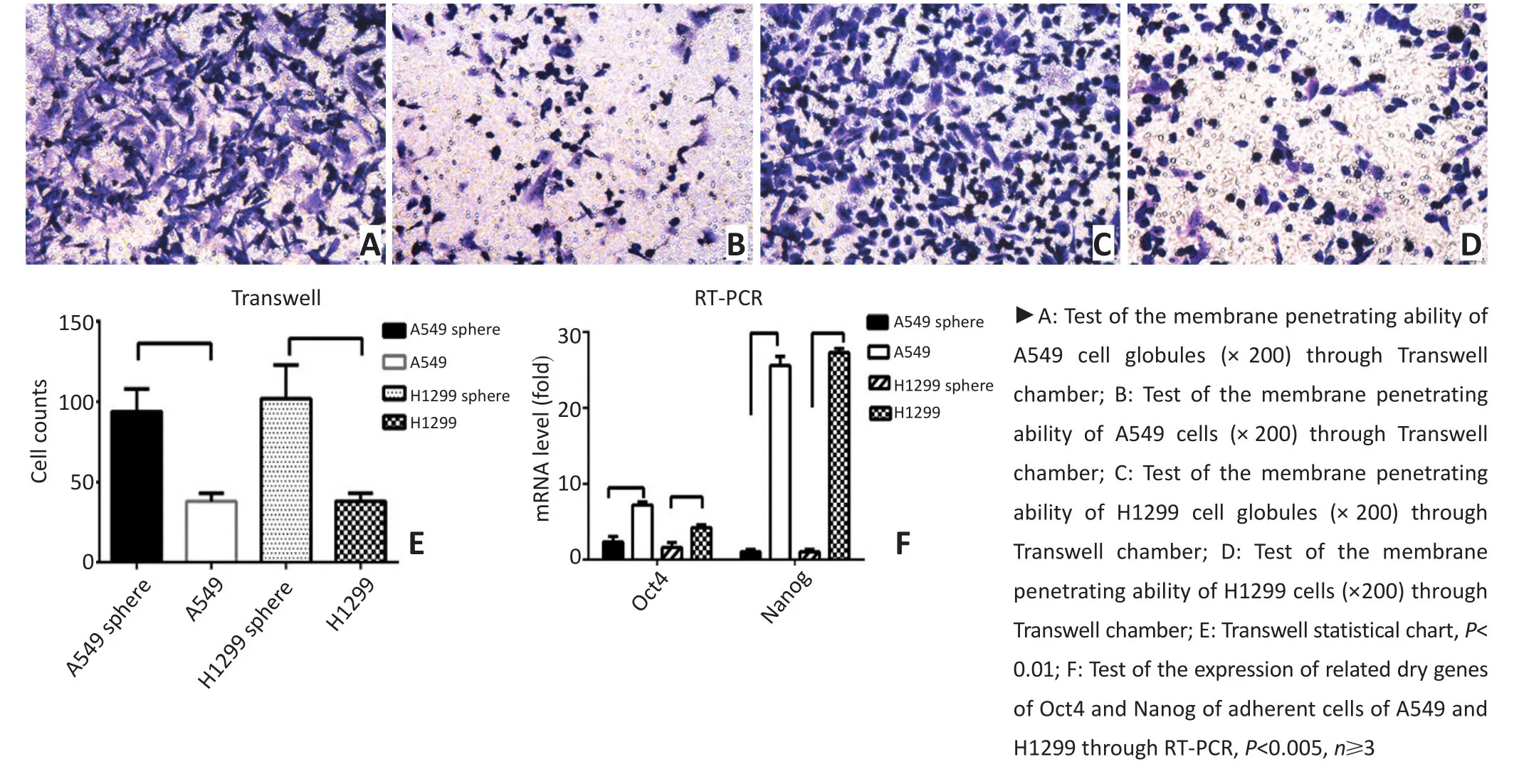
图3 细胞侵袭能力和干性相关基因的检测Figure 3 The detection of cell invasion and stem cell genes

图4 体内成瘤能力分析Figure 4 Tumorigenic capacity analysis
3 讨论
有关肿瘤干细胞(cancer stem cells,CSCs)理论一直存在各种争议。自1997年,从白血病中分离提取出具有干细胞特性的细胞后,在越来越多的实体肿瘤中均分离并鉴定出肿瘤干细胞[7],这个学术观点逐渐被大家所接受。CSCs理论认为,肿瘤干细胞是肿瘤组织中一类数量极少但具有极强自我更新、增殖分化潜能的细胞,是肿瘤发生发展、复发转移和耐药的根源。肿瘤干细胞理论的提出,为人们解决肿瘤术后复发转移,放、化疗后的耐药提供了新的视角,为深入研究肿瘤机制及靶向治疗提供可能。
通过SP细胞或表面标记物筛选法[8]、分子克隆构建法[9]、EMT耐药培养法[10]及无血清悬浮培养[6,11]等方法分离和富集肺癌中的干细胞成分,已成为主要方法。然而这些方法都有一定的自身适用性和局限性。侧群细胞SP细胞在Hoechst 33342染色分离过程中,可因染料的毒性而干扰其成瘤能力;依靠特异性标记物流式分选出的阳性干细胞亚群数量少,后续培养寿命短暂,不利于长期实验。且由于不同分型的细胞存在异质性,肺癌干细胞表面特异性标志物(CD133[12]、CD44[13]、ALDH[14]等)存在较大争议,一部分研究认为CD133+肺癌细胞具有干细胞特性,CD133可作为肺癌干细胞的标志物;而另一部分研究则认为肺癌干细胞中CD133的表达并非阳性[15],H446和A549细胞系中CD133-细胞也含肿瘤干细胞成分[16]。无血清悬浮球培养法最早应用于神经干细胞,目前已在众多实体肿瘤(乳腺癌、结肠癌、胰腺癌、肝癌等)[17-19]中均得以证实。肺癌中已分别有报道A549[16]、H460[6]等细胞通过悬浮培养液条件形成具有干细胞特性的细胞,但尚未在同一个肺腺癌细胞系上,用同样的悬浮条件验证2种以上的细胞系;这样既可规避因其组织来源异质性而存在的差异,同时又能较清楚地阐明不同分型下的腺癌类型;悬浮球培养法原理利用只有CSCs相对未分化的细胞才能够在SFM中悬浮生长并不断增殖,而普通高分化的肿瘤细胞则因无法耐受这种无血清的生长环境出现凋亡[5]。此法虽然也存在着培养的肿瘤干细胞比例不纯、容易随着代数的增加而日益分化问题,但因其成本低,可方便快捷地分离富集CSC样细胞而得到越来越多的应用。
本研究初步探讨了利用无血清悬浮培养法从肺腺癌细胞A549及H1299中分离富集了可稳定传代的细胞球,并对其干细胞特性进行了一系列验证,并随着培养时间的增加,细胞球平均直径增大,悬浮球数目增多。通过体外CCK-8、平皿克隆和Transwell小室等实验证明,无血清悬浮培养获得的悬浮球比贴壁亲代细胞具有明显干细胞特性—强增殖性和侵袭转移性。进一步检测了悬浮球中Oct4和Nanog的表达,这两个转录因子和Sox2、Klf4[20]构成了胚胎干细胞的核心调控因子,是维持胚胎干细胞自我更新和多潜能的关键开关。近年来被广泛证实,在多种实体肿瘤干细胞中均呈现较高表达,Oct4和Nanog与肺癌干细胞关系尤为密切[21],肺腺癌患者肿瘤组织中这两个基因高表达者,预后均较差,易复发转移。检测发现悬浮球中这2个基因的表达均明显高于贴壁亲本细胞,差异具有统计学意义,其中Nanog差异尤为明显,可增高25倍(P<0.001)。另一方面,通过体内动物成瘤实验,将A549细胞球和A549细胞在同等较少的细胞数目下,接种于同一只裸鼠的左右两边,发现悬浮球组成瘤潜伏期、瘤体生长速度、瘤体积等成瘤能力指标均远强于贴壁细胞组。而H1299细胞系,无论其亲代细胞或是悬浮球细胞经过多次尝试,均无法在裸鼠体内皮下成瘤,可能与细胞、鼠系差异有关。以上通过体内、体外的一系列实验表明,无血清悬浮培养法可有效分离、富集到具有干细胞特性的肺癌细胞[11]。
本研究在肺癌的两个细胞系通过同样的构建方法加以尝试,避免了因其组织来源异质性而存在的差异,虽然A549悬浮球的干细胞特性并非与H1299悬浮球完全一致,但和亲代贴壁细胞相比,均表现了更强的干细胞特性。表明通过无血清悬浮培养法可以培养出具有干细胞特性的肺腺癌细胞株。作为一个快速易行的构建干细胞模型方法,为肺癌干细胞生物学特性的深入研究及靶向药物筛选奠定了基础。
参考文献
[1] Hirano H, Maeda H, Yamaguchi T, et al. Survivin expression in lung cancer: Association with smoking, histological types and pathological stages[J]. Oncol Lett, 2015, 10(3):1456-1462.
[2] Chang YW, Su YJ, Hsiao M, et al. Diverse Targets of beta-Catenin during the Epithelial-Mesenchymal Transition Define Cancer Stem Cells and Predict Disease Relapse[J]. Cancer Res, 2015, 75(16):3398-3410.
[3] Qi W, Chen J, Cheng X, et al. Targeting the Wnt-Regulatory Protein CTNNBIP1 by micro RNA-214 Enhances the Stemness and Self-Renewal of Cancer Stem-Like Cells in Lung Adenocarcinomas[J]. Stem Cells, 2015, 33:3423-3436.
[4] Chiou SH, Wang ML, Chou YT, et al. Coexpression of Oct4 and Nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymal transdifferentiation[J]. Cancer Res, 2010, 70(24):10433-1044.
[5] Wang JL, Sun ZQ, Yu JP, et al. Isolation and biological characteristics of cancer stem cells from esophageal cancer cell lines[J]. Acta Universitatis Medicinalis Nanjing(Natural Science), 2013, (10):1362-1367.[汪建林,孙志强,于静萍,等.食管癌细胞株中肿瘤干细胞样细胞的分离培养及生物学鉴定[J].南京医科大学学报(自然科学版),2013,(10):1362-1367.]
[6] Liu P, Zhou XD. Biological behaviors of lung cancer stem-like cells from human large-cell lung cancer cell line H460[J]. J South Med Univ, 2014, 34(4):453-457.[刘攀,周向东.大细胞肺癌H460细胞系肿瘤干细胞样细胞生物学特性[J].南方医科大学学报,2014,(4):453-457.]
[7] Jordan CT. Cancer stem cells: controversial or just misunderstood[J]. Cell Stem Cell, 2009, 4(3):203-205.
[8] Gupta PB, Onder TT, Jiang G, et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening[J]. Cell, 2009, 138 (4):645-659.
[9] Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stemcells[J]. Cell, 2008, 133(4):704-715.
[10] Yang Y, Fan Y, Qi Y, et al. Side population cells separated from A549 lung cancer cell line possess cancer stem cell-like properties and inhibition of autophagy potentiates the cytotoxic effect of cisplatin[J]. Oncol Rep, 2015, 34(2):929-935.
[11] Yan XP, Luo H, Zhou XD. Isolation and identification of lung cancer stem like cells from human lung cancer cell line A549[J]. J Third Mil Med Univ, 2012, 34(12):1153-1157.[闫秀萍,罗虎,周向东.人肺癌细胞系A549中肿瘤干细胞样细胞的分离及鉴定[J].第三军医大学学报,2012, 34(12):1153-1157.]
[12] Su YJ, Lin WH, Chang YW, et al. Polarized cell migration induces cancer type-specific CD133/integrin/Src/Akt/GSK3beta/beta-catenin signaling required for maintenance of cancer stem cell properties[J]. Oncotarget, 2015, 6(35):38029-38045.
[13] Su J, Wu S, Wu H, et al. CD44 is functionally crucial for driving lung cancer stem cells metastasis through Wnt/beta-catenin-FoxM1-Twist signaling[J]. Mol Carcinog, 2015 [Epub ahead of Print].doi:10.1002/ mc.22443.
[14] Zhou Y, Wang Y, Ju X, et al. Clinicopathological significance of ALDH1A1 in lung, colorectal, and breast cancers: a meta-analysis[J]. Biomark Med, 2015, 9(8):777-790.
[15] Huang JS, Ning RL, Wu LX, et al. profi ling of genes differentially expressed after targeted inactivation of OCT4 pluripotent transcription factor in human lung adenocarcinoma stem Cells[J]. Chinese Journal of Cell Biology, 2013, 35(7):928-936.[黄进肃,宁仁利,吴丽霞,等.靶向灭活肺腺癌干细胞OCT4多潜能转录因子后的差异表达基因分析[J].中国细胞生物学学报,2013,35(7):928-936.]
[16] Meng X, Li M, Wang X, et al. Both CD133+and CD133-subpopulations of A549 and H446 cells contain cancer-initiating cells[J]. Cancer Sci, 2009, 100(6):1040-1046.
[17] Rakian R, Block TJ, Johnson SM, et al. Native extracellular matrix preserves mesenchymal stem cell "stemness" and differentiation potential under serum-free culture conditions[J]. Stem Cell Res Ther, 2015, 6:235.
[18] do ARL, de Sousa Bomfim A, de Abreu-Neto MS, et al. Approaches for recombinant human factor IX production in serum-free suspension cultures[J]. Biotechnol Lett. 2015[Epub ahead of Print].doi:10.1007/ s10529-015-1991-1.
[19] Yamasaki S, Hamada A, Akagi E, et al. Generation of cleidocranial dysplasia-specific human induced pluripotent stem cells in completely serum-, feeder-, and integration-free culture[J]. In Vitro Cell Dev Biol Anim, 2015[Epub ahead of Print].doi:10.1007/s11626-015-9968-x.
[20] Yu B, Cai H, Xu Z, et al. Expressions of stem cell transcription factors Nanog and Oct4 in renal cell carcinoma tissues and clinical significance [J]. Artif Cells Nanomed Biotechnol, 2015, 1-6.
[21] Zunder ER, Lujan E, Goltsev Y, et al. A continuous molecular roadmap to iPSC reprogramming through progression analysis of single-cell mass cytometry[J]. Cell Stem Cell, 2015, 16(3):323-337.
(2015-12-20收稿)
(2016-01-15修回)
(编辑:杨红欣校对:郑莉)

杨佳专业方向为肿瘤临床与基础研究。E-mail:jiajiayy07@163.com
·临床研究与应用·
Isolation and identification of lung cancer stem like cells from human lung adenocarcinoma cell lines
Jia YANG, Zhihong FANG, Jianchun WU, Jing XU, Xiaolin YIN, Fanchen Zhao, Yan LI
Correspondence to: Yan LI; E-mail: 18916767226@163.com
Department of Oncology, Shanghai University of Traditional Chinese Medicine Affiliated Shanghai Chinese Medicine Hospital, Shanghai 201203, China
This work were supported by the Key Project of National Natural Science Foundation of China (No.81473627) and Project from Shanghai Municipal Health Bureau (No.20124078)
AbstractObjective: To isolate cell spheres containing cancer stem cells (CSCs) from lung cancer cell lines (A549 and H1299) and identify their biological characteristics. Methods: By adopting the method of serum-free suspension culture, A549 cells and H1299 cells were cultured on no-adhesion plate to form tumor spheres. Clone assay, CCK-8 assay, and Transwell assay were employed to observe proliferation, self-renewal and invasion of tumor spheres. Besides, RT-PCR was performed to compare the expression levels of stem cell markers between sphere cells and adherent cells. Adherent A549 cells and A549 cell spheres were inoculated subcutaneously in nude mice and the tumor growth was assessed. Results: Isolated CSCs from A549 cells and H1299 cells in serum-free medium (SFM) without adhesion could grow as floating cell spheres. The results demonstrated that the self-renewal, proliferation and invasion of A549 and H1299 sphere cells were stronger than parent cells (P<0.05). When compared with adherent cells, the mRNA level of expression of cell spheres' stem cell markers (Oct4 and Nanog) were significantly high (P<0.05) and A549 spheres had a stronger tumorigenicity in nude mice. Conclusion: SFM without adhesion can be a quick and easy method to construct stem cells model from human lung adenocarcinoma cell lines A549 and H1299.
Keywords:lung adenocarcinoma, cancer stem cell, serum-free culture, isolation, identification
作者简介
通信作者:李雁18916767226@163.com
doi:10.3969/j.issn.1000-8179.2016.03.441

