高盐摄入与骨代谢*
·综述·
高盐摄入与骨代谢*
朱晓峰,张荣华△
(暨南大学附属第一医院,广东 广州 510630)
骨质疏松症是以骨质减少,骨微观结构退化为特征,致使骨的脆性增加以及易于发生骨折的一种全身性骨骼疾病。随着老龄化人群的不断增长,骨质疏松的防治已经成为一个全球的健康问题。骨质疏松与遗传、性别、年龄、体重、种族、饮食等均有相关性。和种族、遗传因素不同,一些危险因素是可以干预的,包括饮食营养、性激素、药物应用、生活习惯等。因此,从饮食营养角度探讨骨质疏松的防治有着重要意义。
食盐是人体不可缺少的物质成分,它的主要成分是氯化钠,钠离子和氯离子在人体参与维持细胞外液的渗透压、调节体内酸碱平衡、维持神经和肌肉的兴奋性等生理功能。但过量的盐摄入参与了多种疾病的发生发展过程,包括了高血压、心脑血管病等[1],近期的研究发现高氯化钠也参与了类风湿性关节炎等自体免疫疾病的发生发展[2]。也有部分研究表明,盐也在一些疾病中如皮肤感染中起着正向作用[3]。
饮食盐摄入与骨健康的关系也一直受到重视,很多临床观察和动物实验显示氯化钠可以影响骨代谢,但也有一些矛盾的结果出现,此外氯化钠影响骨代谢的机理仍未完全清楚。我们以“氯化钠”、“食盐”、“骨”、“骨质疏松”、“骨代谢”的不同组合为检索词(中英文),截至2015年12月检索了Medline、Web of Science、中国知网等数据库,根据文献综述了高盐(氯化钠)摄入与骨代谢的关系,对于明确盐摄入影响骨代谢的病理生理学机制以及从饮食指导方面进行骨质疏松的防治有重要意义。
1高盐摄入对骨代谢影响的临床研究
1.1高盐摄入对骨密度或骨矿含量的影响一系列的临床观察已经提示高盐摄入与骨量和骨密度有直接关系。采用尿钠作为评价盐摄入的指标,很早就发现高氯化钠引起的高尿钙可以减少骨量,减少的幅度取决于氯化钠摄入的多少,一个横断面纵向研究发现440例绝经后妇女的骨密度和24 h尿钠的水平是负相关的[4],在尿钙结石形成的病人中也得出了相同的结果[5]。通过对124例绝经(大于10年)后妇女研究进行多元回归分析发现超过2年的尿钠分泌和饮食钙摄入是髋和踝关节部位骨密度显著的决定因素,每天减少氯化钠摄入121 mmol和每天提高钙摄入22 mmol对骨的保护作用相当,尿钠分泌低于92 mmol/d时没有骨丢失的发生[6]。在低龄的研究对象中,高氯化钠摄入加速了钙的丢失,减少了8~13岁青年女孩的骨量[7]。
在亚洲人群中,纳入1 098例中国人的临床研究采用Logistic回归分析发现总髋关节和腰椎骨密度和尿钠、女性呈负相关,认为摄入氯化钠是骨质疏松的一个主要危险因素[8]。在对2 779例韩国绝经后妇女进行的横断面研究结果显示有骨质疏松的参与者尿钠显著高于无骨质疏松的参与者,矫正多个混杂因素后,尿钠和腰椎骨密度显著负相关,平均骨密度随着尿钠的升高而降低[9]。
但也有一些研究没有得到相同甚至得到了相反的结果。有研究显示钠饮食和骨密度是没有关系的[10-11],另有研究也显示钠对骨代谢有益,在一个为期3年的关于钠摄入和骨密度或骨矿含量关系的研究中,参与者为健康的136例绝经后白人妇女,一组每日盐摄入为1 500 mg,另一组为3 000 mg,全部受试者给予钙和维生素D补充至推荐的标准,每6个月评估 1 次,结果显示前臂和脊柱随着高钠摄入在各个时点有着更高的骨密度[12]。
1.2高盐摄入对骨代谢生化指标的影响骨骼是一个相对不活跃的组织,骨密度和骨矿含量的变化要求观察的时间较长,且需要特定的设备和条件,因此短期评价骨代谢状况时,多采用尿和血液学生化指标。代表骨吸收的指标有抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)、羟脯氨酸(hydroxyproline,HOP)、胶原吡啶并啉(pyridine,Pyr)、脱氧胶原吡啶并啉(deoxypyridinoline,D-Pyr)、I型胶原氨基端肽(N-terminal telopeptide of type I collagen,NTx)、I型胶原羧基端肽(carboxy-terminal telopeptide of type Ⅰ collagen,CTx);代表骨形成的指标有甲状旁腺激素(parathyroid hormone,PTH)、降钙素(calcitonin,CT)、骨钙素(osteocalcin,OC)、骨特异性碱性磷酸酶(bone-specific alkaline phosphatase,BALP)等。值得一提的是最初尿HOP一直作为骨吸收的一个证据,后来因缺乏特异性,而被更可靠的基于尿的破骨细胞骨吸收的指标(Pyr、D-pyr和NTx等)代替。
多个横断面观察研究已经证实在不同人群中高盐摄入和尿钙以及HOP的分泌是正相关的[4]。在一个11例绝经后妇女参与的随机交叉设计试验里,7 d高盐饮食(300 mmol/d)相比低盐饮食(50 mmol/d)在尿钙、尿钠显著升高的同时尿D-pyr也显著升高27%[13]。一个有763例自愿者的横断面研究中,多元回归统计分析结果显示50~79岁的女性,尿D-Pyr和尿钠具有显著相关性[14]。对60例绝经后妇女先进行低盐饮食(每天87 mmol钠)3周,然后随机进行高盐饮食(每天225 mmol钠)加钾或者安慰剂4周,发现提高盐摄入提高了NTx,骨形成标志物OC则显著减少[15]。纳入23~76岁的186个成年人的介入性研究中,低钠饮食30 d减少了血清OC、CTx和PTH[16],降低了骨转换。高钠饮食显著提高了尿钠、钾、钙、氮、NTx,和维生素D受体基因多态性(f+VDR)也有明确关系[17]。低盐饮食(2 g/d)6个月显著减少了40例绝经后非裔美国妇女和高加索妇女尿钠、钙和NTx的分泌[18]。8个健康男性参与的一项研究表明,高氯化钠提高了CTx和NTx的分泌[19]。对10例健康绝经后妇女14 d研究发现,高盐饮食的D-Pyr和NTx浓度在傍晚明显升高,空腹和餐后的OC值在低盐饮食组升高[20]。在韩国大规模的临床试验中发现低盐饮食可以降低骨转换指标OC和CTx[21]。
一些阴性的结果显示,对14例绝经后妇女随机分成高钠和低钠2组,干预8 d显示并没有尿D-pyr的不同[22]。横断面研究回归分析表明尿钠和尿钙及尿D-pyr有较强的相关性,但纠正混杂因素尤其是体重后这种相关性便消失了[23]。另在健康青年人中提高盐摄入不能改变骨吸收指标Pyr和D-pyr或者骨形成指标血清OC和BALP[24]。给予29例青年男女(21~39岁)低盐饮食7周,骨代谢的指标没有明显的变化[25]。
2高盐摄入对骨代谢影响的动物实验
动物实验显示高氯化钠摄入和骨丢失有直接关系,成长期的大鼠饮食添加氯化钠16 d,其骨钙低于年龄相当的对照组,同位素标记显示氯化钠诱导尿钠、钙、磷、cAMP和HOP的分泌,表明氯化钠诱导的骨丢失主要是提高骨吸收而不是减少骨形成。在去卵巢大鼠中给予限制钙的饮食和氯化钠添加加速了骨丢失,也提高了正常和去卵巢大鼠尿钙和尿HOP的分泌,减少了骨密度[4]。氯化钠的添加(80 g/kg)增加了断奶大鼠3到5倍尿钙的分泌和少量尿磷、尿镁的分泌,减少了骨量和骨矿含量[26]。
对正常大鼠予以高盐加高钙饮食(0.6%)或者低钙饮食(0.02%),结果显示分别在5周和4个月时减少了骨钙含量[27]。在盐敏感大鼠中,给予高盐饮食后8周骨密度开始减少,不但促进骨吸收而且抑制骨形成,到22周时骨密度显著减少[28]。在3周大的大鼠中添加高盐(50 g/kg)饮食3周,盐饮食组大鼠的体重减轻,尿钙、尿镁分泌分别提高3倍和2倍,股骨钙含量减少,尿Pyr和D-pyr的分泌提高[29]。另有研究显示盐负荷的大鼠从实验第5周开始有一个显著的低体重,尿钙,是对照动物的5倍,骨密度、骨矿含量和股骨重量轻微减少[30]。在失重状态下,高盐饮食能够更快地减少股骨骨密度和骨强度[31]。
3高盐摄入影响骨代谢的机制
3.1高盐摄入增加尿钙的排泄高盐饮食作为骨质疏松的主要危险因素主要基于氯化钠对尿钙排泄的影响。钙是一个重要的影响骨密度的营养因素,近99%的钙存在于骨和牙齿中,另外1%的钙存在于体液中,机体钙平衡直接影响骨矿含量,长时间的阴性平衡将导致钙从骨组织动员出来从而导致骨质疏松。尿钙的原因部分是盐诱导的容积扩张,伴随着肾小球滤过率的升高,另一部分是钠和钙离子在近端小管和亨利氏襻存在联系或共同的吸收途径[32]。当饮食中氯化钠升高,钠在肾小管的重吸收减少,导致了钙重吸收的平行减少。在对一项17个盐负荷研究和18个人群的调查分析表明,尿钙/尿钠的中位比值分别是0.69和1.15[4]。这些数据支持每天提高100 mmol(2 290 mg)的饮食盐将提高1 mmol(40 mg)尿钙的排泄[33]。
高盐摄入增加了尿钙分泌,已经被各个年龄段多个种族的人体试验所证实,尽管这种关系不可能是线性的,在年轻妇女中提高钠摄入即可引起高尿钙[34],而绝经后妇女更为显著[13]。通过对50例高加索人及39例非裔美国人的研究发现,钠分泌是钙分泌的预报器,这种关系可以被钙摄入调节,和种族没有关系[35]。而对1 577例受试者(包括277例白人,227例非裔美国人,239例南亚人)的横断面研究发现,进行年龄、性别校正后,盐摄入和种族是尿钙的独立预测因素[36]。在亚洲人群中也有相同结果,韩国的一项研究中显示尿钙和年龄、血压、尿钠、盐摄入有明确关系[37]。在中国的一项横断面研究中也显示饮食钠可以提高尿钙分泌[38]。在日本,在2组性别中均观察到每天的尿钙分泌和尿钠分泌有显著的相关性[39]。通过一项1 010例中国香港人横断面分析发现尿钠是尿钙一个领先的独立因素,和蛋白、钙、磷等无关,多元回归分析发现尿钠每提高100 mmol尿钙约提高1.4 mmol[40]。在动物实验中,高盐摄入与尿钙分泌的关系得到了更为直接地证实,盐添加可以使大鼠地尿钙的排泄增加3倍[29,41]。
提高尿钙分泌可导致骨吸收或肠道吸收钙的提高。研究发现年轻人适应高盐饮食是通过提高血清PTH,继而依次提高骨化三醇的产生和肠道的钙吸收来实现的,然而,通过提高钙吸收对尿钙分泌的补偿,尤其是在其它危险因素如低钙等情况下,即使在年轻人中也是有限的。在绝经后妇女中提高氯化钠摄入并不伴随着血清PTH和肠道钙吸收的升高,主要是通过继发的骨吸收起作用[42]。实验动物中,年轻的大鼠中给予钙缺乏的饮食(0.1%钙),尽管有高水平的骨化三醇,钙吸收仍不能补偿尿钙的丢失,因此,钙不得不从骨中动员出来以维持正常的血钙浓度[4];高盐饮食引起大鼠股骨钙容量的减少在低钙饮食(0.02%钙)情况下仅需要2个月,正常钙饮食(0.6%钙)情况下是4个月后出现[43]。
3.2高盐摄入引起代谢性酸中毒提高氯化钠摄入可引起高尿钙分泌,但钙是怎样动员出骨的仍不清楚。一些研究结果显示提高氯化钠摄入和酸碱平衡有一定的联系,提高氯化钠摄入导致了阳性的钠平衡,减少了液体潴留,降低了血清pH值和碳酸氢盐的水平[44]。绝经后妇女共同摄入高盐和碳酸氢钾显示,高氯化钠可以提高pH值减少骨吸收标志物的分泌,补充碳酸氢钾后骨矿平衡和骨骼代谢得到改善,伴随着血浆碳酸盐浓度和血pH值的提高,这是酸碱平衡与骨状况直接关系的报道[15]。体内和体外实验已经证实pH值的降低可以激活破骨细胞,也可以抑制成骨细胞活性[45],通过环氧化酶依赖的机制促进核因子κB受体活化因子配体的表达[46],诱导骨吸收,导致钙从骨中丢失,在骨丢失和最终发展至骨质疏松过程中起着重要作用[47]。
研究显示高氯化钠摄入引起的酸碱失衡是轻度的代谢性酸中毒[45, 48],对生长期骨皮质和骨矿含量以及绝经前后妇女骨密度有阴性调节作用,可以提高骨吸收标志物[49-50]。其原因可能是,一方面轻度代谢性酸中毒直接刺激破骨细胞,细胞实验中pH值的减少,即使接近于生理环境,也可引起骨吸收的大幅度升高[45];另一方面,轻度的代谢性酸中毒直接影响远端肾小管的钙吸收,导致肾性高尿钙。除以上机制外,尿钙排出也导致PTH的分泌,动员钙溶解。PTH本身也可以通过减少肾小管对碳酸氢盐的重吸收诱导代谢性酸中毒[51]。在一项8名健康男性参与的随机交叉试验中,一组应用90 mmol的碳酸氢钾补充以抵消氯化钠诱导的轻度代谢性酸中毒,另一组仅应用高氯化钠摄入作为对照,结果显示碳酸氢钾补充组尿钙分泌和骨吸收标志物NTx分别减少了12%和8%[52]。越来越多的研究认为,典型现代高钠低钾的饮食方式引起了慢性轻度的代谢酸中毒,加速了骨丢失的发生[53]。
值得注意的是氯离子在钙的代谢中也起着重要作用[54]。氯离子和钠离子在整个过程中同样重要,这个重要性在利用肠外营养标记的病人中得到证实,只有氯化钠(而不是柠檬酸钠)提高尿钙排泄[4]。另外在一项健康人的横断面研究中也发现氯摄入与钠摄入有强烈的正相关[55],氯化钠引起的酸中毒应该作为骨质疏松的一个危险因素。
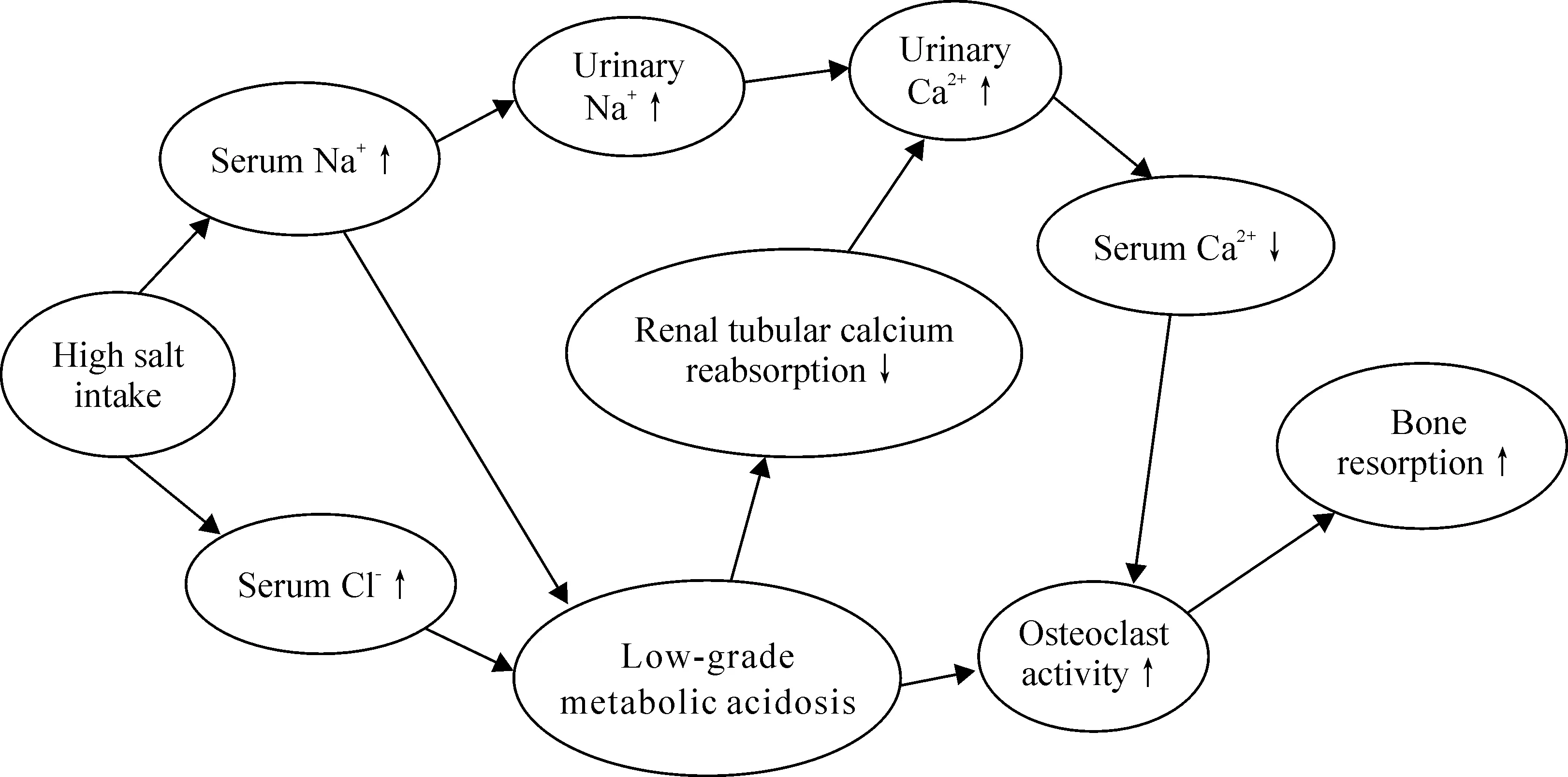
Figure 1.High salt intake leads to bone resorption by increasing levels of urinary calcium excretion and a low-grade metabolic acidosis.
图1高氯化纳摄入引起骨吸收的相关机制
4小结
总体上来看,长期高氯化钠摄入对于骨健康是有害的,尽管在临床研究中得到了不一致的结果,这可能与临床观察中受到钙、维生素D补充的影响[10-12,25],或者观察时间较短[23-24],或者例数太少[22,25]有关。相反,在比较容易控制的动物实验中则得到了明确的结果。高氯化钠摄入作为骨质疏松的一个危险因素,越来越受到重视,其机制可能与高氯化纳引起的尿钙排泄增加和轻度的代谢性酸中毒相关(图1)。在氯化钠对骨骼的影响中,氯离子和钠离子一样起着重要作用。但是高氯化钠对骨骼的影响仍有许多方面尚不清楚,首先必须关注的是多大负荷的氯化钠能影响骨代谢,是否像盐敏感高血压一样有无特定的基因参与了此过程,有无种族和人群的差异?过低摄入氯化钠是否对骨骼也有负面作用?其次,对于高盐影响骨代谢机制的研究,目前仅停留在对尿钙的排泄影响和氯化钠引起的代谢性酸中毒方面,而钠影响钙在肾小管的重吸收机制尚不明确?此外,随着对氯化钠影响机体的认识不断深入,我们还发现氯化钠可以通过对免疫细胞的调节参与自身免疫疾病的发生与发展[2],而骨骼作为一个和免疫系统密切相关的器官[56],氯化钠能否通过免疫系统影响骨骼健康?氯化钠能否直接影响骨系细胞活性?进一步开展氯化钠和骨健康关系的研究,对于明确营养物质对骨代谢影响的病理生理学机制以及日常生活中对于骨质疏松的防治具有重要的意义。
[参考文献]
[1]O′Donnell M, Mente A, Yusuf S. Sodium intake and cardiovascular health[J]. Circ Res, 2015, 116(6):1046-1057.
[2]Kleinewietfeld M, Manzel A, Titze J, et al. Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells[J]. Nature, 2013, 496(7446):518-522.
[3]Jantsch J, Schatz V, Friedrich D, et al. Cutaneous Na+storage strengthens the antimicrobial barrier function of the skin and boosts macrophage-driven host defense[J]. Cell Metab, 2015, 21(3):493-501.
[4]Massey LK, Whiting SJ. Dietary salt, urinary calcium, and bone loss[J]. J Bone Miner Res, 1996, 11(6):731-736.
[5]Martini LA, Cuppari L, Colugnati FA, et al. High sodium chloride intake is associated with low bone density in calcium stone-forming patients[J]. Clin Nephrol, 2000, 54(2):85-93.
[6]Devine A, Criddle RA, Dick IM, et al. A longitudinal study of the effect of sodium and calcium intakes on regional bone density in postmenopausal women[J]. Am J Clin Nutr, 1995, 62(4):740-745.
[7]Matkovic V, Ilich JZ, Andon MB, et al. Urinary calcium, sodium, and bone mass of young females[J]. Am J Clin Nutr, 1995, 62(2):417-425.
[8]Woo J, Kwok T, Leung J, et al. Dietary intake, blood pressure and osteoporosis[J]. J Hum Hypertens, 2009, 23(7):451-455.
[9]Kim SW, Jeon JH, Choi YK, et al. Association of urinary sodium/creatinine ratio with bone mineral density in postmenopausal women: KNHANES 2008-2011[J]. Endocrine, 2015, 49(3):791-799.
[10]Dawson-Hughes B, Fowler SE, Dalsky G, et al. Sodium excretion influences calcium homeostasis in elderly men and women[J]. J Nutr, 1996, 126(9):2107-2112.
[11]Reid IR, Ames RW, Evans MC, et al. Determinants of the rate of bone loss in normal postmenopausal women[J]. J Clin Endocrinol Metab, 1994, 79(4):950-954.
[12]Ilich JZ, Brownbill RA, Coster DC. Higher habitual sodium intake is not detrimental for bones in older women with adequate calcium intake[J]. Eur J Appl Physiol, 2010, 109(4):745-755.
[13]Evans CE, Chughtai AY, Blumsohn A, et al. The effect of dietary sodium on calcium metabolism in premenopausal and postmenopausal women[J]. Eur J Clin Nutr, 1997, 51(6):394-399.
[14]Itoh R, Suyama Y, Oguma Y, et al. Dietary sodium, an independent determinant for urinary deoxypyridinoline in elderly women. A cross-sectional study on the effect of dietary factors on deoxypyridinoline excretion in 24-h urine specimens from 763 free-living healthy Japanese[J]. Eur J Clin Nutr, 1999, 53(11):886-890.
[15]Sellmeyer DE, Schloetter M, Sebastian A. Potassium citrate prevents increased urine calcium excretion and bone resorption induced by a high sodium chloride diet[J]. J Clin Endocrinol Metab, 2002, 87(5):2008-2012.
[16]Lin PH, Ginty F, Appel LJ, et al. The DASH diet and sodium reduction improve markers of bone turnover and calcium metabolism in adults[J]. J Nutr,2003, 133(10):3130-3136.
[17]Harrington M, Bennett T, Jakobsen J, et al. The effect of a high-protein, high-sodium diet on calcium and bone metabolism in postmenopausal women and its interaction with vitamin D receptor genotype[J]. Br J Nutr, 2004, 91(1):41-51.
[18]Carbone LD, Barrow KD, Bush AJ, et al. Effects of a low sodium diet on bone metabolism[J]. J Bone Miner Metab, 2005, 23(6):506-513.
[19]Frings-Meuthen P, Buehlmeier J, Baecker N, et al. High sodium chloride intake exacerbates immobilization-induced bone resorption and protein losses[J]. J Appl Physiol, 2011, 111(2):537-542.
[20]Linda K, Massey. Effect of dietary salt intake on circadian calcium metabolism, bone turnover, and calcium oxalate kidney stone risk in postmenopausal women[J]. Nutr Res, 2005, 25(10):891-903.
[21]Park SM, Joung JY, Cho YY, et al. Effect of high dietary sodium on bone turnover markers and urinary calcium excretion in Korean postmenopausal women with low bone mass[J]. Eur J Clin Nutr, 2015,69(3):361-366.
[22]Lietz G, Avenell A, Robins SP. Short-term effects of dietary sodium intake on bone metabolism in postmenopausal women measured using urinary deoxypyridinoline excretion[J]. Br J Nutr, 1997, 78(1):73-82.
[23]Jones G, Beard T, Parameswaran V, et al. A population-based study of the relationship between salt intake, bone resorption and bone mass[J]. Eur J Clin Nutr, 1997, 51(8):561-565.
[24]Ginty F, Flynn A, Cashman KD. The effect of dietary sodium intake on biochemical markers of bone metabolism in young women[J]. Br J Nutr, 1998, 79(4):343-350.
[25]Natri AM, Kärkkäinen MU, Ruusunen M, et al. A 7-week reduction in salt intake does not contribute to markers of bone metabolism in young healthy subjects[J]. Eur J Clin Nutr, 2005, 59(3):311-317.
[26]Shortt C, Flynn A. Effect of dietary lactose on salt mediated changes in mineral metabolism and bone composition in the rat[J]. Br J Nutr, 1991, 66(1):73-81.
[27]Chan AY, Poon P, Chan EL, et al. The effect of high sodium intake on bone mineral content in rats fed a normal calcium or a low calcium diet[J]. Osteoporos Int, 1993, 3(6):341-344.
[28]Iwasa Y, Shimoyama K, Aoki K, et al. The effect of high salt intake on the mandibular bone loss in Dahl-Iwai salt-sensitive rat[J]. J Med Dent Sci, 2000, 47(3):187-195.
[29]Creedon A, Cashman KD. The effect of high salt and high protein intake on calcium metabolism, bone composition and bone resorption in the rat[J]. Br J Nutr, 2000, 84(1):49-56.
[30]SarifM, Piasek M, Blanusa M, et al. Sodium and calcium intakes and bone mass in rats revisited[J]. Nutrition, 2005, 21(5):609-614.
[31]Liang MT, Navidi M, Cleek TM, et al. Dietary salt, bone strength, and mineral content in unloaded rat femurs[J]. Aviat Space Environ Med, 2011, 82(10):941-945.
[32]Heaney RP. Role of dietary sodium in osteoporosis[J]. J Am Coll Nutr, 2006, 25(3 Suppl):271-276.
[33]Nordin BE, Need AG, Morris HA, et al. The nature and significance of the relationship between urinary sodium and calcium in women[J]. J Nutr, 1993, 123(9):1615-1622.
[34]Susan JW, Timothy JG,Evezyn PM, et al. Effects of excess protein, sodium and potassium on acute and chronic urinary calcium excretion in young women[J]. Nutri Res, 1998, 18(3):475-487.
[35]Carbone LD, Bush AJ, Barrow KD, et al. The relationship of sodium intake to calcium and sodium excretion and bone mineral density of the hip in postmenopausal African-American and Caucasian women[J]. J Bone Miner Metab, 2003, 21(6):415-420.
[36]Blackwood AM, Sagnella GA, Cook DG, et al. Urinary calcium excretion, sodium intake and blood pressure in a multi-ethnic population: results of the Wandsworth Heart and Stroke Study[J]. J Hum Hypertens, 2001, 15(4):229-237.
[37]Lim HJ. A study on the calcium and sodium intakes and urinary calcium excretion of adults in Busan[J]. Korean J Community Nutr, 2011, 16(2):215-226.
[38]Hu JF, Zhao XH, Parpia B, et al. Dietary intakes and urinary excretion of calcium and acids: a cross-sectional study of women in China[J]. Am J Clin Nutr, 1993, 58(3):398-406.
[39]Itoh R, Suyama Y. Sodium excretion in relation to calcium and hydroxyproline excretion in a healthy Japanese population[J]. Am J Clin Nutr, 1996, 63(5):735-740.
[40]Ho SC, Chen YM, Woo JL, et al. Sodium is the leading dietary factor associated with urinary calcium excretion in Hong Kong Chinese adults[J]. Osteoporos Int, 2001, 12(9):723-731.
[41]Mason RA, Morris HA. Increased urinary calcium excretion potentiates bone turnover in oophorectomized rats[J]. Miner Electrolyte Metab, 1997, 23(1):38-42.
[42]Cohen AJ, Roe FJ. Review of risk factors for osteoporosis with particular reference to a possible aetiological role of dietary salt[J]. Food Chem Toxicol, 2000, 38(2-3):237-253.
[43]Chan EL, Swaminathan R. Calcium metabolism and bone calcium content in normal and oophorectomized rats consuming various levels of saline for 12 months[J]. J Nutr, 1998, 28(3):633-639.
[44]Heer M, Baisch F, Kropp J, et al. High dietary sodium chloride consumption may not induce body fluid retention in humans[J]. Am J Physiol Renal Physiol, 2000, 278(4):585-595.
[45]Frings-Meuthen P, Baecker N, Heer M. Low-grade metabolic acidosis may be the cause of sodium chloride-induced exaggerated bone resorption[J]. J Bone Miner Res, 2008, 23(4):517-524.
[46]Frick KK, Bushinsky DA. Metabolic acidosis stimulates RANKL RNA expression in bone through a cyclo-oxygenase-dependent mechanism[J]. J Bone Miner Res, 2003, 18(7):1317-1325.
[47]MacLeay JM, Olson JD, Enns RM, et al. Dietary-induced metabolic acidosis decreases bone mineral density in mature ovariectomized ewes[J]. Calcif Tissue Int, 2004, 75(5):431-437.
[48]Heer M, Frings-Meuthen P, Titze J, et al. Increasing sodium intake from a previous low or high intake affects water, electrolyte and acid-base balance differently[J]. Br J Nutr, 2009, 101(9):1286-1294.
[49]New SA, MacDonald HM, Campbell MK, et al. Lower estimates of net endogenous noncarbonic acid production are positively associated with indexes of bone health in premenopausal and perimenopausal women[J]. Am J Clin Nutr, 2004, 79(1):131-138.
[50]Macdonald HM, New SA, Fraser WD, et al. Low dietary potassium intakes and high dietary estimates of net endogenous acid production are associated with low bone mineral density in premenopausal women and increased markers of bone resorption in postmenopausal women[J]. Am J Clin Nutr, 2005, 81(4):923-933.
[51]Peacock M. Primary hyperparathyroidism and the kidney: Biochemical and clinical spectrum[J]. J Bone Miner Res, 2002, 17(Suppl 2):N87-N94.
[52]Buehlmeier J, Frings-Meuthen P, Remer T, et al. Alkaline salts to counteract bone resorption and protein wasting induced by high salt intake: results of a randomized controlled trial[J]. J Clin Endocrinol Metab, 2012, 97(12):4789-4797.
[53]Frassetto LA, Morris RC Jr, Sellmeyer DE, et al. Adverse effects of sodium chloride on bone in the aging human population resulting from habitual consumption of typical American Diets[J]. J Nutr, 2008, 138(2):419S-422S.
[54]Barzel US. Anion effects on calcium metabolism[J]. Miner Res, 1997, 12(2):298-299.
[55]Frassetto LA, Morris RC Jr, Sebastian A. Dietary sodium chloride intake independently predicts the degree of hyperchloremic metabolic acidosis in healthy humans consuming a net acid-producing diet[J]. Am J Physiol Renal Physiol, 2007, 293(2):F521-F525.
[56]Maruyama K, Akira S. Emerging molecules in the interface between skeletal system and innate immunity[J]. Pharmacol Res, 2015, 99:223-228.
(责任编辑:卢萍, 余小慧)
High salt intake and bone metabolismZHU Xiao-feng, ZHANG Rong-hua
(TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China.E-mail:tzrh@jnu.edu.cn)
[ABSTRACT]Osteoporosis has become a global public health problem, and dietary interventions may potentially be helpful in preventing this disorder. Salt (sodium chloride) is one of the most important dietary nutrients. High sodium chloride intake may play an important role in bone metabolism. In this paper, we reviewed the effects of high sodium chloride intake on bone mineral density, bone mineral content and bone biochemical markers, and analyzed the possible causes through currently available literature. Although there are a few inconsistencies results, we conclude a long-term high salt intake can reduce bone density or bone mineral content, change many biochemical markers of bone resorption, which may be caused mainly by increasing urinary calcium excretion and a low-grade metabolic acidosis. However, there are still many unclear aspects need further exploration.
[关键词]氯化钠; 骨质疏松; 骨代谢
[KEY WORDS]Sodium chloride; Osteoporosis; Bone metabolism
doi:10.3969/j.issn.1000- 4718.2016.02.030
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 020-85228202; E-mail: tzrh@jnu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.81173619; No.81473509);广东省自然科学基金资助项目(No.S2012040007531);广东建设中医药强省科研项目(No.20151178);暨南大学附属第一医院科研培育项目(No.2015103)
[收稿日期]2015- 11- 23[修回日期] 2015- 12- 24
[文章编号]1000- 4718(2016)02- 0371- 06

