小鼠慢性酒精中毒及戒断过程中抑郁样行为的改变及其共病机制*
蒋 曦, 田福荣, 赵应征
(1宁波明州医院药剂科,浙江 宁波 315100;2温州医科大学, 浙江 温州 325035)
小鼠慢性酒精中毒及戒断过程中抑郁样行为的改变及其共病机制*
蒋曦1 △,田福荣2,赵应征2
(1宁波明州医院药剂科,浙江 宁波 315100;2温州医科大学, 浙江 温州 325035)
[摘要]目的: 研究小鼠慢性酒精中毒及戒断过程中抑郁样行为的改变,进一步探讨酒精中毒与抑郁症的共病机制。方法: 构建新型慢性酒精中毒小鼠模型;实验分为正常对照组及慢性酒精7 d、14 d、21 d和28 d组。在第6、13、20和27天分别进行酒精偏好度测试,测试后戒断酒精1 d,随后次日进行抑郁行为学测试,测试结束后处死小鼠取海马与额叶皮层,采用高效液相色谱法测定5-羟色胺(5-HT)及去甲肾上腺素(NE)含量,采用免疫印迹法测定cAMP反应元件结合蛋白(CREB)和脑源性神经营养因子(BDNF)的含量。结果: 随着酒精饮酒天数及戒断次数的增加,小鼠表现出明显嗜酒现象,并且在强迫游泳和悬尾测试中,表现出明显的不动时间增加。7 d组小鼠额叶皮层内5-HT水平升高(P<0.05),海马与额叶5-HT水平在21 d与28 d组降低(P<0.01);7 d和14 d组小鼠海马与额叶NE水平无明显变化,21 d和28 d组NE水平降低(P<0.05)。21 d和28 d组小鼠海马与额叶内p-CREB/CREB比值及BDNF表达水平明显下降(P<0.05),7 d与14 d组无明显变化。结论: 酒精中毒、戒断阶段与抑郁的共病机制涉及5-HT。5-HT-cAMP-CREB-BDNF信号转导通路可能为酒精中毒与抑郁症的共病机制。
[关键词]酒精中毒; 抑郁; 5-羟色胺; cAMP反应元件结合蛋白; 脑源性神经营养因子
酒精成瘾与抑郁症均是中枢神经性疾病,两者的病理特点表现为脑内特定脑区大量神经细胞的凋亡,相关神经保护蛋白表达的减少,神经再生的减少。报道指出酒精成瘾与抑郁症存在关联性[1],相关临床前研究也发现酒精成瘾与抑郁症存在关联[2],临床研究也已证实抑郁症与酒精滥用有关[3],抑郁与酒精成瘾共病率高达70%[2],但两者的共病机制仍不明确。
本研究基于抑郁症的重要机制单胺假说,以及酒精成瘾与神经递质5-羟色胺(5-hydroxytryptamine,5-HT)等存在相关性[4],以脑内神经递质为突破口,进一步检测神经保护相关蛋白——环磷腺苷反应元件结合蛋白(cAMP response element-binding protein, CREB)和神经再生相关蛋白脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达,深入探讨神经递质→cAMP→CREB→BDNF通路是否为酒精成瘾与抑郁症两者的共病机制。本研究采用慢性酒精成瘾小鼠模型,并在经典模型基础上稍作修改,模拟临床酒精戒断后复饮的现象,观察小鼠在反复戒断及复饮时,抑郁样行为的改变、相关神经递质及相关蛋白表达的改变。
材料和方法
成年雄性ICR小鼠40只, 6~8周龄,购于中国科学院上海实验动物中心,实验动物许可证号为SYXK(浙)2010-0150。动物自由进食及饮水。所有实验和动物处理符合1986 年11 月24日欧洲共同体理事会指导,并通过复旦大学动物护理和使用委员会批准。所有的实验均在上午8:00~10:00进行。
2主要试剂和设备
2.1试剂无水乙醇购于无锡佳妮化工有限公司;5-HT、去甲肾上腺素(norepinephrine,NE)、5-羟基异丁酸(5-hydroxyisobutyric acid,5-HIAA)和3-甲氧-4-羟苯乙二醇(3-methoxy-4-hydroxyphenylglycol,MHPG)均购于 Sigma;BDNF抗体和ECL曝光液购于Abcam;CREB抗体、p-CREB抗体、兔Ⅱ抗及鼠Ⅱ抗均购于Santa Cruz;β-actin抗体购于Abcam;脱脂奶粉购于碧迪医疗器械有限公司;Tris-HCl购于Biosharp;APS、SDS、TEMED及BCA蛋白浓度测定试剂盒均购于上海碧云天生物技术有限公司;30%聚丙烯酰胺和PVDF膜购于Solarbio。
2.2设备BS110S型电子分析天平(北京赛多利斯天平有限公司);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);WH966漩涡混合器(太仓市科教器材厂);Allegra 64R超速冷冻离心机(Beckman Coulter);Agilent 1100 高效液相色谱仪(Agilent)。
3实验方法
3.1慢性酒精成瘾小鼠模型的建立64只小鼠分为慢性酒精成瘾7 d组、14 d组、21 d组、28 d组和相应的正常对照组,每组8只小鼠,共8组。3~5只小鼠饲养为1笼。以酒精和水的体积比为5%的初始浓度,按10 mL/kg量取酒水溶液。第2、3、4周酒精浓度分别为10%、20%和35%,将酒精溶液作为唯一的饮水来源。除正常对照组外,所有小鼠第1周给予5%酒精,慢性酒精成瘾7 d组及其正常对照组在第6天进行酒精偏好度测试,测试后停止给予酒精,戒断1 d后,进行强迫游泳测试和悬尾测试,测试后杀7 d组小鼠,取海马与额叶皮层组织,其它各组则模拟戒断和复饮过程,但并不进行行为学测试,在第7天开始给予20%的酒精,以此类推处理14 d组、21 d组和28 d组小鼠。正常对照组则在全过程中给予正常饮水。
3.2酒精偏好测试仿照糖水消耗实验方法[5],对小鼠进行酒精消耗测试。在小鼠进行抑郁行为学测试前1 d,每只小鼠单笼饲养,禁水24 h后同时给予酒精与水各1瓶,记录1 h内酒水与水各自的消耗量,用酒水消耗率来表示实验结果。酒水消耗率(%)= 酒水消耗量/(酒水消耗量+自来水消耗量)×100%。
3.3强迫游泳实验测试(forced swim test, FST)动物被迫在一个局限的空间中游泳,首先以游泳、攀爬、挣扎试图逃脱,随后即进入一种被称为“行为绝望”的不动状态,以反映动物的抑郁状态。实验时将对照组、慢性酒精组小鼠逐只放入高45 cm、直径20 cm、水深20 cm的游泳水槽中,水温维持在(22±1)℃,观察6 min,记录后4 min内小鼠的绝对不动时间[6]。
3.2 【指南建议】 表型相关的临床信息是测序数据解释的组成部分。在开始检测之前,临床信息必须进行咨询的临床医生以标准格式提交,优先使用人类表型本体术语。此外,临床医生还应提供影像资料(至少要有报告,最好能补充相关图像)以支持对胎儿的表型发现。鼓励实验室建立便于提交标准化表型信息的系统,这些信息作为检测申请过程的一部分。
3.4悬尾实验测试(tail suspension test,TST)根据相关文献[6],在距尾尖约1 cm 处用胶布把小鼠悬于高50 cm 的位置。小鼠被悬于高处会立刻出现逃生样行为,然后转变为被动不动。过了最初的挣扎期后小鼠会适应不动状态, 类似于绝望和精神抑郁的状态。测试时间为6 min,记录后4 min内的累计不动时间,精确到秒。
3.5高效液相色谱法采用高效液相色谱法测定小鼠海马及额叶皮质内单胺递质的含量。7 d、14 d、21 d和28 d行为学测试后,断头处死小鼠,迅速剥离大脑,分离出海马和皮质,称重,放入-80 ℃ 冰箱中保存。测试时,每100 mg组织置于200 μL冰冷高氯酸(浓度为0.4 mol/L,溶液 A)中超声匀浆。匀浆液避光置于冰上1 h,使其充分裂解,然后置于12 000 r/min 4 ℃离心20 min,丢弃沉淀。160 μL上清液加入至80 μL的溶液B(0.2 mol/L柠檬酸、0.3 mol/L磷酸氢二钾和0.2 mol/L EDTA)。混合液避光在冰上孵育1 h,之后,再次进行离心,转速为12 000 r/min,温度为4 ℃,离心20 min。取样品上清液经过0.22 μm 孔径的过滤器处理,然后再取20 μL 进行高效液相色谱分析。该色谱柱为 Diamonsilim C 18(150 mm ×4.6 mm,5 μm),采用CoulArray电化学检测器(ESA Inc.)。流动相组分为125 mmol/L枸橼酸-柠檬酸钠缓冲液(pH 4.3)、0.1 mmol/L EDTA、1.2 mmol/L辛烷基磺酸钠和18%甲醇。流动相的流速为1.0 mL/min。脑组织中单胺及其代谢产物的含量以ng/g组织湿重表示。
3.6蛋白免疫印迹法各组小鼠在对应天数进行行为学测试后处死,在4 ℃条件下迅速剥离大脑,用生理盐水洗去血渍后分离出海马和皮质,分别置预冷的RIPA 裂解液中进行组织匀浆。用 BCA 蛋白定量试剂盒进行蛋白定量,经过上样电泳及转膜后,蛋白转移至PVDF膜上。室温下用5%脱脂奶粉封闭 1 h或4 ℃封闭过夜, 随后用TBST 洗膜3次, 加入BDNF的 I 抗(稀释倍数为1∶1 000)、p-CREB或CREB的I抗(稀释倍数为1∶200)4 ℃孵育过夜。用TBST洗膜3 次, 每次7 min, 加入相应的II抗(稀释倍数为1∶10 000), 孵育1 h。用TBST 洗膜3 次。曝光显影后,用薄层扫描分析仪分析结果。
4统计学处理
采用SPSS 16.0统计软件包进行统计学处理,数据以均数±标准误(mean±SEM)表示,数据进行多因素方差分析。多因素方差分析,给予酒精与不给予酒精及不同酒精浓度作为组间因素,当出现多个时点的比较,时点的变化均为组内因素,数据之间的多重比较采用Duncan检验。单因素方差分析中,采用Dunnett’st检验进行多重比较。以P<0.05为差异有统计学意义。
结果
1慢性酒精成瘾过程中对酒精的依赖程度
如图1所示,与正常对照组相比,7 d组小鼠对酒精的偏好程度有所增加,但差异无统计学意义,而14 d组、21 d组和28 d组小鼠对酒精的偏好程度显著增加,差异具有统计学意义(P<0.01)。

Figure 1.The effects of chronic alcohol consumption on alcohol preference test in 7 d, 14 d, 21 d and 28 d groups. Mean±SEM.n=8.**P<0.01vs0 d group.
图1酒精偏好行为学结果
2慢性酒精成瘾戒断对抑郁样行为学的影响
各组小鼠戒断1 d后的抑郁行为学如图2所示,7 d与14 d组小鼠在戒断1 d后的FST和TST中,与对照组相比,不动时间并无显著变化,差异无统计学意义。21 d组与28 d组小鼠经历7 d与14 d的戒断后复饮过程,FST的不动时间较正常对照组明显增加;在TST中,21 d与28 d组小鼠的不动时间与对照组相比较,也明显增加,差异具有统计学意义(P<0.05)。
3慢性酒精成瘾戒断对脑内海马和额叶皮层5-HT及NE水平的影响
如表1所示,7 d戒断组小鼠海马内5-HT水平与正常对照组相比略有升高,NE水平则无明显变化,差异均无统计学意义,14 d组小鼠脑内神经递质则无明显差异,而21 d与28 d组的5-HT与NE水平则明显降低(P<0.05);相对应的额叶皮层脑区,7 d戒断组小鼠皮层中5-HT水平与正常对照组相比明显升高(P<0.05),NE水平并无明显变化,但21 d及28 d组5-HT与NE水平随着饮酒时间与戒断次数的增加,呈阶梯式降低,差异具有统计学意义(P<0.05),见表2。
4慢性酒精成瘾戒断对脑内海马和额叶皮层p-CREB和BDNF表达的影响
21 d和28 d酒精戒断组小鼠海马内pCREB和BDNF的蛋白水平与正常对照组相比明显降低(P<0.05),而7 d和14 d组表达并无明显变化;相应的21 d和28 d组小鼠额叶皮层的p-CREB和BDNF蛋白水平也明显降低(P<0.05),7 d和14 d组蛋白表达与正常组相比差异并无统计学意义,见图3、4。

Figure 2.The effects of chronic alcohol consumption on force swimming test (A) and tail suspension test (B) in 7 d, 14 d, 21 d and 28 d groups. Mean±SEM.n=8.*P<0.05,**P<0.01vs0 d group.
图2抑郁样行为学强迫游泳和悬尾实验结果
表1海马单胺递质含量测定结果
Table 1.The effects of chronic alcohol consumption on the concentrations of 5-HT, NE and their metabolites in hippocampus of mice (ng/g tissue. Mean±SEM.n=8)

Group5-HT5-HIAANEMHPGControl313.98±22.90237.36±30.40237.85±33.50191.18±22.40Alcohol7d365.45±23.60231.21±30.30239.34±27.80192.49±20.50Alcohol14d268.94±25.00214.33±24.10206.83±21.90184.33±13.80Alcohol21d205.75±24.50*222.60±16.70148.31±11.00*198.80±16.50Alcohol28d193.40±14.10**219.71±40.90145.80±16.40*192.36±24.20
*P<0.05,**P<0.01vscontrol group.
表2额叶皮层单胺递质含量测定结果
Table 2.The effects of chronic alcohol consumption on the concentrations of 5-HT, NE and their metabolites in frontal cortex of mice (ng/g tissue. Mean±SEM.n=8)

Group5-HT5-HIAANEMHPGControl323.91±16.40233.35±27.40304.46±31.40217.85±39.80Alcohol7d406.39±50.30**240.36±38.20295.10±34.40220.15±28.40Alcohol14d264.46±37.00244.76±33.50284.57±31.10229.12±24.60Alcohol21d218.10±30.60*238.41±38.60189.86±35.20*216.08±23.90Alcohol28d186.16±28.80**229.21±33.80181.88±21.30*218.77±31.20
*P<0.05,**P<0.01vscontrol group.
讨论
酒精是一种人类历史上使用时间最长的成瘾药物。适量饮酒对机体并无害,但过量饮酒会导致中枢神经系统受损。额叶皮层是受损最为明显的脑区,尸检结果发现皮层存在明显的神经元丢失[7]。同时酒精中毒也会损害重要的学习记忆脑区海马。研究发现海马胚胎培养细胞暴露于酒精中时会引起酒精导致的细胞活力明显降低,但如果暴露于BDNF时则会显著逆转酒精引起的神经毒性[8]。额叶皮层与海马调节着复杂的认知功能,如学习记忆、情绪和情感。酗酒可导致这2个脑区受损,酗酒者表现出判断力下降,情感麻木,洞察力变弱,社交退缩。这些表现与抑郁症的表现惊人地相似,同时海马与皮层也是抑郁症最易累及的脑区[9]。酒精中毒与抑郁症均为神经退行性疾病,有着相似的病变脑区,临床研究发现,酒精依赖及戒断的患者首先多表现为:兴奋、躁动、敌对攻击、伤人毁物,并出现幻觉,随着依赖程度的加深及戒断次数的增多,患者可能出现焦虑、抑郁等伴随症状。临床也将抗抑郁药物——选择性5-HT重摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)作为酒精成瘾的治疗药物之一,这提示两者可能存在共同的发病机制。
单胺假说作为抑郁症的经典发病机制之一,主要阐述的是脑内神经递质(5-HT、NE等)失衡导致抑郁的发病,但5-HT和NE不仅仅与抑郁相关,近年来大量研究发现其与酒精成瘾、酒精依赖相关,其中5-HT与酒依赖之间的相关性已被公认,但目前其病理生理机制尚未研究清楚。本次研究以酒精中毒为模型,探究酒精与抑郁的共病机制,结果发现,在酒精摄入初期(7 d~14 d),海马和额叶的5-HT神经递质水平升高,且并无抑郁样行为出现,而在酒精中毒中后期(14 d~28 d),5-HT与NE递质水平明显降低,出现抑郁样行为。这一结果在酒精的相关研究中得到部分验证,即人体长期饮酒和中枢5 -HT 能神经递质呈负相关,中枢5-HT 能神经递质的浓度随着饮酒时间的延长而降低[10],并且近期研究也发现5-HT受体亚型的活性与酒精摄入量密切相关,然而在饮酒后期的NE水平的变化并无相关研究可以佐证,同时在抑郁研究领域中,虽有大量临床病人调研及群众心理分析,至今仍无相关研究能说明长期饮酒后的神经递质改变与戒断阶段的抑郁症有关。以本实验结果为基础,结合经典单胺假说,不难发现5-HT与NE均是抑郁发病的重要神经递质,酒精摄入初期的递质水平升高可能是由于乙醇脱氢酶能催化酒精生成乙醛,乙醛可抑制催化5-HT的酶活性,减弱其降解[11],从而使5-HT 浓度增加,这也正符合临床应用中,使用抗精神病药缓解酒精中毒患者出现的幻觉症状,抗精神病药均在不同程度上减少突触间隙5-HT含量或阻断5-HT受体。但在酒精中毒及戒断加重的后期,本研究结果发现神经递质水平明显降低,这可能正是酒后抑郁症状出现的原因所在,因此本研究提出5-HT及其受体和受体后通路可能是酒精依赖与抑郁的共病机制这一观点。
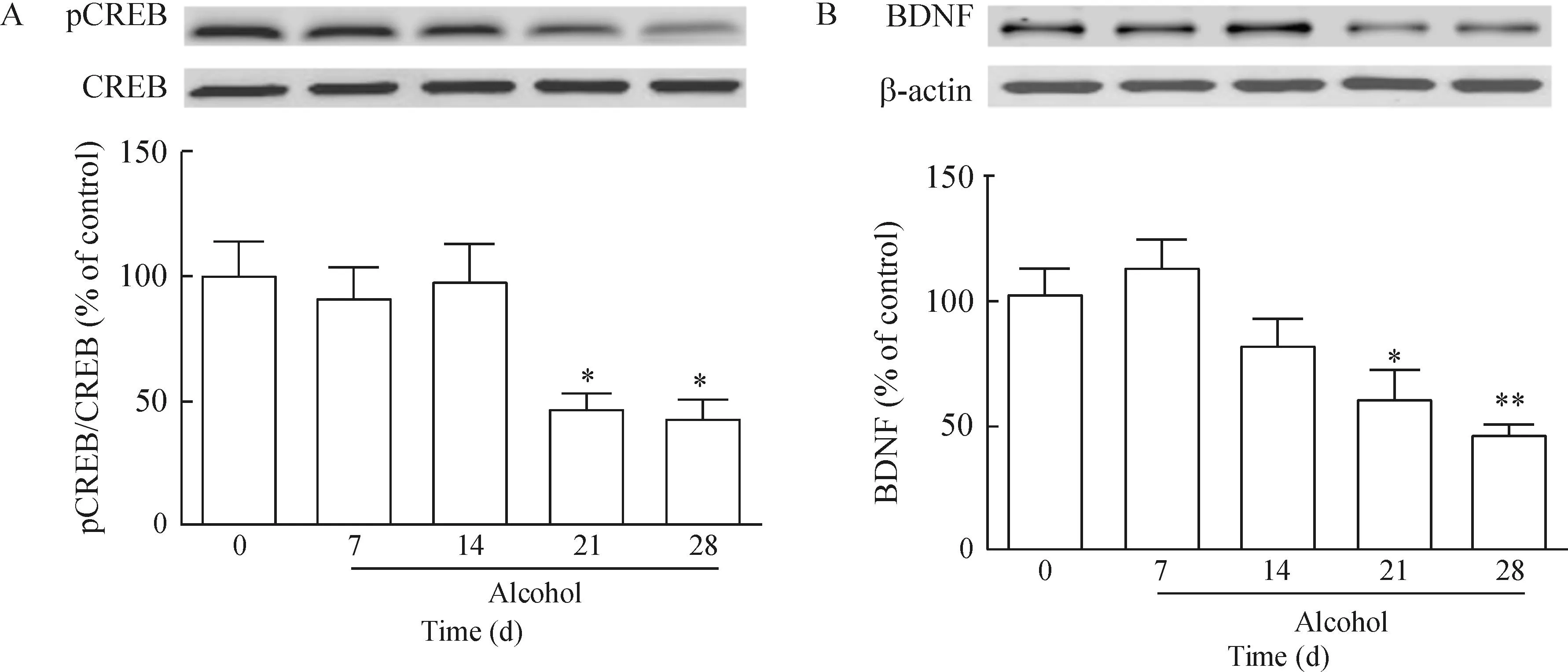
Figure 3.Western blot analysis for p-CREB, CREB (A) and BDNF (B) expression in hippocampus of 0 d, 7 d, 14 d, 21 d and 28 d groups. Mean±SEM.n=4.*P<0.05,**P<0.01vs0 d group.
图3海马p-CREB、CREB和BDNF蛋白表达结果

Figure 4.Western blot analysis for p-CREB, CREB (A) and BDNF (B) expression in frontal cortex of 0 d, 7 d, 14 d, 21 d and 28 d groups. Mean±SEM.n=4.*P<0.05,**P<0.01vs0 d group.
图4额叶皮层p-CREB、CREB和BDNF蛋白表达结果
CREB与BDNF是cAMP第二信使通路中重要的两类神经保护蛋白,相关研究发现慢性应激抑郁大鼠海马和额叶内cAMP含量、CREB和BDNF的表达都会相应发生变化[12-13],CREB通路的激活可以介导BDNF的表达从而促进神经元的再生[14]。CREB与BDNF不仅仅与抑郁症的发病密切相关,也与酒精中毒相关联。本实验的行为学结果表明,在酒精中毒后小鼠有明显的抑郁样行为出现,并且这种行为与海马与额叶中神经递质(5-HT和NE)紊乱有关,进一步检测2个脑区的CREB、p-CREB和BDNF的表达水平后,发现随着酒精摄入量及戒断次数的增加,CREB的磷酸化及BDNF的表达下降明显。这表明酒精中毒后的抑郁样行为与CREB和BDNF表达下降有关。慢性酒中毒、酒精戒断过程及抑郁症,均涉及神经退行性变和再生。CREB和BDNF在神经元的存活、生长、分化发育过程中发挥着重要的作用。不仅在神经发育过程中,在成人脑中BDNF也被认为参与了神经递质的调节,及神经元的可塑性,如长时程增强和学习,同时也参与了物质成瘾的过程。此外,相关研究还发现,BDNF水平下降会导致酒精消耗量增加,而其水平的增加则会减少酒精的摄入。重要的是,cAMP-CREB-BDNF通路也同样是5-HT及其受体后的相关通路之一[15],BDNF也与5-HT存在相互作用。当BDNF激活其受体TrkB时,可以使5-HT的合成及释放增加,从而增加突触间隙5-HT的浓度,达到减轻症状、治疗疾病的作用。这些结果均表明,调控5-HT-cAMP-CREB-BDNF信号通路可能是改善酒精成瘾的重要途径。
[参考文献]
[1]Hall M. Alcoholism & depression[J]. Home Healthc Nurse, 2012, 30(9): 543-550.
[2]Conner KR, Pinquart M, Gamble SA. Meta-analysis of depression and substance use among individuals with alcohol use disorders[J]. J Subst Abuse Treat, 2009, 37(2):127-137.
[3]Epstein JF, Induni M, Wilson T. Patterns of clinically significant symptoms of depression among heavy users of alcohol and cigarettes[J]. Prev Chronic Dis, 2009, 6(1):A09.
[4]Kruszewski SP. A possible association between SSRI drugs and alcohol dependence[J]. Int J Risk Saf Med, 2014, 26(2):55-56.
[5]Romano-Torres M, Fernandez-Guasti A. Estradiol valerate elicits antidepressant-like effects in middle-aged female rats under chronic mild stress[J]. Behav Pharmacol, 2010, 21(2):104-111.
[6]Kordjazy N, Haj-Mirzaian A, Amiri S, et al. Elevated level of nitric oxide mediates the anti-depressant effect of rubidium chloride in mice[J]. Eur J Pharmacol, 2015, 762(3):411-418.
[7]Navarro AI, Mandyam CD. Protracted abstinence from chronic ethanol exposure alters the structure of neurons and expression of oligodendrocytes and myelin in the me-dial prefrontal cortex[J]. Neuroscience, 2015, 293:35-44.
[8]Napper RM, West JR. Permanent neuronal cell loss in the cerebellum or rats exposed to continuous low blood alcohol levels during the brain growth spurt: a stereological investigation[J]. J Comp Neurol, 1995, 362(7):283-292.
[9]Reinhart V, Bove SE, Volfson D, et al. Evaluation of TrkB and BDNF transcripts in prefrontal cortex, hippocampus, and striatum from subjects with schizophrenia, bipolar disorder, and major depressive disorder[J]. Neurobiol Dis, 2015, 77:220-227.
[10]Berggren U, Eriksson M, Fahlke C, et al. Is long-term heavy alcohol consumption toxic for brain serotonergic neurons? Relationship between years of excessive alcohol consumption and serotonergic neurotransmission[J]. Drug Alcohol Depend, 2002, 65(2):159-165.
[11]Kalev-Zylinska ML, During MJ. Paradoxical facilitatory effect of low-dose alcohol consumption on memory mediated by NMDA receptors[J]. J Neurosci, 2007, 27(5):10456-10467.
[12]Pillai A, Dhandapani KM, Pillai BA, et al. Erythropoietin prevents haloperidol treatment-induced neuronal apoptosis through regulation of BDNF[J]. Neuropsychopharmacology, 2008, 33(8):1942-1951.
[13]张俊芳,张忠敏,赵鑫,等. 磷酸二酯酶4抑制剂咯利普兰逆转慢性束缚应激诱导的大鼠抑郁和焦虑样行为[J]. 中国病理生理杂志, 2012, 28(10):1729-1739.
[14]Xu Y, Pan J, Sun J, et al. Inhibition of phosphodiesterase 2 reverses impaired cognition and neuronal remodeling caused by chronic stress[J]. Neurobiol Aging, 2015, 36(2):955-970.
[15]Ignácio ZM, Réus GZ, Abelaira HM, et al. Epigenetic and epistatic interactions between serotonin transporter and brain-derived neurotrophic factor genetic polymorphism: insights in depression[J]. Neuroscience, 2014, 275:455-468.
(责任编辑: 陈妙玲, 罗森)
Change of depression-like behavior in chronic alcoholism and withdrawal model, and co-mechanism of depression and chronic alcoholism in miceJIANG Xi1, TIAN Fu-rong2, ZHAO Ying-zheng2
(1PharmaceuticalPreparationSectionofNingboMingzhouHospital,Ningbo315100,China;2WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:jiangxi901022@163.com)
[ABSTRACT]AIM: To investigate the behavior of depression in chronic alcoholism and withdrawal model of mice, and to explore the co-mechanism of alcoholism and depression. METHODS: A novel model of chronic alcoholism was constructed in this study. The animals were divided into normal control group, and alcohol 7 d, 14 d, 21 d and 28 d groups. The mice were given alcohol preference test on the 6th, 13th, 20th and 27th days. After the test, alcohol were withdrawn for 1 d, then the next day the mice were given behavior test of depression. After the test, the mice were sacrificed. The contents of 5-hydroxytryptamine (5-HT) and norepinephrine (NE) were detected by HPLC. The expression of cAMP response element-binding protein (CREB) and brain-derived neurotrophic factor (BDNF) was detected by Western blot. RESULTS: The mice showed an obvious drinking phenomenon, and the immobility time of forced swimming test and tail suspension test was significantly increased, with increasing drinking days and withdrawal times. 5-HT level in 7 d group mice only increased in frontal cortex (P<0.05). However, compared with control group, 5-HT levels in hippocampus and cortex were decreased on the 21th and 28th days (P<0.01). NE levels in 21 d and 28 d groups were decreased in hippocampus and frontal cortex (P<0.05), and no significant change was observed in 7 d and 14 d groups. The protein levels of p-CREB and BDNF were significantly decreased in hippocampus and frontal cortex of 12 d and 28 d groups (P<0.05), and no significant change was observed in 7 d group and 14 d group. CONCLUSION: The co-mechanism of alcoholism, withdrawal and depression is related to 5-HT. 5-HT-cAMP-CREB-BDNF signaling pathway may be a common mechanism for alcoholism and depression.
[KEY WORDS]Alcoholism; Depression; 5-hydroxytryptamine; cAMP response element-binding protein; Brain-derived neurotrophic factor
doi:10.3969/j.issn.1000- 4718.2016.02.018
[中图分类号]R363.21
[文献标志码]A
通讯作者△Tel: 0574-83009631; E-mail: jiangxi901022@163.com
*[基金项目]国家自然科学基金资助项目 (No. 81272160)
[收稿日期]2015- 08- 03[修回日期] 2015- 10- 09
[文章编号]1000- 4718(2016)02- 0296- 06

