心脏生物标志物肌红蛋白的生物传感检测方法
余 文 刘灵芝 谢国明
(重庆医科大学检验医学院,重庆 400016 )
综述
心脏生物标志物肌红蛋白的生物传感检测方法
余文刘灵芝谢国明*
(重庆医科大学检验医学院,重庆 400016 )
摘要:急性心肌梗死(AMI)有极高的发病率和病死率。心肌损伤标志物肌红蛋白在心肌梗死后1小时内便开始升高,是AMI发生后最早可检测的标志物之一。本文重点综述了基于纳米增强比色、局域表面等离子共振、荧光和电化学分析构建的肌红蛋白检测生物传感新方法,探讨了各类方法的优缺点及其在AMI即时检测和早期诊断中的应用。
关键词:急性心肌梗死肌红蛋白生物传感
1引言
急性心肌梗死(Acute myocardial infarction,AMI) 起病急,病情凶险,死亡率高。心电图是经典的用于诊断心脏疾病的方法,但心电图诊断AMI的阳性率仅为80%,灵敏性不够高,而且心肌梗死早期不会发生心电图特征性改变。另外,心电图不能诊断出非ST段抬高型心肌梗死,易导致临床抢救不及时,造成严重后果。因此,为克服心电图的局限性,心肌损伤标志物被广泛用于心肌梗死的诊断。
肌红蛋白(myoglobin,Mb)作为AMI发生后最早可检测的标志之一,在AMI发生后1小时内便开始释放入血,是目前应用最早的心肌损伤标志物。虽然Mb的特异性不高(如肌肉损伤时,Mb也会升高),但从病史和临床表现以及与其他指标联合诊断,能很好地鉴别出AMI,并且AMI患者Mb 的阳性率为92%[1]。此外,Mb的阴性预测价值达100%,即在疑似发生AMI的病人中,2h内Mb在正常范围,基本可以排除AMI。另外,Mb还可用于判断再梗死[2]。因此检测Mb具有重要的临床意义。一般将血清Mb浓度100ng/mL作为医学临界值。传统的Mb的检测方法如ELISA、荧光免疫分析、化学发光分析等操作繁琐,分析费时,且需要大型分析仪器,多需要将样本送到实验室或检验科进行检测,耗时,容易延误病情(表1)。因此,就需要更加简单、快速的分析方法,能够在病人发生AMI时即时快速地进行检测,生物传感分析方法满足了这一要求。近年来,Mb的新型传感检测方法不断被研发,其中包括金纳米颗粒比色分析、金纳米棒的局域表面等离子共振、微流体荧光芯片、荧光免疫层析以及基于石墨烯、ZnS修饰的纳米晶、自组装单分子膜等电化学分析方法(表2)。这类传感方法具有简单、快速、灵敏、准确、特异的优点。本文着重讨论这些方法的优点与不足,以及其在即时检测(Point of care test,POCT)和AMI的早期诊断中的应用。
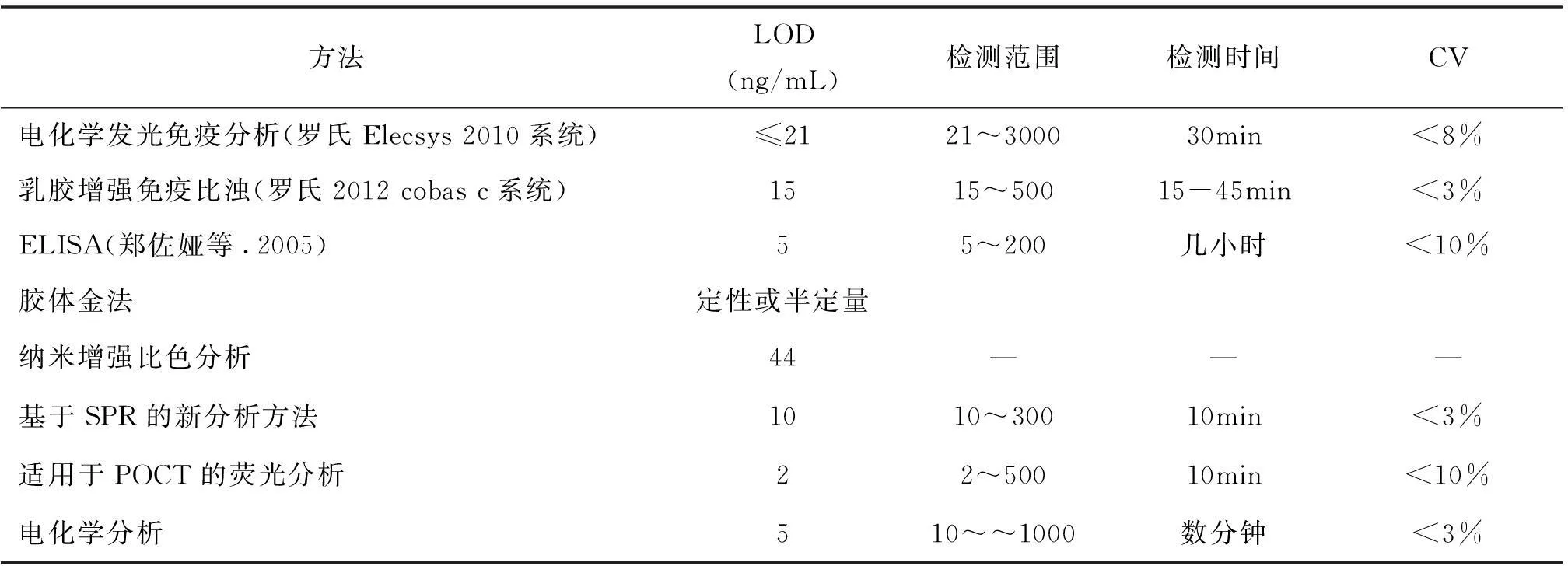
表1 临床常用方法与新传感方法比较

表2 肌红蛋白新传感方法比较
2肌红蛋白的传感检测方法
2.1比色分析方法
近年来,将金纳米粒子运用于比色分析体系,克服了传统比色分析方法灵敏度不高,不易定量等缺点,实现了灵敏、快速的定量检测。一种新型的基于脱氧核酶功能化的金纳米颗粒的比色方法被报道[3]。该比色方法的原理为:酶标板上固定肌红蛋白捕获抗体,当其与样品中的肌红蛋白结合后,再通过核酸适体链与脱氧核酶功能化的金纳米颗粒间接连接,最后加入底物,底物被氧化显色,实现肌红蛋白的比色检测。该方法肌红蛋白的检测线可达2.5nM(44ng/mL),具有良好的选择性。
2.2局域表面等离子共振传感方法
表面等离子共振(Surface plasmon resonance,SPR)是发生于两种介质临界面的等离子体的共振,局域表面等离子共振(Local surface plasmon resonance,LSPR)是指在贵金属纳米颗粒如金纳米颗粒或纳米棒上发生的表面等离子共振[4]。LSPR对周围介质更敏感。当靶分子结合到固定于金纳米颗粒表面的抗体时,能更灵敏地影响其折射率,产生更强的光吸收,导致检测到更明显的反射光强的改变,从而将传感器表面相互作用的靶分子的生物信号更灵敏地转化为光信号进行检测。
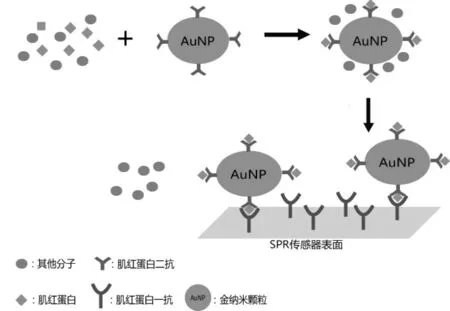
图1 金纳米粒子增强SPR反向夹心免疫法示意图
为提高传统SPR传感检测的灵敏度,基于金纳米微粒的反向夹心免疫表面离子共振技术已被报导[5],这是一种新型的高灵敏性的表面等离子共振传感方法(图1)。在金纳米颗粒表面包被肌红蛋白二抗,先将其加入待测标本中,使其与标本中的抗原(肌红蛋白)相结合,形成蛋白-胶体金复合物,此复合物再与生物传感表面的肌红蛋白一抗结合,引起更高的折射率的改变,产生检测信号,该方法最低检测线可达0.18ng/mL。由于没有一个生物指标能反映AMI的全过程,因此临床急需多个心肌标志物联合检测,以提高临床诊断的灵敏性和特异性。Tang L等[6]建立了基于LSPR的生物传感方法,这是首次运用金纳米棒技术同时检测两种心肌标志物即CTnT和Mb的LSPR方法。金纳米棒是一种尺度从几纳米到上百纳米的棒状金纳米颗粒,金纳米棒的表面等离子体共振波长可以随金纳米棒的长宽比变化。金纳米棒长宽比为2.1和4.2时,它们各自对应的共振波长为640nm和830nm。在这两种金纳米棒表面固定相应的抗体,可分别用于检测肌红蛋白和肌钙蛋白。当生物标本中含有相应的靶分子时,其与相应抗体结合,金纳米棒生物传感器便会将这种生物信号转变为光信号,且光信号的改变与靶分子的浓度成正比(图2)。
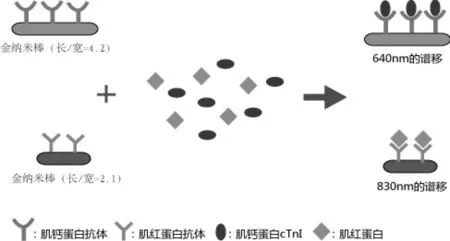
图2 基于金纳米棒的多路LSPR传感方法示意图
以上的检测方法均利用抗体来特异地结合靶抗原,但抗体的成本相对较高,且抗体不易保存,因此需要不断探索更加稳定的抗体替代物。目前,已有基于分子印迹聚合物(MIPs)的SPR传感器被报导。在SPR传感器表面通过微印迹方法覆盖一层MIPs修饰的金纳米薄膜,用于捕获肌红蛋白[7]。该方法最低检测线26.3ng/mL,功能灵敏度为87.6ng/mL。此传感方法具有不依赖抗体、价格低,检测结果易于保存等优点。
总之,LSPR方法是一种无需标记,操作简单,价格低的分析方法。近年来,其灵敏度不断被提高,金纳米棒的运用实现了多种心肌标记物同时检测,若将LSPR方法与微流体芯片、矩阵列技术相结合,有望实现床旁即时检测,尽管目前还没有在微流体芯片或矩阵列中结合LSPR免疫传感方法检测心肌标志物的报道,但是这种方法能实现多通量、多指标的灵敏快速测定,是未来很具潜能的研究方向。
2.3荧光分析方法
荧光检测方法具有极高的灵敏度,但是传统的荧光检测方法操作比较繁琐,易受背景荧光的干扰,分析成本高。近年,为克服传统荧光检测的不足,新型的基于荧光的生物传感方法被大量研究。
2.3.1改进的荧光分析
为减少背景荧光干扰,提高灵敏度,一种基于超顺磁性微球的荧光免疫分析方法被报导。在一种改进的超顺磁性微球表面进行双抗体夹心荧光检测,用于联合检测肌红蛋白和心型脂肪酸结合蛋白[8]。其对于肌红蛋白的检测下限为25ng/mL,对于心型脂肪酸结合蛋白的检测下限为1ng/mL。此外,将图像分析技术用于旋转相位荧光免疫分析是克服背景荧光,提高灵敏度的又一方法[9]。其对肌红蛋白的检测线可达700fM。这种新型的分析方法通过CCD相机采集旋转固相荧光信号,再由特定图像分析程序得到肌红蛋白浓度,具有灵敏、快速、简单的优点。为使荧光检测方法的操作更加简单,结果更加灵敏。研究发现将脂质体用于荧光免疫方法检测肌红蛋白,比酶联放大的荧光检测更具优势[10]。采用荧光染料封装的脂质体使得该方法检测限可达11.3pg/mL,具有极高的灵敏度,检测速度快(13分钟完成检测),同时脂质体非常稳定,能够较长时间储存。
2.3.2基于芯片技术的荧光分析
目前,已有一种新型的基于荧光的肌红蛋白检测芯片研制成功[11]。这种芯片在双抗体夹心的基础上使用了微流体技术,具有高通量、样品用量少、分析速度快的特点。通过CCD相机检测荧光强度,从而对肌红蛋白进行定量。这种免疫传感器的线性范围为20ng/mL~230ng/mL,检出限为16ng/mL。由该芯片制作的便携式免疫传感器盒具有小型性,便携,简单,快速的优点,能在10分钟内迅速获得结果,适用于POCT。此外,利用该方法的原理,可以在微通道内实现多个心脏标志物的平行检测,如联合检测肌红蛋白和肌钙蛋白等,提高AMI的检出率。
2.3.3基于免疫层析的荧光分析
免疫层析试纸条具有小型便携、操作简便、分析快速的优点,是国内外实现POCT应用最为广泛的方法。其对于肌红蛋白的检测已从传统的定性检测发展到定量检测[12,13]。但以往的免疫层析试纸条法多存在灵敏度不高、重复性差,准确度不高等缺点。为提高传统免疫层析检测的灵敏度和准确度,大量研究被报道,其中包括将双纳米金粒子用于侧向免疫分析法,实现肌钙蛋白和肌红蛋白的联合超灵敏定量检测,且分析灵敏度分别为9ng/mL和10ng/mL[14]。另外,还有报导将荧光技术用于侧向免疫层析试纸条,联合检测AMI生物标志物[15]。在一个荧光免疫层析试纸条上,联合检测肌红蛋白、肌钙蛋白、CK-MB。该方法分析速度快,只需12分钟便可完成检测;灵敏度高,其中肌红蛋白检测线为1ng/mL。为减少侧向荧光免疫分析方法背景荧光的干扰,一种基于二维纸色谱检测急性心肌梗死标志物的荧光免疫传感方法被报导[16],该方法在传统的侧向荧光免疫分析方法基础上增加了一个自动洗涤过程,对多种心脏标志物进行联合检测,其对于肌钙蛋白、CK-MB、肌红蛋白的检测限分别为0.02ng/mL,0.2ng/mL,2ng/mL。
总之,荧光分析方法是灵敏度极高的分析方法,其中荧光芯片技术、荧光定量免疫层析技术,还具有操作简单、灵敏、特异、准确、样品用量少及分析速度快的优点。设计为便携式仪器,可用于POCT。但是,荧光分析方法多需要特殊的荧光检测仪器进行荧光测定,且荧光抗体一般较贵,不易制备,限制了该类方法的推广。
2.4电化学分析方法
电化学方法是将生物信号转变为电信号检测的一种分析方法。这种方法具有分析速度快、无需标记、不需复杂的样品预处理、分析范围广、灵敏度高、特异性好等优点。目前,纳米材料已被广泛用于各种电化学免疫传感器,聚苯胺和聚吡咯等有机纳米材料的运用,更增加了无机纳米材料的生物相容性。为早期诊断急性心肌梗死,用于检测肌红蛋白的电化学检测方法也被广泛研究。
2.4.1单聚苯胺纳米线的电化学方法
单聚苯胺纳米线是一种有机纳米材料,其比无机纳米材料具有更好的生物相容性,基于单聚苯胺纳米线的检测肌红蛋白的传感方法已显示出其独特的性能[17]。在单聚苯胺纳米线的表面固定有肌红蛋白抗体,用于捕获样品中的肌红蛋白。当肌红蛋白结合到纳米线表面时,引起纳米线电导的改变,从而将生物信号转变为电信号,该传感器检测限为1.4ng/mL。为实现多标志物联合检测,以及进一步提高检测灵敏度,单聚苯胺纳米线和微流体技术相结合的用于检测心脏标志物的电导传感器已被研发[18]。结合单聚苯胺纳米线与微流体通道技术,能够检测到更低浓度的心肌损伤标志物,其中Myo、CTnI、CK-MB、BNP的检测下限分别为0.1ng/mL、0.25ng/mL、0.15ng/mL 、0.05ng/mL。此传感器线性范围宽,具高灵敏度和高特异性,检测速度快(只需几分钟),且可用于多个标志物联合检测,适合于即时检验。
2.4.2基于ZnS纳米晶修饰的电化学传感方法
羧基功能化的ZnS纳米晶是一种半导体纳米晶,其易于制备,具有良好的生物相容性,拥有较大的表面积,为抗体的结合提供了丰富的位点。2012年,将巯基丙酸修饰的ZnS纳米晶与自组装单分子膜(SAM)相结合的电阻抗生物电极研制成功[19]。其用于检测心肌生物标志物肌红蛋白的线性范围为10ng/mL~1μg/mL。在ITO玻璃电极表面上覆盖一层3-氨丙基三乙氧基硅烷自组装单分子膜,然后在SAM上共价连接3-巯基丙酸修饰的ZnS纳米晶。最后将捕获抗体共价结合到ZnS纳米晶的自由羧基上,从而构成抗体/ZnS纳米晶/自组装单分子膜/ITO玻璃的生物电极(图3)。ITO-SAM-ZnS纳米晶电极检测原理是当抗原与电极表面抗体结合后引起电极电阻抗的改变,从而将生物信号转变为电信号。
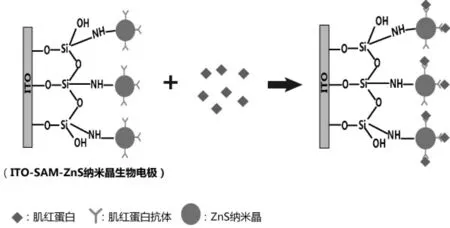
图3 ITO-SAM-ZnS纳米晶电极检测原理
Sujeet K. Mishra等将修饰后ZnS纳米晶用于传统石墨烯电极表面构成复合生物电极(图4),ZnS/RGO复合电极的电阻抗响应灵敏度是普通RGO电极的2.5倍,此复合生物电极对于肌红蛋白的响应线性范围是10ng/mL ~1μg/ml[20]。

图4 ITO-GRO-ZnS纳米晶生物电极的制作示意图
2.4.3基于导电聚合物的电化学传感方法
导电聚合物具有良好的导电性能,是构建生物传感器的新型有机纳米材料。而聚吡咯纳米粒子导电聚合物与其它导电聚合物相比具有良好的环境稳定性和生物相容性,因而在生物传感器领域应用更为广泛[21]。有文章报导将吡咯/N-(2-羧乙基)吡咯纳米粒子(AuNP-PPy-PPa)导电聚合物用于石墨烯电极表面构成新型生物电极检测肌红蛋白[22]。在玻碳电极的石墨烯表面(RGO)合成含有金纳米颗粒的吡咯/N-(2-羧乙基)吡咯纳米薄膜(AuNP-PPy-PPa),构成AuNP-PPy-PPa/RGO多聚纳米膜,此多聚纳米膜具有具有良好的电化学活性、电化学稳定性。然后在其表面共价偶联肌红蛋白抗体,构成免疫阻抗传感器,在PBS中即可进行电化学阻抗谱分析,实现肌红蛋白的定量检测,其检测的线性范围为10ng/mL~1μg/mL。
2.4.4双向液晶分子膜电化学传感方法
首次运用双向液晶分子膜于电化学免疫传感器已有报道[23],即在玻璃碳电极表面镀上电活性离子液晶膜,然后在液晶膜表面覆盖聚乙烯亚胺功能化的金纳米颗粒薄膜(AuNP-PEI),最后连接肌红蛋白抗体,检测肌红蛋白。液晶的应用提高了电极的敏感性和传导性。该免疫传感器的检测的线性范围为9.96ng/mL~72.8ng/mL,检测限为6.29ng/mL。
2.4.5Aptamer与MIPs的电化学传感方法
分子印迹聚合物(MIPs)与寡核苷酸配基(aptamer)均为天然抗体的替代物,克服了天然抗体制备成本较高、化学稳定性较差的缺点。且具有对目标分子有良好的选择性、热力学稳定性好、机械强度高、易于制备、可多次重复使用的优点,因此愈加受到了人们的青睐。
已有报导在丝网印刷电极的石墨表面覆盖一层MIPs检测肌红蛋白[24]。该电极具有良好的选择性和较高的灵敏度,其检测限达79ng/mL。此外,也有利用aptamer修饰的RGO/碳纳米管纳米结构电极通过直接电子转移检测肌红蛋白的研究[25]。其检测限为0.34ng/mL,检测范围为1ng/mL~4μg/mL。
2.5其他方法
文献[26]报导了一种利用个人血糖仪检测心肌肌红蛋白的方法,这种方法在聚苯乙烯微孔板里形成肌红蛋白抗体-肌红蛋白-酶联核酸适体的夹心模型,酶使体系中淀粉转化为葡萄糖,从而利用个人血糖仪检测出肌红蛋白浓度。这种方法的灵敏度可达50pM,不需特别仪器,价格便宜,但是此方法分析速度慢,还需进一步研究。
3结束语
AMI是临床危重症之一,为实现AMI的即时快速检测,新型生物传感检测方法是研究的热点。其中纳米增强比色方法,在传统的比色方法上运用金纳米离子,提高了比色方法的灵敏度。局域表面等离子共振通过复合金纳米棒的运用,实现了无需标记的多项指标联合检测。荧光免疫层析分析、顺超磁性微球荧光技术等克服了传统荧光检测背景荧光、操作复杂、分析费时的缺点。石墨烯、ZnS纳米晶、以及聚吡咯纳米粒子等导电聚合物运用于传统的电化学分析,提高了生物电极的导电性、灵敏性、特异性、生物相容性。MIPs与aptamer作为抗体的替代物,与靶分子结合有高度特异性,且易于制备和保存,可多次重复使用,已被用于各种分析检测。
尽管如此,这些新型传感方法仍然存在一些不足,如纳米增强比色分析易受胆红素、血脂等干扰;表面等离子共振与荧光分析方法需要特殊的检测仪器进行检测,且荧光抗体价格昂贵;电化学分析中电极的稳定性和重复性易受导电聚合物等新型纳米材料的固定技术影响。此外,这些检测方法多用血清或血浆进行检测,仍需对标本进行离心;且线性范围多较窄,对高浓度的肌红蛋白检测时多需稀释。今后的研究将探索对全血直接进行检测,简化操作步骤,缩短检测时间,降低检测成本,同时提高检测方法的稳定性、重复性等。随着这些问题的解决,结合纳米技术与微流体技术等的生物传感方法,将实现多项指标的联合、快速检测,且灵敏度高,特异性好,能够实现AMI以及临床其它疾病的即时检测。
参考文献
[1] 焦文学,王洁.检验医学与临床,2012,9(14):1777.
[2] 府伟灵,徐克前.临床生物化学检验.5版. 北京:人民卫生出版社,2011:221.
[3] 杨晓涵,王青,羊小海,等.第八届全国化学生物学学术会议论文摘要集.
[4] 杨彦,戴宗,邹小勇.分析测试学报,2009,28(11):1344-1350.
[5] Gnedenko O V,Mezentsev Y V,Molnar A A,Lisitsa A V,et al.Analytica Chimica Acta,2013,759: 105-109.
[6] Tang L,Casas J. Biosensors and Bioelectronics,2014,61: 70-75.
[7] Osman B,Uzun L,Besirli N,et al.Materials Science and Engineering C,2013,33(7): 3609-3614.
[8] Wang J,Ren L,Wang X,Wang Q,Wang Z,et al.Biosensors and Bioelectronics,2009,2(10):3097-3102.
[9] Wahanti P,Taylor T,et al.Analyst,2011,136(2):375-373.
[10] Edwards K A,Meyers L J,leonard B,Baeumner A J.Analytic and Bioanalytic Chemistry,2013,405(12):4017-4026.
[11] Darain F,Yager P,Gan K L,Tjin S C.Biosensors and Bioelectronics,2009,(6): 1744-1750.
[12] 刘宇,周荣斌.中国全科医学,2011,(17):1903-1904.
[13] 刘厚明,江先雨,等.国际检验医学杂志,2015,(6):822-824.
[14] Zhu J,Zou N,Mao H,Wang P,et al.Biosensors and Bioelectronics,2013,42: 522-525.
[15] Kim T K,Oh S W,et al.Journal of Clinical Laboratory Analysis,2014,28(6): 419-427.
[16] Cho J H,Kim M H,Mok R S,et al.Journal of Chromatography B,2014,967:139-146.
[17] Lee I,Luo X,Cui XT,Yun M.Biosensors and Bioelectronics,2011,26(7): 3297-3302.
[18] Lee I,Luo X L,et al.Biosensors,2012,2(2):205-220.
[19] Mishra S K,Kumar D,et al.Bioelectrochemistry ,2012,88:118-126.
[20] Mishra S K,Srivastava A K,et al.Nanoscale,2013,5(21):10494-10503.
[21] 谢爱娟,程文,等.分析测试学报,2012,31(11):1464-1470.
[22] Puri N,Niazi A,Srivastava A K,et al.Applied Biochemistry and Biotechnology,2014,174(3):911-925.
[23] Zapp E,Westphal E,Gallardo H,et al.Biosensors and Bioelectronics,2014,59: 127-133.
[24] Moreira F T,Sharma S,Dutra R A,Noronha J P,et al. Microchimica Acta,2015,182: 975-983.
[25] Kumar V,Shorie M,Ganguli A K,Sabherwal P. Biosensors and Bioelectronics,2015,72:56-60.
[26] Wang Q,Liu F,Yang X,Wang K,Wang H,Deng X. Biosensors and Bioelectronics,2015,64:161-164.
《分析仪器》杂志通过国家学术期刊认定
2014年12月10日,《分析仪器》杂志通过国家新闻出版广电总局认定,成为首批国家认定的学术期刊。在我国,由国家新闻出版行政部门组织对学术期刊进行认定尚属首次。
Biosensing methods for detection of cardiac biomarker myoglobin.YuWen,LiuLingzhi,XieGuoming
*(DepartmentofLaboratoryMedicine,ChongqingMedicalUniversity,Chongqing400016,China)
Abstract:Acute myocardial infarction (AMI) has extremely high morbidity and mortality worldwide. Myoglobin as one of the biomarkers for earlier AMI detection is increased apparently after AMI within 1h. The latest sensing methods of myoglobin detection were reviewed in this paper,including the nano-particals enhancing colorimetric detection,local surface plasmon resonance,fluorescence immunoassays and electrical detection. The advantages,disadvantages and their applications in the point of care test (POCT) and earlier detection of AMI were concluded.
Keywords:acute myocardial infarction; myoglobin;biosensing
收稿日期:2015-06-08
DOI:10.3936/j.issn.1001-232x.2016.01.001
作者简介:余文,女,1993年出生,重庆医科大学检验学院本科生,研究方向为生物传感与及时检测,E-mail:109130177.qq.com。

