FOXC1蛋白在食管鳞状细胞癌中的表达及临床意义
聂丽敏 王琳琳 刘 杰 高 薇 林文俐 乔 丽 孙玉萍
(泰山医学院,山东 泰安 271016)
FOXC1蛋白在食管鳞状细胞癌中的表达及临床意义
聂丽敏王琳琳刘杰高薇林文俐乔丽1孙玉萍
(泰山医学院,山东泰安271016)
〔摘要〕目的探讨FOXC1蛋白在食管鳞状细胞癌(ESCC)中的表达及其与肿瘤的病理类型、分化程度、TNM分期和淋巴结转移等临床病理特征之间的相关性。方法采用免疫组化法分别检测FOXC1在94例ESCC组织及47例癌旁正常组织中的表达,并结合临床病理学参数进行统计学分析。结果FOXC1蛋白阳性表达主要定位于ESCC细胞的胞质,少数同时定位于胞核;ESCC及癌旁正常组织中Foxc1阳性表达率有显著差异(P=0.000);FOXC1在ESCC低分化组(96.7%)、T3+T4期组(90.3%)及淋巴结阳性组(95.0%)的阳性表达率均明显高于相应的中高分化组(75.0%)、T1+T2组(71.4%)和淋巴结阴性组(72.2%),P值分别为0.011、0.018和0.005;而与性别、年龄等无明显相关性(P均>0.05)。结论FOXC1的高表达可能在ESCC的发生发展及侵袭转移过程中发挥重要作用。
〔关键词〕FOXC1;食管鳞状细胞癌;上皮间充质转化
1山东大学附属济南市中心医院肿瘤科
第一作者:聂丽敏(1984-),女,硕士在读,主要从事肿瘤基础研究。
我国是世界上食管癌的高发国家,食管癌校正死亡率居世界首位〔1〕。然而,大部分食管鳞状细胞癌(ESCC)患者对现有的治疗手段不敏感,疾病控制率低,患者难以获得满意的生活质量,总体生存期短。以往研究表明,FOXC1从上皮间充质转化(EMT)、细胞信号转导和血管内皮细胞形成等多方面影响肿瘤细胞的分裂、增殖和侵袭转移能力,其高表达和肿瘤的发生发展及侵袭转移关系密切〔2~6〕,但有关FOXC1在ESCC中表达的研究国内外仍尚未有报道。本研究探讨FOXC1的表达在食管鳞癌发生发展过程中可能的作用机制及临床意义。
1材料与方法
1.1标本的采集 收集济南市中心医院病理科2008年1月至2012年12月术后病理均诊断为ESCC的存档组织蜡块94例,患者均为首次手术,术前均未接受任何的化疗、放疗及生物靶向治疗等治疗,均有详细的临床资料。同时选取47例癌旁正常组织(距离癌组织5 cm 以上),经病理证实均未见癌细胞。94例ESCC患者,男81例,女13例;年龄44~81岁,中位年龄为62岁;伴有淋巴结转移者40例;TNM分期按2009年国际抗癌联盟(UICC)修订的标准:T1+T2期42例,T3+T4期52例;Ⅰ+Ⅱ期57例,Ⅲ+Ⅳ期37例;依据病理分化程度分为:高分化鳞癌15例,中分化鳞癌49例,低分化鳞癌30例。本研究获得医院伦理委员会批准,并遵循患者知情同意的原则。
1.2试剂试剂:羊抗兔FOXC1多克隆抗体购自英国Abcam公司,Max Vision兔抗羊多克隆抗体及DAB显色试剂盒均购自福建迈新生物技术有限公司。其余常用免疫组化试剂略。
1.3检测方法采用免疫组织化学法进行石蜡肿瘤组织抗原检测。所有肿瘤组织标本均经10%甲醛固定,石蜡包埋,连续3~4 μm切片。切片烤片后常规脱蜡至水。抗原在EDTA中高压修复2 min,磷酸盐缓冲液(PBS)冲洗3次,每次3 min,采用3%过氧化氢10 min阻断内源性过氧化物酶,蒸馏水冲洗1次,3 min,PBS冲洗2次,每次3 min,滴加一抗(50 μl/张),4℃孵育过夜,37℃复温30 min,PBS冲洗3次,每次5 min,滴加Max Vision二抗室温孵育15 min,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。用已知的阳性组织作阳性对照,用PBS代替一抗作阴性对照。
1.4结果判断具有正高职称的病理科医师3名双盲阅片,光镜下每张切片随机取20个高倍镜(400倍),记录每个视野下1 000个细胞中阳性着色细胞数,计算阳性百分率后取其平均值。FOXC1蛋白阳性表现为胞质或胞核黄色或棕黄色颗粒,记录阳性细胞比率:阳性细胞1%~30%计1分,30%~60%计2分,>60%计3分,细胞染色强度:0分为未着色,浅黄色为1分,黄色至棕黄色为2分,棕黄色为3分。然后记录二者的乘积,<3分为低表达,≥3分为高表达,即阳性表达。
1.5统计学方法采用SPSS18.0软件进行χ2检验。
2结果
2.1ESCC组织和癌旁正常组织FOXC1的表达情况ESCC组织中FOXC1蛋白表达主要位于肿瘤细胞质和部分细胞核,呈黄色或棕黄色颗粒;癌旁正常对照组织中几乎无FOXC1的表达,或仅在少数细胞核中有低水平的表达,呈浅黄色颗粒。见图1。ESCC组织中FOXC1阳性表达率显著高于正常对照组〔89.1%(77/94) vs 25.5%(12/47),χ2=42.791,P=0.000〕。
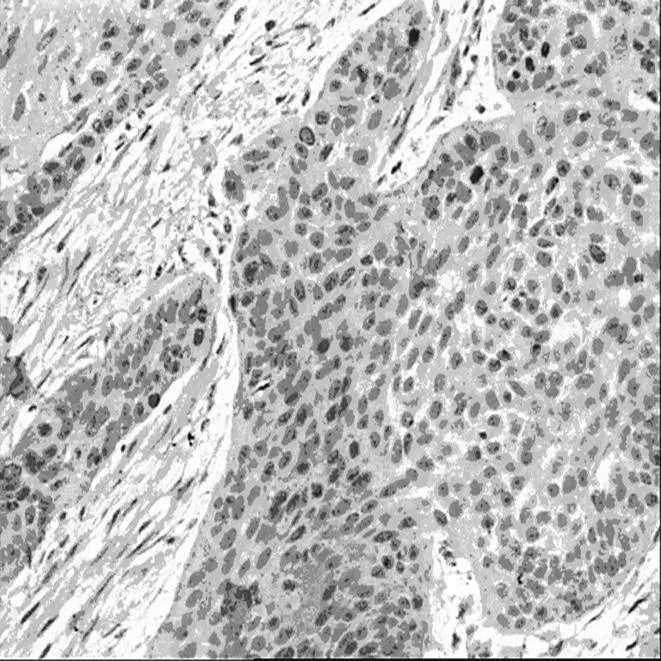
ESCC胞质阳性表达

ESCC胞质及胞核阳性表达

癌旁正常组织阳性表达
2.2FOXC1蛋白的表达与临床病理参数间的相关性FOXC1在ESCC低分化组、T3+T4期组及淋巴结阳性组的阳性表达率均明显高于相应的中高分化组、T1+T2组和淋巴结阴性组(P=0.011、0.018、0.005);而与性别、年龄等无明显相关性(P均>0.05)。见表1。

表1 FOXC1蛋白阳性表达与临床病理参数的关系〔n(%)〕
3讨论
转录因子是一类通过调控靶基因表达从而影响细胞、组织或器官的生长、发育、分化、代谢等一系列的生物学过程的关键性蛋白。叉头框(FOX)转录因子是一类从酵母等低等生物到人类等高等真核生物中普遍存在的一种重要的转录因子,目前FOX转录因子超家族根据DNA结合区的同源性差异从A到S共分为19个亚族,100多个FOX家族成员。FOX转录因子的DNA结合区称之为“叉头区”由100个氨基酸组成,核心部分由3个α螺旋排列构成,两侧通过β链连接了两个环状结构。由于其空间结构特点,又被称为翼状螺旋蛋白〔7〕。FOX转录因子在生物体胚胎的生长发育、生物代谢、免疫调节等方面都发挥重要作用,其突变或表达异常与发育畸形、代谢性疾病、肿瘤、免疫异常等密切相关〔7〕。
FOXC1为FOX转录因子家族的一员,它的编码基因位于人染色体6p25基因编码区〔8〕,其基因突变或表达异常与动物胚胎发育异常、人类Axenfeld-Rieger 综合征的发生密切相关〔9,10〕。在多种恶性肿瘤组织中,如乳腺癌、子宫内膜癌、原发性肝癌等,FOXC1的异常表达也被报道与肿瘤细胞的增殖、侵袭转移密切相关,是肿瘤患者预后差的标志〔2~6〕。本研究首次检测分析了FOXC1在ESCC中的表达情况,结果发现FOXC1在ESCC组织中的表达明显高于正常组织,并且与ESCC的分化程度、T分期及区域淋巴结转移关系密切相关,分化程度越低、肿瘤负荷越大和有淋巴结转移者表达更高,提示FOXC1高表达在ESCC的发生发展及侵袭转移中可能发挥重要作用。
FOXC1被发现是肿瘤细胞EMT的重要调节因子〔4,11~13〕。EMT是指在转录因子Snail,Slug,Twist,Zeb1等作用下,细胞间黏附分子E-Cadherin丢失,基质金属蛋白酶(MMPs)等表达增加,上皮性肿瘤细胞转变为游走迁徙能力更强的间充质性细胞,从而使肿瘤细胞获得更高的侵袭转移能力。有研究发现:FOXC1在原发性肝细胞肝癌(HCC)中过表达不仅诱导转录因子Snail的表达上调促进EMT,而且诱导E-cadherin的表达下调,从而增强HCC的侵袭及远处转移;敲除FOXC1后,EMT会部分逆转,细胞骨架发生重构,MMP1,MMP2,MMP7,MMP9和血管内皮生长因子-A(VEGF-A)的表达也随之下调,最终导致HCC的增殖、侵袭及转移能力均降低〔4,12〕。此外,研究证实紧密连接蛋白claudin呈低表达的乳腺癌中,FOXC1蛋白的过表达不但可独立作为EMT的诱导剂,而且也可以上调EMT的转录因子Snail,Twist,TGF-β1等共同完成EMT的过程。由此可见,FOXC1的表达与Snail、MMPs等EMT促进因子的表达呈正相关而与E-cadherin等EMT抑制因子的表达呈负相关,FOXC1也因此被视为肿瘤细胞发生EMT的正性调控分子。在ESCC中,多项研究证实存在 EMT转录因子Slug,Twist,Snail的过表达,同时E-cadherin的表达降低,是患者的预后不佳的提示〔14,15〕。而MMPs的过表达也被发现与ESCC的EMT及血管生成密切相关,在ESCC发生发展及侵袭转移过程中也发挥了重要作用〔16〕。推测FOXC1在ESCC中的表达也可能通过调节转录因子Snail、Slug、Twist,E-cadherin,MMPs或VEGF的表达而参与EMT,进而促进ESCC的发生发展及侵袭转移,但是其中具体分子调节机制尚需研究进一步证实。
4参考文献
1William PT,David PK,David HI.Targeted therapies for esophageal cancer〔J〕.Oncologist,2005;10(8):590-601.
2Chung TKH,Lau TS,Cheung TH,etal.Dysregulation of miroRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1〔J〕.Int J Cancer,2012;130:1036-45.
3Partha SR,Sanjay PB.Basal-like breast cancer defined by FOXC1 expression offers superior prognostic value:a retrospective immunohistochemical study 〔J〕.Ann Surg Oncol,2011;18:3839-47.
4Xu ZY,Ding SM,Zhou L.FOXC1 contributes to microvascular invasion in primary hepatocellular carcinoma via regulating epithelial-mesenchymal transition〔J〕 .Int J Biol Sci,2012;8(8):1130-41.
5Lei WF,Gu CY,Liu RJ,etal.High level of FOXC1 expression is associated with poor prognosis in pancreatic ductal adenocarcinoma〔J〕.Tumour Biol J Int Soc Oncodev Biol Med,2012;34(2):853-8.
6Wei LX,Zhou RS,Xu HF,etal.High expression of FOXC1 is associated with poor clinical outcome in non-small cell lung cancer patients〔J〕.Tumour Biol J Int Soc Oncodev Biol Med,2013;34(2):941-6.
7Lam EW,Brosens JJ,Gomes AR.Forkhead box proteins:tuning forks for transcriptional harmony〔J〕.Nat Rev Cancer,2013;13:482-95.
8Lehmann OJ.Ocular developmental abnormalities and glaucoma associated with interstitial 6p25 duplications and deletions 〔J〕.Invest Ophthalmol Vis Sci,2002;43(6):1843-9.
9Ta CC,Gail S,Lisa AS,etal.Axenfeld-rieger syndrome:new perspectives〔J〕.Br J Ophthalmol,2012;96:318-22.
10Delahaye A,Khung SS,Aboura A,etal.Pre- and postnatal phenotype of 6p25 deletions involving the FOXC1 gene〔J〕.Am J Med Genet A,2012;158A(10):2430-8.
11Yu M,Bardia A,Wittner BS,etal.Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition〔J〕.Science,2013;339(6119):580-4.
12Xia L,Huang W,Tian D,etal.Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma〔J〕.Hepatology,2013;57(2):610-24.
13Xia L,Huang W,Tian D,etal.Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma〔J〕.Hepatology,2013;57(2):610-24.
14Zhang K,Zhang M,Zhao H,etal.S100A4 regulates motility and invasiveness of human esophageal squamous cell carcinoma through modulating the AKT/Slug signal pathway〔J〕.Dis Esophagus,2012;25(8):731-9.
15Sasaki K,Natsugoe S,Ishigami S,etal.Significance of Twist expression and its association with E-cadherin in esophageal squamous cell carcinoma 〔J〕.Exp Clin Cancer Res,2009;28:158.
16Groblewska M,Siewko M,Mroczko B,etal.The role of matrix metalloproteinases(MMPs)and their inhibitors(TIMPs)in the development of esophageal cancer〔J〕.Folia Histochem Cytobiol,2012;50(1):9-12.
〔2014-05-19修回〕
(编辑安冉冉/曹梦园)
通讯作者:刘杰(1981-),女,博士,主治医师,主要从事肿瘤内科及肿瘤基础研究。
基金项目:济南市青年科技明星计划资助课题(No.20110321)
〔中图分类号〕R735.1
〔文献标识码〕A
〔文章编号〕1005-9202(2016)04-0796-03;doi:10.3969/j.issn.1005-9202.2016.04.011

