小麦果聚糖合成酶基因6-SFT-D多态性及其与6-SFT-A2的累加效应
岳爱琴 李 昂 毛新国 昌小平 柳玉平 李润植 景蕊莲,*
1山西农业大学农学院, 山西太谷 030801;2中国农业科学院作物科学研究所 / 农业部作物种质资源利用重点开放实验室, 北京100081
小麦果聚糖合成酶基因6-SFT-D多态性及其与6-SFT-A2的累加效应
岳爱琴1,2李昂2毛新国2昌小平2柳玉平2李润植1景蕊莲2,*
1山西农业大学农学院, 山西太谷 030801;2中国农业科学院作物科学研究所 / 农业部作物种质资源利用重点开放实验室, 北京100081
摘要:小麦6-SFT是果聚糖合成的关键酶基因。以23份六倍体普通小麦(AABBDD)、5份D基因组材料(DD)为多样性代表群体材料, 通过测序分析小麦6-SFT-D基因的序列多态性, 根据多态性开发6-SFT-D基因的功能标记, 分析由154份六倍体普通小麦构成的自然群体的6-SFT-D基因单倍型(haplotype)与表型性状的关联特性和基因累加效应。在28份多样性代表群体中, 共检测到6-SFT-D基因的4个多态性位点, 均为单核苷酸多态性(SNP)位点, 构成3种6-SFT-D基因单倍型; 而在自然群体中只检测到6-SFT-D的两种单倍型。根据6-SFT-D基因2850 bp位点的T/C变异开发等位变异特异PCR标记。关联分析表明, 6-SFT-D单倍型分别与灌溉条件下的千粒重和穗长显著关联, 单倍型Hap I是提高千粒重的优异等位变异; 在雨养和灌溉条件下, 同时具有6-SFT-D与6-SFT-A2优异等位变异小麦材料的千粒重显著高于其他基因型材料, 说明6-SFT-D和6-SFT-A2优异等位变异对于提高千粒重表现累加效应。
关键词:普通小麦; 6-SFT-D; 功能标记; 单核苷酸多态性; 关联分析; 累加效应
本研究由国家高技术研究发展计划(863计划)项目(2011AA100501)和国家自然科学基金项目(31461143024)资助。
This study was supported by the National High Technology Research and Development Program of China (863 Program) (2011AA100501) and the National Natural Science Foundation of China (31461143024).
第一作者联系方式: E-mail: yueaiqinnd@126.com, Tel: 0354-6289806
果聚糖是小麦茎秆重要的储藏性可溶性碳水化合物(water-soluble carbohydrates, WSC)[1]。小麦茎秆中的WSC含量达到最高值时, 果聚糖含量可占其85%。小麦茎秆中WSC含量有丰富的遗传多样性, 不
同小麦材料茎秆中WSC的差异主要是由果聚糖含量造成的[1-2]。研究表明, 茎秆中WSC与粒重和产量呈正相关[3-7], 果聚糖也是重要的渗透调节物质[8-11]。蔗糖:果聚糖6-果糖基转移酶(sucrose-fructan 6-fructosyltransferase, 6-SFT)是小麦果聚糖合成过程中的关键酶之一。研究果聚糖代谢酶基因的多态性, 通过关联分析发掘优异等位变异, 对于提高小麦产量和抗旱性具有重要意义。
关联分析是一种将候选基因的遗传变异与表型性状联系起来的分析方法[12-13], 是发掘优异等位基因的有效途径。利用该分析方法, 发现小麦Ppd-D1基因的不同单倍型(haplotype)与抽穗期、株高和千粒重呈显著或极显著相关[14], TaGW2-6A单倍型影响粒宽和粒重[15], 小麦TaSus2[16]、TaSAP1-A1[17]和TaSnRK2.10[18]的单倍型也显著影响千粒重等性状。单核苷酸多态性(single nucleotide polymorphism, SNP)广泛而稳定地存在于植物基因组中, 研究发现一些基因的SNP影响基因的功能[14-18]。本课题组在小麦中检测到6-SFT基因的3个拷贝, 根据其所在基因组分别命名为6-SFT-A1、6-SFT-A2和6-SFT-D, 其中6-SFT-A1和6-SFT-A2的多态性与小麦农艺性状有密切关系[19-20];但是尚未对6-SFT-D基因的多态性及其与农艺性状的相关性开展研究, 另外, 6-SFT-D和6-SFT-A2之间的是否具有累加或互作效应, 尚不清楚。
本研究以23份六倍体小麦和5份粗山羊草为材料, 测序分析小麦6-SFT-D基因的多态性, 并根据测序结果开发基因分子标记。利用新开发的基因分子标记, 在普通小麦自然群体中检测6-SFT-D基因单倍型, 并通过关联分析探讨6-SFT-D多态性与农艺性状的关系, 同时发现了6-SFT-D与6-SFT-A2的累加效应。本研究结果是分子标记辅助聚合优异等位变异的重要依据, 为利用和改良小麦品种果聚糖代谢途径相关基因以提高千粒重提供研究思路。
1 材料与方法
1.1植物材料
本研究构建的自然群体由154份不同年代育成的普通小麦品种(系)组成。利用83对SSR标记对其进行群体遗传结构分析, 将154份材料分为4个亚群[21]。从各亚群中挑选典型的多样性材料23份, 与5份粗山羊草(Aegilops tauschii, DD)材料组成多样性代表群体, 用于直接测序, 检测目标基因的序列多态性。此外, 还利用了1份乌拉尔图小麦(Triticum urartu, AA)、1份拟斯卑尔脱山羊草(Aegilops speltoides, SS) 和1份四倍体小麦(Triticum polonicum, AABB)材料。所有试验材料均由中国农业科学院作物科学研究所提供。
1.2引物设计
用Primer Premier 5软件, 参照NCBI公布的6-SFT序列(FJ228688), 设计通用引物F1/R1 (F1: 5′-TACC AAACTCTCTTAGAGTTCACGAGGG-3′; R1: 5′-CA CGAGTCCACTCTCCCAAACAACAATA-3′)。根据6-SFT在A、B、D基因组的序列差异, 设计6-SFT-D特异引物F2/R2 (F2: 5′-TACCAAACTCTCTTAGAGT TCACGAGGG-3′; R2: 5′-CCAAACTATATCGATCCT ACA-3′)。扩增产物在2850 bp位点存在一个核苷酸变异(T→C), 据此开发等位变异特异PCR (allele-specific PCR, AS-PCR)引物F3/R3 (F3: 5'-CATACCAGCTTCT GCCAAGGT-3′; R3: 5′-CCAAACTATATCGATCCTAC A-3′)。为避免假阴性, 设计了在所有材料均能扩增出目标产物的引物F4/R4 (F4: 5′-GCGCACAACCAGCT CTCC-3′; R4: 5′-GCAGACCACACCGGTTCAC-3′)。另外, 还设计了4条叠套测序引物SeqF1 (5′-GTGCAGA TCCCAACGG-3′)、SeqF2 (5′-GTCACCTACCGCTCG C-3′)、SeqF3 (5′-TCAAGGAGAGCAGCGAC-3′)和SeqR1 (5′-AACTCATCGTGGCAGAAG-3′)。
1.3目标片段的获得和测序
以供试材料基因组DNA为模板, PCR体系总体积为15 μL, 含2.1 μL DNA模板(20 ng μL–1)、3.0 μL 5× buffer、引物各0.3 μL (10 μmol L–1)、0.1 μL dNTP (10 μmol L–1)、0.3 μL TransStart FastPfu (5 U)和8.9 μL ddH2O。PCR程序为95℃ 5 min; 95℃ 1 min, 59 ℃ 45 s, 72℃ 3.5 min, 32次循环; 72℃ 10 min, 15℃保存。在1.2%琼脂糖凝胶中检测扩增产物, 回收目标片段, 利用6条叠套引物(F2、R2、SeqF1、SeqF2、SeqF3和SeqR1)在ABI 3730XL基因分析仪(Applied Biosystems, 美国)上直接测序, 3次重复。
1.4目标基因DNA序列单核苷酸多态性分析
用DNAStar软件分析6-SFT-D序列的SNP, 利用DnaSP5.10软件分析6-SFT-D基因多态性位点及单倍型, 并计算遗传多态性指数π值。
1.5表型性状数据收集
2007—2010年, 种植154份小麦材料于中国农业科学院作物科学研究所昌平试验基地, 设雨养和灌溉两种处理。每小区4行, 行长2.0 m, 行距0.3 m,每行点播40粒种子。小麦收获时, 从每份材料随机取5株调查千粒重和穗长。
2010年小麦籽粒灌浆至成熟期间, 分6次取穗样, 每份材料随机取5株。前5次在灌浆期内, 取样日依次是5月20日、5月26日、6月2日、6月7日和6月11 日, 样品烘干脱粒后称重, 计算千粒重; 最后一次取样在6月中旬(收获期), 其中雨养条件下为6月14 日, 灌溉条件下为6月18日, 考种后计算千粒重。
1.6关联分析
利用AS-PCR标记检测自然群体材料的6-SFT-D基因单倍型。以个体Q值作为协变量, 用TASSEL软件[22]进行群体结构分析, 将6-SFT-D的单倍型和表型性状数据进行关联分析。用SPSS13统计软件计算不同单倍型的农艺性状值。
2 结果与分析
2.16-SFT-D不同基因组序列SNP分析
利用6-SFT全长引物F1/R1在4份不同倍性材料中扩增到基因的全长DNA序列, 二倍体野生近缘种和六倍体小麦序列比对结果如图1。在六倍体小麦中分离到3种6-SFT序列, 其中AABBDD-3序列与粗山羊草(DD)的序列相似度达到99%, 因此推测AABBDD-3序列来自于六倍体小麦的D基因组, 命名为6-SFT-D。利用6-SFT-D基因组特异引物F2/R2获得6-SFT-D序列(图1)。引物F2/R2在4份二倍体小麦、1份四倍体小麦和5份六倍体小麦中的扩增结果证实, 6-SFT-D序列位于D基因组(图2)。
利用F2/R2扩增出的目标片段长度为3362 bp,包括4个外显子、3个内含子及5′和3′-UTR (图3)。外显子区域依次位于30~323、464~472、1126~1986和2487~3188 bp, 第2外显子与6-SFT-A1、6-SFT-A2序列[19-20]相同, 均为5′-ATCCCAACG-3′; 3个内含子分别位于324~463、473~1125和1987~2486 bp区段; 此外, 1~29 bp为5′-UTR, 3189~3362 bp为3′-UTR。

图1 六倍体小麦(旱选10号)及其近缘种6-SFT的序列比对Fig. 1 Sequence alignment of 6-SFT in hexaploid wheat (cv. Hanxuan 10) and its wild relative species

图2 6-SFT-D基因组定位Fig. 2 Genome locations of 6-SFT-D
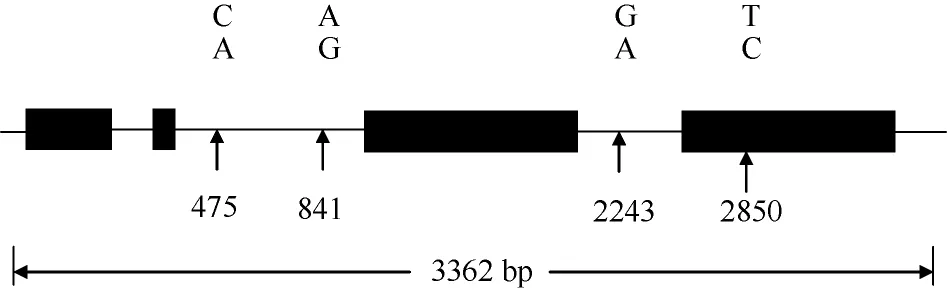
图3 小麦6-SFT-D的结构及其4个SNP位点Fig. 3 Schematic representation and four SNP in 6-SFT-D gene sequence
2.26-SFT-D序列的多态性
对23份六倍体小麦材料(AABBDD)与5份粗山羊草(DD)组成的多样性代表群体进行6-SFT-D全长测序, 分析其序列多态性。在扩增片段为3362 bp的6-SFT-D序列中共检测到4个多态性位点, 均为SNP位点, 没有InDel (图3), 其中3个SNP位于非编码区, 1个位于编码区, 平均每841 bp有一个SNP位点。这4 个SNP位点包括3个转换(A↔G、C↔T)和1个颠换(A↔C), 转换是主要碱基突变类型。与4A染色体上的6-SFT-A1和6-SFT-A2[19-20]相比, 6-SFT-D的变异频率(1SNP/841 bp)显著小于6-SFT-A1 (1SNP/234 bp)和6-SFT-A2 (1SNP/242 bp), 进一步证明小麦的D基因组比较保守。6-SFT-D在二倍体小麦中的变异频率(1SNP/841 bp)大于在六倍体小麦(1SNP/3362 bp)中,可能是六倍体小麦长期经受人工选择的缘故。
2.36-SFT-D多态性位点分布
在28份材料中, 6-SFT-D的序列多样性呈现不均匀分布, 共检测出的4个SNP位点中, 其中3个位于内含子, 分别位于内含子2和3 (图4)。在外显子4检测到1个SNP, 并且属于同义突变。在6-SFT-D基因序列外显子1、2、3和内含子1中没有发现SNP。6-SFT-D基因全长的π值为0.0004, 其π值显著小于6-SFT-A1 和6-SFT-A2基因的π值0.00273和0.00218。
2.46-SFT-D单倍型分析
在28份材料中, 6-SFT-D序列聚类为3种单倍型,分别是Hap I、Hap II和Hap III (图5), 分别对应SNP组合C/A/G/C、C/A/G/T和A/G/A/C (表1)。Hap II与 Hap I之间有1个SNP位点存在差异, Hap III与Hap I之间有3个SNP位点存在差异, Hap II和Hap III之间有4个SNP位点存在差异。
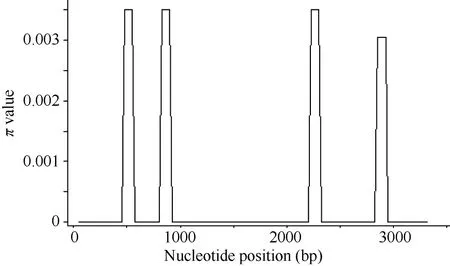
图4 6-SFT-D基因多态性位点分布的Sliding-window分析Fig. 4 Sliding-window analysis of 6-SFT-D polymorphic sites
23份六倍体小麦材料中, 仅Opata为Hap III基因型, 与5份二倍体材料聚在一类, 其他22份分为两种单倍型(图5)。其中, Hap I基因型17份, 包括偃展1号、豫麦18、小齐麦、PANDAS、鲁麦14、晋麦47、旱选10号、大荔1号、春04 9th-5-1、中国春、长武131、长6878、北京8686、北京10号、白齐麦、白糙麦和安85中124-1; Hap II基因型5份, 包括红和尚、W7984、沧州小麦、昌乐5号和霸王鞭。由于Hap III基因型六倍体小麦仅有1份, 因此本文仅分析Hap I和Hap II与农艺性状的关联情况。
2.56-SFT-D等位变异分子标记的开发
为了区分6-SFT-D基因Hap I与Hap II, 根据2850 bp位点T/C变异设计AS-PCR引物F3/R3 (图6-A)。等位特异引物的正向引物F3根据2850 bp位点的T/C变异设计, 并依据引物错配原理在3′端第2位引入与A强错配的碱基G; 反向引物R3与6-SFT-D基因组特异引物R2相同。当2850 bp位点为T时扩增出500 bp左右的条带, 为C时无扩增条带。当等位基因特异PCR引物扩增结果是无带时, 则很难确定是PCR扩增确实没有目标带还是其他原因导致的检测不到扩增产物。为了增加实验的可靠性, 在此反应体系中加入了另一对引物F4/R4, 此对引物在所有的材料中都可检测到扩增产物。本试验中, 当2850 bp位点为T时扩增出两条带, 为C时扩增一条带(图6-B)。
2.66-SFT-D不同单倍型与相关农艺性状的关联分析
2.6.16-SFT-D不同单倍型与千粒重的关联分析
用AS-PCR标记扫描自然群体, 分子标记与农艺性状的关联分析表明, 2009年和2010年在灌溉条件下6-SFT-D基因两种单倍型Hap I和Hap II与千
粒重显著相关, 基因型Hap I较Hap II的千粒重平均值分别高2.13 g和2.84 g。因此, Hap I为灌溉条件下影响小麦千粒重的优异单倍型(表2)。

图5 6-SFT-D序列单倍型关系树状图Fig. 5 Phylogenetic tree for 6-SFT-D haplotypes
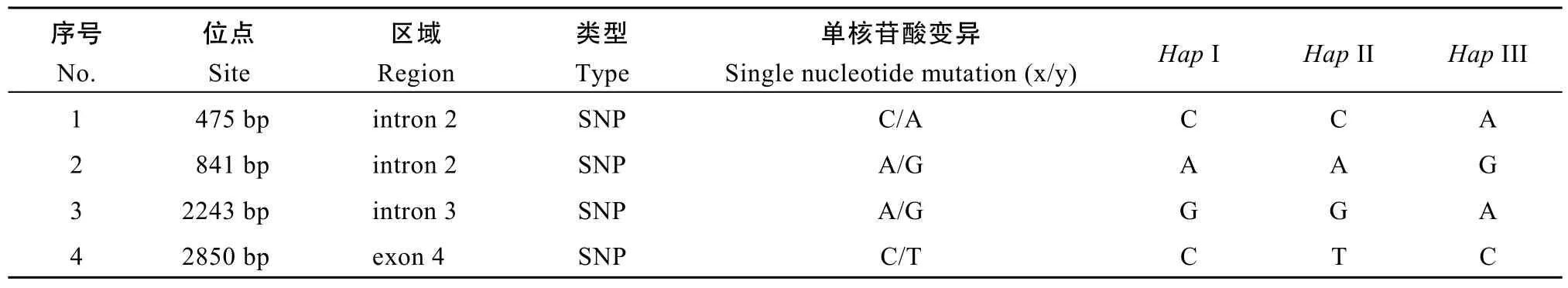
表1 6-SFT-D序列的多态性位点Table 1 Single nucleotide mutation in 6-SFT-D sequence
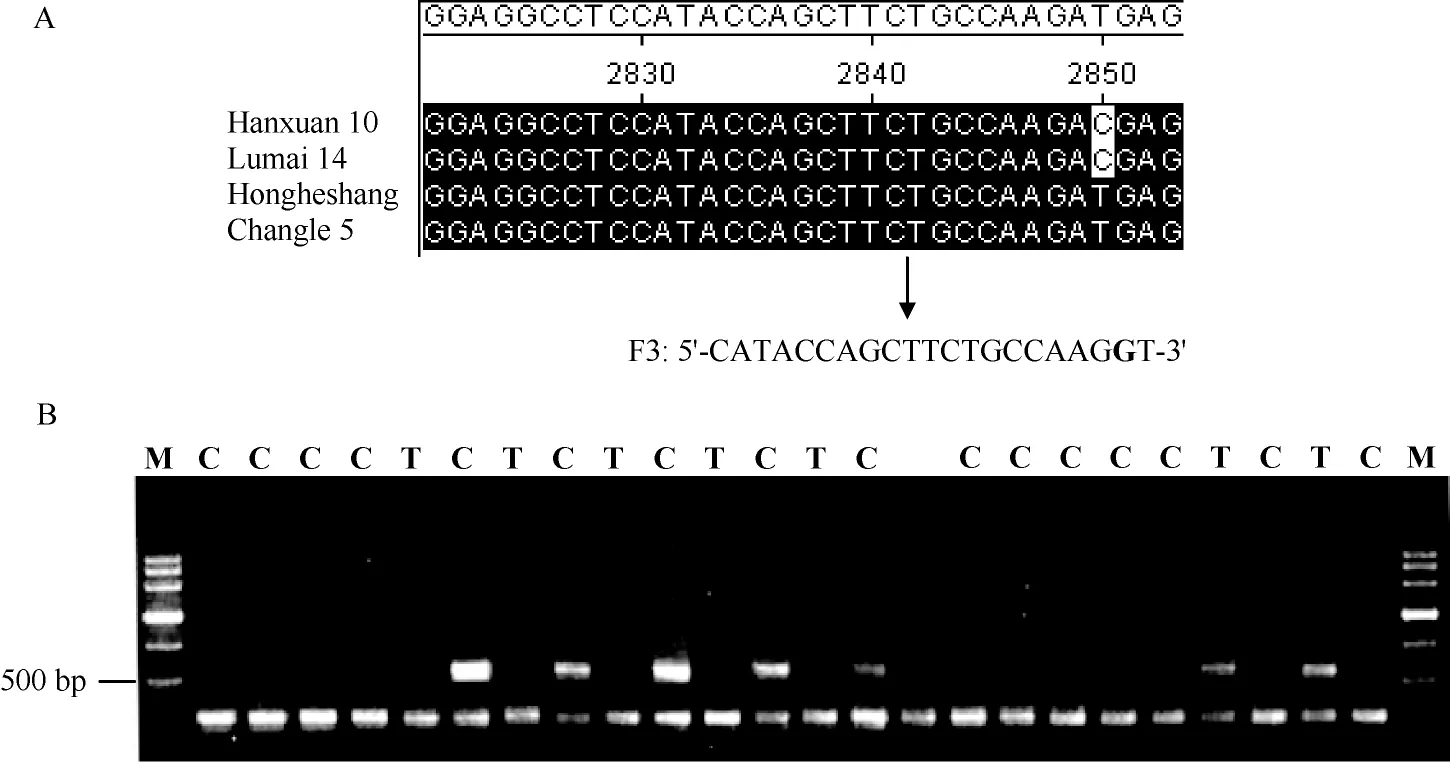
图6 利用6-SFT-D等位特异引物检测的基因型Fig. 6 Genotypes detected by 6-SFT-D allele-specific primers
2.6.26-SFT-D两种单倍型千粒重的积累在灌浆进程的不同时期取样表明, 在灌浆初期(5月26日) Hap I基因型的千粒重与Hap II的千粒重差异不显著, 灌浆后期(6月2日至11日) Hap I的千粒重均高于Hap II (图7)。因此认为, Hap I的品种灌浆速率比Hap II的品种快, 使小麦籽粒成熟后Hap I的小麦品种的千粒重显著高于Hap II小麦品种。

表2 灌溉条件下6-SFT-D两种单倍型与小麦千粒重和穗长的关联分析Table 2 Association analysis between 6-SFT-D haplotype and TGW in wheat under well-watered condition
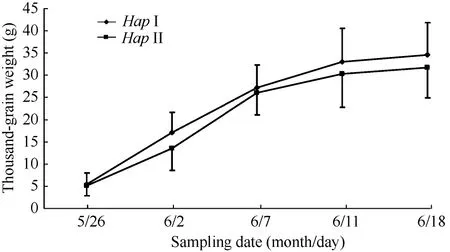
图7 灌浆期6-SFT-D两种单倍型材料的千粒重增长情况(2010年)Fig. 7 Thousand-grain weight of two 6-SFT-D haplotypes during grain filling period in 2010
2.6.36-SFT-D两种单倍型与穗长的关联分析
两年分析结果表明, 在灌溉条件下6-SFT-D两种单倍型与穗长显著相关, Hap I基因型的穗长较大, 2009年和2010年分别比Hap II基因型高0.37 cm和0.42 cm (表2)。
2.76-SFT-D与6-SFT-A2的累加效应
普通小麦中, 6-SFT-D基因分为两种单倍型, 其中Hap I为高千粒重的优异等位变异。小麦的6-SFTA2基因分为3种单倍型, 与千粒重显著相关, 其中Hap III为6-SFT-A2的高千粒重优异等位变异[20]。2007—2010年连续4年分析6-SFT-D和6-SFT-A2不同单倍型组合基因型在雨养和灌溉条件下的表型性状, 发现同时含有基因优异等位变异Hap I+III的小麦材料的千粒重平均值显著高于其他材料(图8); 而不带6-SFT-D与6-SFT-A2任何一个优异等位变异的Hap II+I小麦材料, 其千粒重平均值低。如在2010年灌溉条件下, Hap I+III小麦材料的千粒重平均值高达43.2 g, 含有任何一个基因优异等位变异小麦材料的千粒重平均值为39.3~41.1 g, 而没有优异等位变异的Hap II+I和Hap II+II基因型, 其千粒重平均值仅为39.2 g和36.6 g, 说明6-SFT-D和6-SFT-A2两个基因对千粒重的效应存在一定的累加作用。
3 讨论
6-SFT是小麦果聚糖合成过程中的关键酶基因,在普通六倍体小麦中具有多个拷贝[20]。6-SFT-A1、6-SFT-A2和6-SFT-D是6-SFT在普通小麦中的不同拷贝。本课题组前期研究结果表明, 在小麦6-SFT-A1 的3269 bp中有13个SNP和1个InDel, 频率为/1个SNP/251 bp和1个InDel/3269 bp[19]。小麦6-SFT-A2的3149 bp序列中共检测到11个SNP和2个InDel, 在所检测区域1个SNP/242 bp, 1个InDel/1333 bp[20]。本研究在六倍体小麦材料中发现6-SFT-D的3362 bp序列中仅有1个SNP, 没有InDel, 这与基因的基因组来源有关, 进一步研究证明普通小麦的3个基因组中, D基因组在进化上是最保守的[23]。
千粒重是小麦重要的产量构成因素。寻找影响千粒重优异等位变异并开发功能标记, 是开展小麦分子标记辅助选择育种、分子设计育种和转基因育种的前提。近年来研究表明开花期茎秆中WSC含量与粒重和籽粒产量均呈极显著正相关, 因此认为在
茎秆中高WSC含量是改良千粒重和产量的重要性状之一[4, 24-27]。本研究结果表明小麦果聚糖合成酶基因6-SFT-D影响小麦在灌溉条件下的千粒重, Hap I为灌溉条件下影响小麦千粒重的优异单倍型, 为分子标记辅助选择育种奠定基础。
基于单核苷酸多态性在关联分析中的成功应用,初步证明这是一种发掘优异等位基因的有效途径。目前关联分析策略主要集中于分析单个位点或单个基因与性状的关系, 仅能发现一部分单独效应显著的SNP位点。然而, 作物的许多重要性状都是由多个基因控制的数量性状, 控制同一性状的基因之间往往存在累加效应或联合效应。因此研究多个基因间的累加效应已经成为深入解析数量性状分子遗传机制的重要手段之一[28]。本研究发现, 不带有6-SFT-D 和6-SFT-A2基因任何一个优异等位变异的小麦材料千粒重显著较低, 而同时含有两个基因优异等位变异组合(Hap I+III)的小麦材料, 其千粒重显著高于其他变异组合的材料, 说明6-SFT-D和6-SFT-A2两个基因存在一定的累加效应。本文研究了小麦果聚糖合成过程中6-SFT基因2个成员之间的累加效应, 但是小麦千粒重是由多基因控制的数量性状, 目前有许多研究通过关联分析策略解析与千粒重相关的单个基因[14-18,20], 进一步系统研究这些影响千粒重基因的不同组合方式对千粒重的影响, 对于聚合最优等位变异提高小麦千粒重将具有重要的指导意义。
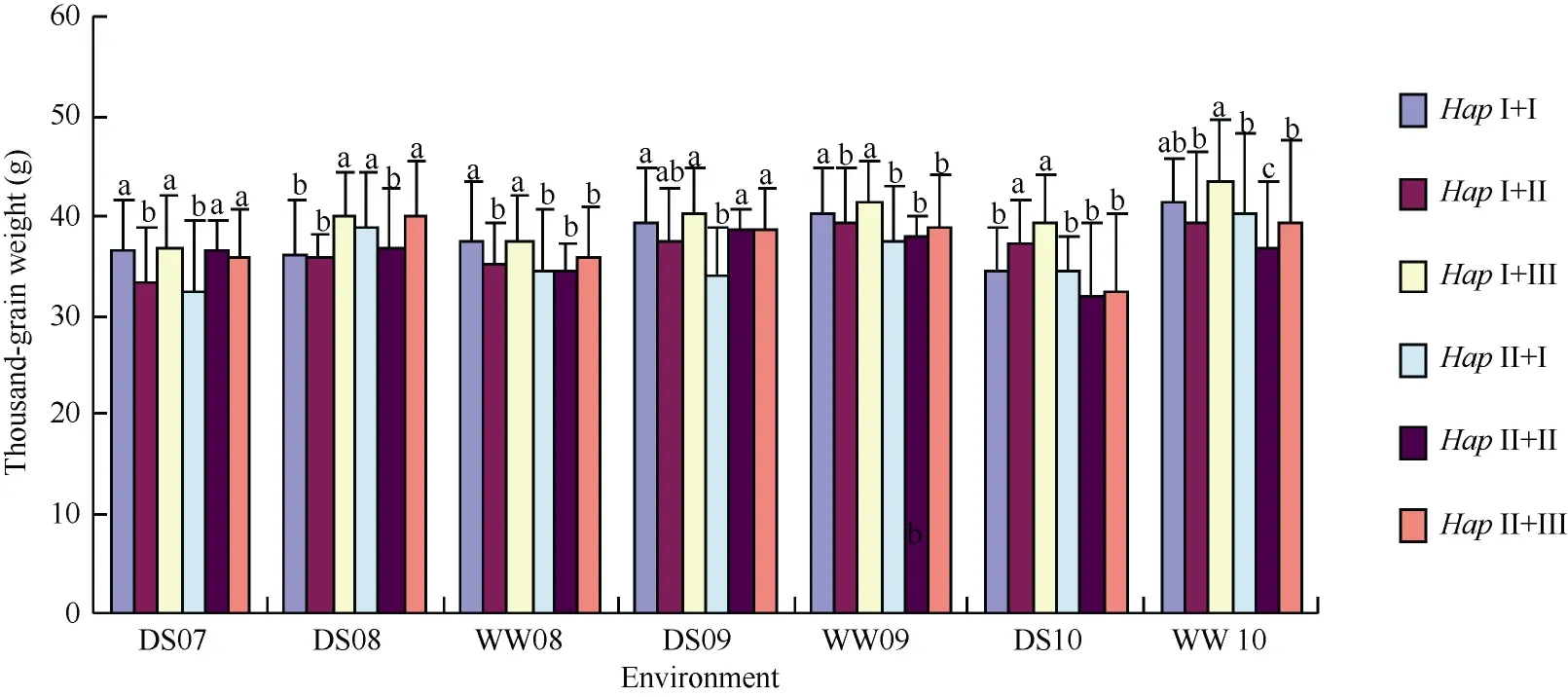
图8 不同环境条件下6-SFT-D与6-SFT-A2单倍型对千粒重的累加效应Fig. 8 Accumulation effects on grain weight of 6-SFT-D and 6-SFT-A2 haplotypes in multi-environment
4 结论
在小麦材料中检测到6-SFT-D基因的4个SNP位点, 分为2种单倍型。根据6-SFT-D基因2850 bp位点的核苷酸变异T/C开发了AS-PCR标记。在灌溉条件下, 6-SFT-D单倍型分别与千粒重和穗长显著关联, 其中Hap I是提高千粒重的优异单倍型。在雨养和灌溉条件下, 同时含有6-SFT-D与6-SFT-A2优异等位变异的小麦材料千粒重平均值显著高于其他材料, 说明6-SFT-D与6-SFT-A2的优异等位变异对于提高小麦千粒重具有累加效应。
References
[1] Ruuska S, Rebetzke G, van Herwaarden A, Richards R, Fettell N, Tabe L, Jenkins C. Genotypic variation in water-soluble carbohydrate accumulation in wheat. Funct Plant Biol, 2006, 33: 799–809
[2] Foulkes M J, Scott R K, Sylvester-Bradley R. The ability of wheat cultivars to withstand drought in UK conditions: formation of grain yield. J Agric Sci, 2002, 138: 153–169
[3] Asseng S, van Herwaarden A F. Analysis of the benefits to wheat yield from assimilates stored prior to grain filling in a range of environments. Plant Soil, 2003, 256: 217–229
[4] Xue G P, McIntyre C L, Jenkins C L D, Glassop D, van Herwaarden A F, Shorter R. Molecular dissection of variation in carbohydrate metabolism related to water-soluble carbohydrate accumulation in stems of wheat. Plant Physiol, 2008, 146: 441–454
[5] Xue G P, McIntyre C L, Rattey A R, van Herwaarden A F, Shorter R. Use of dry matter content as a rapid and low-cost estimate for ranking genotypic differences in water soluble carbohydrate concentrations in the stem and leaf sheath of Triticum aestivum. Crop Pasture Sci, 2009, 60: 51–59
[6] McIntyre C L, Casu R E, Rattey A, Dreccer M F, Kam J W, van Herwaarden A F, Shorter R, Xue G P. Linked gene networks involved in nitrogen and carbon metabolism and levels of water soluble carbohydrate accumulation in wheat stems. Funct Integr
Genomics, 2011, 11: 585–597
[7] McIntyre C L, Seung D, Casu R E, Rebetzke G J, Shorter R, Xue G P. Genotypic variation in the accumulation of water soluble carbohydrates in wheat. Funct Plant Biol, 2012, 39: 560–568
[8] Wardlaw I F, Willenbrink J. Mobilization of fructan reserves and changes in enzyme activities in wheat stems correlate with water stress during kernel filling. New Phytol, 2000, 148: 413–422
[9] Foulkes M J, Sylvester-Bradley R, Weightman R, Snape J W. Identifying physiological traits associated with improved drought resistance in winter wheat. Field Crops Res, 2007, 103: 11–24
[10] Volaire F, Lelièvre F. Production, persistence, and water soluble carbohydrate accumulation in 21 contrasting populations of Dactylis glomerata L. subjected to severe drought in the South of France. Aust J Agric Res, 1997, 48: 933–944
[11] Portes M T, Figueiredo-Ribeiro R C L, Carvalho M A M. Low temperature and defoliation affect fructan-metabolizing enzymes in different regions of the rhizophores of Vernonia herbacea. J Plant Physiol, 2008, 165: 1572–1581
[12] Zondervan K T, Cardon L R. The complex interplay among factors that influence allelic association. Nat Rev Genet, 2004, 5: 89–100
[13] Gupta P K, Rustgi S, Kulwal P L. Linkage disequilibrium and association studies in higher plants: present status and future prospects. Plant Mol Biol, 2005, 57: 461–485
[14] Guo Z A, Song Y X, Zhou R H, Ren Z L, Jia J Z. Discovery, evaluation and distribution of haplotypes of the wheat Ppd-D1 gene. New Phytol, 2009, 185: 841–851
[15] Su Z Q, Hao C Y, Wang L F, Dong Y N. Identification and development of a functional marker of TaGW2 associated with grain weight in bread wheat (Triticum aestivum L.) . Theor Appl Genet, 2011, 122: 211–223
[16] Jiang Q Y, Hou J, Hao C Y, Wang L F, Ge H M, Dong Y S, Zhang X Y. The wheat (T. aestivum) sucrose synthase 2 gene (TaSus2) active in endosperm development is associated with yield traits. Funct Integr Genomics, 2011, 11: 49–61
[17] Chang J Z, Zhang J N, Mao X G, Li A, Jia J Z, Jing R L. 2013. Polymorphism of TaSAP1-A1 and its association with agronomic traits in wheat. Planta, 237: 1495–1508
[18] 王倩, 毛新国, 昌小平, 贾继增, 刘惠民, 景蕊莲. 小麦TaSnRK2.10的多态性及与农艺性状的关联. 中国农业科学, 2014, 44: 1865–1877 Wang Q, Mao X G, Chang X P, Jia J Z, Liu H M, Jing R L. Polymorphism of TaSnRK2.10 and its association with yield-related traits in wheat. Sci Agric Sin, 2014, 47: 1865–1877 (in Chinese with English abstract)
[19] 岳爱琴, 李昂, 毛新国, 昌小平, 李润植, 贾继增, 景蕊莲. 小麦果聚糖合成酶基因6-SFT-A单核苷酸多态性分析及其定位.中国农业科学, 2011, 44: 2216–2224 Yue A Q, Li A, Mao X G, Chang X P, Li R Z, Jia J Z, Jing R L. Single nucleotide polymorphism and mapping of 6-SFT-A gene responsible for fructan biosynthesis in common wheat. Sci Agric Sin, 2011, 44: 2216–2224 (in Chinese with English abstract)
[20] Yue A Q, LI A, Mao X G, Chang X P, Li R Z, Jing R L. Identification and development of a functional marker from 6-SFT-A2 associated with grain weight in wheat. Mol Breed, 2015, 35: 63 (DOI: 10.1007/s11032-015-0266-9)
[21] Zhang J N, Hao C Y, Ren Q, Chang X P, Liu G R, Jing R L. Association mapping of dynamic developmental plant height in common wheat. Planta, 2011, 234: 891–902
[22] Bradbury P J, Zhang Z W, Kroon D E, Casstevens T M, Ramdoss Y, Buckler E S. TASSEL: Software for association mapping of complex traits in diverse samples. Bioinformatics, 2007, 2: 2633–2635
[23] 贾继增, 张正斌, Devos K, Gale M D. 小麦21条染色体RFLP作图位点遗传多样性分析. 中国科学C辑, 2001, 31: 13–21 Jia J Z, Zhang Z B, Devos K, Gale M D. Diversity of wheat’s twenty-one chromosomes based on RFLP analysis. Sci China Ser C, 2001, 31: 13–21 (in Chinese with English abstract)
[24] Foulkes M J, Snape J W, Shearman V J, Reynolds M P, Gaju O, Sylvester-Bradley R. Genetic progress in yield potential in wheat: recent advances and future prospects. J Agric Sci, 2007, 145: 17–29
[25] Zhang B, Li W Y, Chang X P, Li R Z, Jing R L. Effects of favorable alleles for water-soluble carbohydrates at grain filling on grain weight under drought and heat stresses in wheat. PLoS One, 2014, 9: e102917
[26] Li W Y, Zhang B, Li R Z, Chang X P, Jing R L. Favorable alleles for stem water-soluble carbohydrates identified by association analysis contribute to grain weight under drought stress conditions in wheat. PLoS One, 2015, 10: e0119438
[27] Yang D L, Jing R L, Chang X P, Li W. Identification of quantitative trait loci and environmental interactions for accumulation and remobilization of water-soluble carbohydrates in wheat (Triticum aestivum L.) stems. Genetics, 2007, 176: 571–584
[28] Cordell H J. Detecting gene-gene interactions that underlie human diseases. Nat Rev Genet, 2009, 10: 392–404
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151008.1357.002.html
Sequence Polymorphism and Cumulative Effect with 6-SFT-A2 of Fructan Biosynthesis Gene 6-SFT-D in Wheat
YUE Ai-Qin1, 2, LI Ang2, MAO Xin-Guo2, CHANG Xiao-Ping2, LIU Yu-Ping2, LI Run-Zhi1, and JING Rui-Lian2,*
1College of Agronomy, Shanxi Agricultural University, Taigu 030801, China;2Institute of Crop Science, Chinese Academy of Agricultural Sciences / Key Laboratory of Crop Germplasm and Utilization, Ministry of Agriculture, Beijing 100081, China
Abstract:Gene 6-SFT encodes a key enzyme in fructan biosynthesis pathway in common wheat (Triticum aestivum L.). In this study, we analyzed the single nucleotide polymorphism (SNP) on 6-SFT-D locus in a diversity population of 23 hexaploid wheat (AABBDD) accessions and five wheat relative species (DD) by means of direct sequencing. Functional markers were developed according to the sequence polymorphism. The correlation between 6-SFT-D haplotypes and phenotypic traits and the cumulative effect of 6-SFT alleles were analyzed using a natural population consisting of 154 historical wheat accessions. Four SNPs were detected in 6-SFT-D sequences in the diversity population, forming three haplotypes. However, only two 6-SFT-D haplotypes were identified in the natural population. We developed a pair of allele-specific PCR markers based on a polymorphism (T/C) at the 2850 bp site. The results of haplotype–trait association analysis showed that 6-SFT-D was significantly associated with thousand-grain weight (TGW) and spike length under well-watered conditions. Hap I was a superior allele in improving TGW. Under drought stress and well-watered conditions, wheat materials carrying both superior allele of 6-SFT-D and 6-SFT-A2 had significantly higher TGW than other genotypes, suggesting that 6-SFT-D and 6-SFT-A2 have cumulative effect on TGW improvement.
Keywords:Wheat; 6-SFT-D; Functional marker; SNP; Association analysis; Cumulative effect
收稿日期Received(): 2015-07-15; Accepted(接受日期): 2015-09-06; Published online(网络出版日期): 2015-10-08.
通讯作者*(Corresponding author): 景蕊莲, E-mail: jingruilian@caas.cn, Tel: 010-82105829
DOI:10.3724/SP.J.1006.2016.00011

