雌激素介导骨桥蛋白/基质金属蛋白酶9通路调节子宫内膜异位症腺上皮细胞侵袭性的研究
杨 眉,蒋春樊,哈春芳
·论著·
雌激素介导骨桥蛋白/基质金属蛋白酶9通路调节子宫内膜异位症腺上皮细胞侵袭性的研究
杨 眉,蒋春樊,哈春芳
【摘要】目的探讨子宫内膜异位症腺上皮细胞骨桥蛋白(OPN)与基质金属蛋白酶9(MMP-9)表达与子宫内膜腺上皮细胞迁移的关系。方法选取2013年8月—2014年3月于宁夏医科大学总医院因“卵巢巧克力囊肿”行剥除术或患侧附件切除术的9例患者异位子宫内膜,同期取行输卵管绝育术的10例患者的正常子宫内膜。子宫内膜组织培养,分离子宫内膜腺上皮细胞。检测子宫内膜异位症及正常子宫内膜OPN、MMP-9蛋白及mRNA表达水平。加入最适宜浓度的17β-雌二醇,培养最适宜时间,检测子宫内膜异位症腺上皮细胞OPN、MMP-9蛋白表达水平。子宫内膜异位症腺上皮细胞分别进行无意义链siRNA转染和siRNA-OPN转染,以无意义链siRNA转染作为对照,检测转染后子宫内膜异位症腺上皮细胞OPN、MMP-9蛋白表达水平。原代培养的子宫内膜腺上皮细胞达到90%融合时,配置成1×106/ml细胞悬液。侵袭小室下室分别加入500 μl的17β-雌二醇(10.0 nmol/L)、siRNA-OPN及无意义链siRNA,培养后在显微镜下取16个固定位置的视野计数穿膜细胞数。结果通过原代培养技术成功分离子宫内膜腺上皮细胞,腺上皮细胞成团生长,呈铺路石样,均在细胞胞质检测到OPN及MMP-9的表达。子宫内膜异位症腺上皮细胞OPN、MMP-9蛋白相对表达量分别为(2.53±0.57)、(3.12±0.69),高于正常子宫内膜腺上皮细胞,差异有统计学意义(tOPN=-2.310,tMMP-9=-1.375,P<0.05)。子宫内膜异位症腺上皮细胞OPN、MMP-9mRNA相对表达量分别为(2.91±0.73)和(3.33±0.54),高于正常子宫内膜腺上皮细胞,差异有统计学意义(tOPN=1.681,tMMP-9=-2.362;P<0.05)。OPN及MMP-9 mRNA均在17β-雌二醇浓度为10.0 nmol/L,培养时间为48 h时达到高峰。培养48 h后,10.0 nmol/L 17β-雌二醇干预的子宫内膜异位症腺上皮细胞OPN及MMP-9蛋白表达高于未加药干预,差异有统计学意义(P<0.05)。子宫内膜异位症腺上皮细胞经siRNA-OPN干扰后,OPN、MMP-9蛋白表达水平低于经无意义siRNA干扰,差异有统计学意义(P<0.05)。不同干预措施处理后,子宫内膜异位症腺上皮细胞穿膜细胞数比较,差异有统计学意义(P<0.05);其中,17β-雌二醇干预的子宫内膜异位症腺上皮细胞穿膜细胞数高于未处理干预,siRNA-OPN干预的子宫内膜异位症腺上皮细胞穿膜细胞数多于未处理干预,差异有统计学意义(P<0.05)。结论雌激素诱导的OPN蛋白表达增加导致MMP-9的表达上调,可能与子宫内膜异位症患者子宫内膜腺上皮细胞的迁移有关。
子宫内膜异位症是临床常见的妇科慢性疾病,其具体发生机制仍不明确。异位的子宫内膜能够侵袭和转移到不同的器官,使其功能被破坏,表现出与恶性肿瘤相似的特征。骨桥蛋白(OPN)是一种结合糖蛋白,在骨基质中首先被发现,与肿瘤细胞的黏附、转移、抗凋亡密切相关[1]。基质金属蛋白酶9(MMP-9)是一种锌酯酶,能够促进胶原酶Ⅳ的降解,促进肿瘤细胞的侵袭和转移。有报道称,OPN能够通过活化相应的分子通路激活MMP-9,促进恶性肿瘤的进展[2],因此,OPN/MMP-9通路可能是一种新的肿瘤转移分子机制。目前已明确,OPN及MMP-9均在正常子宫内膜晚分泌期表达[3],且在子宫内膜异位症患者的子宫内膜中,OPN及MMP-9的表达水平均明显高于正常人[4]。因此,笔者推断,与肿瘤细胞相似,OPN/MMP-9通路可能在子宫内膜腺上皮细胞的迁移中发挥重要作用,导致子宫内膜异位症的发生。
子宫内膜异位症被认定是雌激素依赖型疾病,全身或局部合成的雌激素能够促进其发生发展[5]。促性腺激素释放激素类似物(GnRH-a)等药物即是通过抑制子宫内膜细胞的增殖和转移,降低局部雌激素水平来加速其凋亡[6],成为临床上最常用的治疗子宫内膜异位症的药物。目前,雌激素调控OPN及MMP-9水平的具体机制尚不明确。根据以上发现,笔者假设:局部雌激素水平升高,导致OPN水平升高,进而通过上调MMP-9的表达,促进子宫内膜细胞的迁移,引起子宫内膜异位症的发生。本研究采用雌激素及siRNA-OPN对原代培养的子宫内膜异位症腺上皮细胞进行干预,观察OPN、MMP-9 mRNA及蛋白的表达变化,探讨其在子宫内膜异位症发生机制中的作用。
1材料与方法
1.1细胞来源选取2013年8月—2014年3月于宁夏医科大学总医院因“卵巢巧克力囊肿”行剥除术或患侧附件切除术的患者9例,术中行诊刮术获取子宫内膜。经2位病理科医师再次对其病理切片复诊后明确其子宫内膜异位症诊断。患者均处于月经分泌期,且依据美国生育协会1985年“修正子宫内膜异位症分期法”[7],均为子宫内膜异位症Ⅳ期,无重大内科疾病,否认激素治疗史。另同期选取10例行输卵管绝育术患者,术中排除合并子宫内膜异位症,同为月经分泌期,行诊刮取得在位内膜。本研究获患者知情同意及本院医学伦理委员会批准同意。
1.2细胞培养取得子宫内膜组织在低温条件下迅速送往实验室。首先,用无菌无酚红Hank′s平衡盐缓冲溶液(HBSS)清洗3次,剪刀剪成约1 mm3,再用10 ml 0.03%HBSS溶解的胶原酶Ⅳ在37 ℃条件下消化40 min。然后500 r/min离心1 min,未被消化的组织被沉淀分离出,进行下一次消化。悬浮的上皮细胞和间质细胞则被差速离心分离开。经过选择性接触再次纯化子宫内膜腺上皮细胞。以无酚红的DMEM/Ham′s F12加入10%胎牛血清、100 μg/ml链霉素、100 U/ml青霉素及 2 μg/ml的氟康唑组成培养液培养子宫内膜腺上皮细胞,隔日换液直至细胞达到90%融合。
1.3免疫细胞化学将胰酶消化并计数的子宫内膜腺上皮细胞种植于经预处理的盖玻片上。继续培养细胞,当细胞达到70%融合时,取出爬片,并将其植入4%多聚甲醛中,将细胞室温固定30 min。波形蛋白、光谱角蛋白、OPN、MMP-9等抗体(Abcam公司)用来检测细胞上的相应抗原。各抗体溶解比例如下:波形蛋白(1∶500)、光谱角蛋白(1∶500)、OPN(1∶200)及MMP-9(1∶300)。采用二抗(PV900,Zymed Laboratory,美国)孵育细胞,DAB显像,苏木精染色。
1.4雌激素干预子宫内膜腺上皮细胞达到60%融合时,吸弃培养液,将细胞置于无胎牛血清的DMEM/Ham′s F12培养液中12 h。后将培养液换为含不同浓度的17β-雌二醇及活性炭的DMEM/Ham′s F12培养液,进一步去除胎牛血清。17β-雌二醇的浓度分别设置为0、0.1、0.5、1.0、5.0、10.0 nmol/L。48 h后,采用实时荧光定量PCR技术检测不同浓度17β-雌二醇干预后OPN及MMP-9的mRNA水平。若OPN和MMP-9的mRNA水平在某一特定浓度的17β-雌二醇刺激后达到最大值,该浓度即为17β-雌二醇的最适宜浓度。取最适宜浓度的17β-雌二醇对子宫内膜腺上皮细胞进行干预,分别培养0、12、24、36、48、60、72 h。采用实时荧光定量PCR技术检测17β-雌二醇干预不同时间后OPN及MMP-9的mRNA表达水平,若OPN和MMP-9的mRNA表达水平在某一特定培养时间达到最大值,该培养时间即为17β-雌二醇干预的最适宜时间。
1.5siRNA干扰实验子宫内膜异位症腺上皮细胞分别进行无意义链siRNA转染和siRNA-OPN转染,以无意义链siRNA转染作为对照。siRNA-OPN引物序列:正义链:5′-GGUCAAAAUCUAAGAAGUUTT-3′,反义链:5′-AACUUCUUAGAUUUUGACCTC-3′;无意义链siRNA引物序列:正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′。引物序列均由上海吉玛制药技术有限公司设计。采用罗氏X-tremeGENE转染试剂,将siRNA寡核苷酸转入子宫内膜异位症腺上皮细胞中,每2×105个细胞使用10 μl转染试剂和2.5 μg siRNA。转染步骤均根据说明书进行,72 h后采用蛋白免疫印迹法检测转染效率。
1.6实时荧光定量PCR在10 cm细胞培养皿中加入1 ml TRIZOL裂解细胞,用紫外分光光度计分别读取其在波长260、280 nm处的吸光度值,并计算出RNA的纯度和浓度;RNA凝胶电泳检测后行反转录;通过Primer Premier 5.0软件设计引物,并由上海生工合成引物。OPN引物序列:正义链:5′-ACAGCCGTGGGAAGGACAGTTA-3′,反义链:5′- CCTGACTATCAATCACATCGGAATG -3′;MMP-9引物序列:正义链:5′-AGTCCACCCTTGTGCTCTTCCC-3′,反义链:5′- TCTGCCACCCGAGTGTAACCAT-3′;内参β-actin引物序列:正义链:5′-AGCGAGCATCCCCCAAAGTT-3′,反义链:5′- GGGCACGAAGGCTCATCATT-3′。
PCR反应体系的总体积20 μl,包括变性处理的RNA溶液12 μl,dNTP混合物(10 mmol/L)2 μl,RNA酶抑制剂(10 U/μl)1 μl,5×RT Buffer 4 μl,ReverTra Ace 1 μl。反应程序如下:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,变性、退火、延伸共循环40次。结束前72 ℃延伸7 min,4 ℃保存。采用2-ΔΔCt法计算OPN、MMP-9 mRNA的相对表达量。
1.7蛋白免疫印迹法取最适宜浓度的17β-雌二醇干预子宫内膜腺上皮细胞,培养最适宜时间,以未加药为对照。用冷PBS冲洗2次,250 μl RIPA(含10 μl蛋白酶抑制剂混合物)提取蛋白质。制备SDS-PAGE胶,上样后电泳分离蛋白样本,转膜,封闭,一抗、二抗孵育,ECL法检测蛋白,所得胶片采用ImageJ软件扫描其灰度值,得出OPN、MMP-9蛋白相对表达量。
1.8穿膜实验原代培养的子宫内膜异位症腺上皮细胞达到90%融合时,细胞撤血清饥饿12~24 h。0.25%胰酶消化细胞,计数后用无血清的DMEM/Ham′s F12培养液配置成1×106/ml细胞悬液。侵袭小室上室每孔加入细胞悬液100 μl,下室分别加入500 μl 的17β-雌二醇(10.0 nmol/L)、siRNA-OPN及无意义链siRNA,置于37 ℃,5%CO2培养箱,培养24 h。将侵袭小室从培养板中取出,弃去液体,将基底膜胶用2根棉签擦拭干净,PBS洗后加入4%甲醛溶液,固定15~20 min。再用PBS洗5 min。用手术刀将膜切下,台盼蓝染色,贴在玻片上,滴二甲苯,盖上盖玻片,使用Leica DC 300F正置显微镜进行观察和拍照,取16个固定位置的视野计数细胞个数。

2结果
2.1子宫内膜腺上皮细胞鉴定通过原代培养技术成功分离子宫内膜腺上皮细胞,腺上皮细胞成团生长,呈铺路石样。利用上皮来源细胞的标志物广谱角蛋白及间叶来源细胞的标记物波形蛋白,用免疫细胞化学方法进行细胞鉴定。结果显示多数细胞pan-CK染色阳性,而VIMITEN染色阴性(见图1a、1b,本文彩图详见本刊官网www.chinagp.net),提示得到纯度95%以上的子宫内膜腺上皮细胞。采用免疫细胞化学方法在原代培养的子宫内膜腺上皮细胞中检测到OPN及MMP-9的表达,均主要表达于细胞胞质(见图1c、1d)。
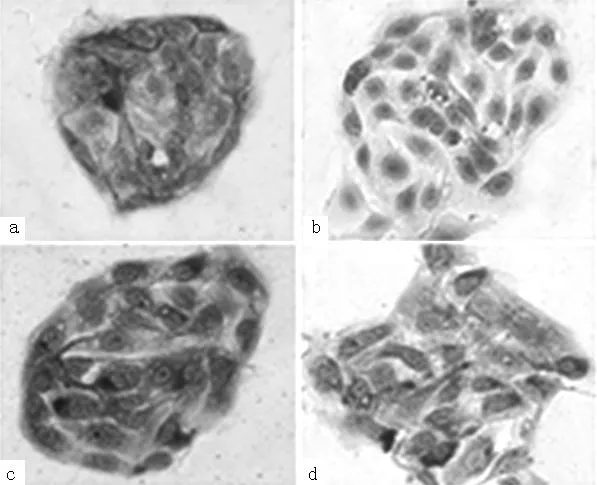
注:图a、b分别示pan-CK染色阳性及VIMITEN染色阴性;图c、d示OPN、MMP-9位于细胞胞质中
图1免疫组化检测子宫内膜腺上皮细胞OPN、MMP-9的表达
(×200)
Figure1OPN,MMP-9weredetectedincytoplasmsofendometrialepithelialcellswithimmunohistochemistry
2.2OPN、MMP-9蛋白及mRNA的相对表达水平正常子宫内膜腺上皮细胞OPN、MMP-9蛋白表达量设定为1,子宫内膜异位症腺上皮细胞OPN、MMP-9蛋白相对表达量分别为(2.53±0.57)、(3.12±0.69),高于正常子宫内膜腺上皮细胞,差异有统计学意义(tOPN=-2.310,tMMP-9=-1.375,P<0.05)。正常子宫内膜腺上皮细胞OPN及MMP-9 mRNA表达量设定为1,子宫内膜异位症腺上皮细胞OPN、MMP-9 mRNA相对表达量分别为(2.91±0.73)和(3.33±0.54),高于正常子宫内膜腺上皮细胞,差异有统计学意义(tOPN=1.681,tMMP-9=-2.362,P<0.05)。
2.317β-雌二醇干预OPN及MMP-9 mRNA均在17β-雌二醇浓度为10.0 nmol/L,培养时长为48 h时达到高峰(见图2、3)。培养48 h后,10.0 nmol/L 17β-雌二醇干预的子宫内膜异位症腺上皮细胞OPN及MMP-9蛋白表达高于未加药干预,差异有统计学意义(P<0.05,见表1)。
2.4siRNA干扰实验子宫内膜异位症腺上皮细胞经siRNA-OPN干扰后,OPN、MMP-9蛋白表达水平低于经无意义siRNA干扰,差异有统计学意义(P<0.05,见表2)。
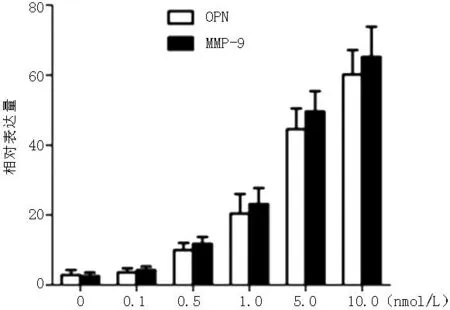
图2子宫内膜异位症腺上皮细胞不同17β-雌二醇干预浓度OPN及MMP-9 mRNA表达水平
Figure 217 β-estradiol dose-dependent response of OPN and MMP-9 mRNA expression in EEECs
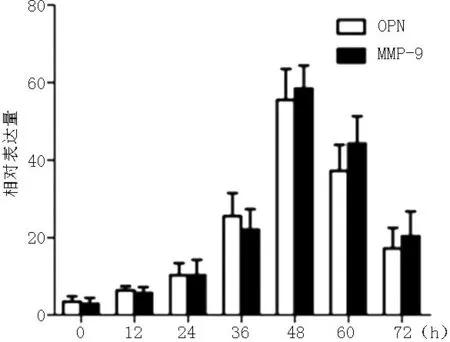
图3子宫内膜异位症腺上皮细胞不同培养时间OPN及MMP-9 mRNA表达水平
Figure 3Time-dependent response of OPN and MMP-9 mRNA expression in EEECs

Table 1Comparison of OPN and MMP-9 protein expression in EEECs between different treatments

干预措施OPNMMP-9未加药2.32±0.463.02±1.2817β-雌二醇48.91±6.2177.35±10.67t值-1.824-2.351P值0.0030.001
2.5穿膜实验未处理、无意义链siRNA干扰、siRNA-OPN干扰及17β-雌二醇干预后,子宫内膜异位症腺上皮细胞穿膜细胞数分别为(65±12)、(62±18)、(25±8)、(250±39)个。不同干预措施处理后,子宫内膜异位症腺上皮细胞穿膜细胞数比较,差异有统计学意义(F=4.927,P<0.05);其中,17β-雌二醇干预的子宫内膜异位症腺上皮细胞穿膜细胞数多于未处理干预,siRNA-OPN干扰的子宫内膜异位症腺上皮细胞穿膜细胞数少于未处理干预,差异有统计学意义(P<0.05,见图4)。

Table 2Comparison of OPN and MMP-9 protein expression in EEECs between various siRNA interventions
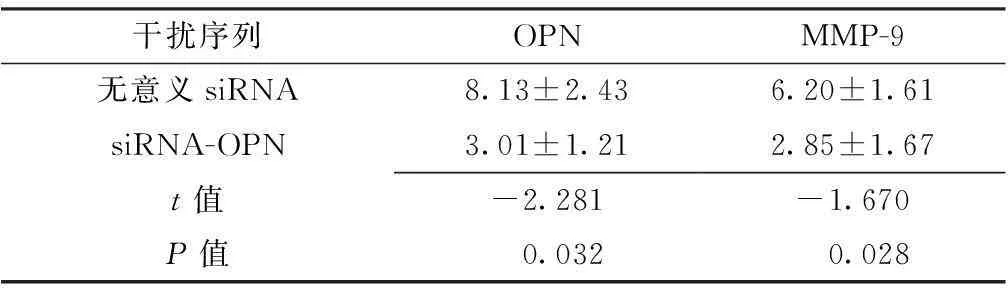
干扰序列OPNMMP-9无意义siRNA8.13±2.436.20±1.61siRNA-OPN3.01±1.212.85±1.67t值-2.281-1.670P值0.0320.028

注:图a~d依次为未处理、无意义链siRNA干扰、siRNA-OPN干扰及17β-雌二醇干预的子宫内膜异位症腺上皮细胞
图4子宫内膜异位症腺上皮细胞穿膜实验(台盼蓝染色,×100)
Figure 4Transwell assay of the EEECs
3讨论
子宫内膜异位症是常见妇科疾病,其具体发病机制尚不明确。子宫内膜细胞从正常位置分离,到达并侵入子宫外器官和组织,与肿瘤细胞的转移方式极为相似。许多与恶性肿瘤病理过程密切相关的蛋白如OPN及MMP-9,同样被报道与子宫内膜异位症的发生密切相关[8-9]。为进一步阐明子宫内膜异位症的发病机制,本研究采用雌激素及siRNA-OPN对原代培养的子宫内膜腺上皮细胞进行干预,并检测干预前后子宫内膜腺上皮细胞OPN、MMP-9 mRNA及蛋白的表达,以穿膜实验检测子宫内膜腺上皮细胞侵袭性的变化。
OPN是一种分泌型磷酸糖蛋白,与细胞黏附、趋化、血管新生、抗凋亡等活动密切相关。有研究证实,OPN在多种恶性肿瘤细胞中表达增强[1],其可能是恶性肿瘤早期侵袭和转移过程中的关键因子。MMP-9是基质金属蛋白酶家族成员,为分子量最大的明胶酶,在肿瘤细胞膜的表面表达,能降解细胞外基质中Ⅳ型、Ⅴ型胶原和明胶,促进血管生成,为肿瘤细胞的侵袭浸润创造条件[10]。有报道称,OPN能活化PI3-K/Akt通路,上调缺氧诱导因子-1α(HIF-1α)表达,经由v3整合素,通过尿激酶型纤溶酶原激活剂(uPA)和MMP-9降解细胞外基质,进而促进肿瘤细胞的转移[2]。亦有报道称,在胃癌的发病过程中,OPN通过NF-κB通路活化MMP-2和MMP-9,促进胃癌的进展[11]。近年多个关于子宫内膜异位症的分子机制研究显示,OPN、MMP-9在整个生殖周期中均可波动性的表达于正常子宫内膜腺体,而在同样月经周期的子宫内膜异位症患者的在位、异位内膜腺体中,OPN、MMP-9均呈明显高表达[8-9]。上述研究表明,OPN与MMP-9的高表达可能是导致子宫内膜分离、黏附并迁移至子宫外组织的关键因素。
子宫内膜异位症为性激素依赖性疾病。国内外众多研究显示,子宫内膜异位症发病过程中,异位内膜的生长和侵袭首先是细胞的异位黏附、转移,而子宫内膜腺上皮细胞被认为在该过程发挥主要作用[12],而雌激素水平在此过程中也发挥重要调控作用[13-14];机制学研究显示,雌激素需要与内膜腺上皮细胞的相应受体特异性结合,启动相应的分子信号通路,对基因表达及细胞的代谢进行调控[15],调节子宫内膜的周期性变化,并通过某些特定因子的表达使细胞的侵袭性增强,促进细胞异位黏附侵袭。
本研究对子宫内膜腺上皮细胞进行分离并原代培养,排除了混杂的子宫内膜间质细胞。通过不同剂量雌激素的干预,子宫内膜异位症腺上皮细胞OPN及MMP-9表达上调。表明OPN及MMP-9的水平与局部雌激素水平密切相关。雌激素是子宫内膜异位症发生过程中的关键激素,其通过与雌激素受体结合而发挥作用,包括ER-α和ER-β[16]。研究发现,雌激素受体在子宫内膜异位症腺上皮细胞中表达明显高于正常子宫内膜。长期局部雌激素刺激可能会导致雌激素受体的过表达[17],而雌激素与受体的过度结合将活化下游基因表达。本研究印证了雌激素是促进子宫内膜异位症腺上皮细胞OPN及MMP-9高表达的关键因素这一假说。
本研究采用穿膜实验检测雌激素及siRNA-OPN干扰后子宫内膜异位症腺上皮细胞侵袭性的变化,以验证子宫内膜异位症腺上皮细胞的迁移是否受到雌激素及OPN/MMP-9通路的调节,结果显示雌激素干扰后子宫内膜异位症腺上皮细胞穿膜细胞数增多,而siRNA-OPN干扰则使穿膜细胞数减少。说明雌激素/OPN/MMP-9通路在子宫内膜异位症腺上皮细胞的迁移过程中发挥作用。
目前,子宫内膜异位症的药物治疗主要是以抑制雌激素合成使异位内膜萎缩,阻断下丘脑-卵巢轴的刺激和出血周期为目的的性激素治疗,其仅适用于有慢性盆腔痛、痛经症状明显、有生育要求而无卵巢囊肿形成者,存在依从性差、易复发等问题。本研究对雌激素调控OPN、MMP-9的细胞信号途径和调控网络进一步研究,力图推动药物治疗子宫内膜异位症的新进展,为后续从机制上对子宫内膜异位症进行有效的药物干预、指导临床治疗和随访提供依据,降低复发率,提高疗效。
作者贡献:杨眉进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;蒋春樊进行课题实施、评估、资料收集;哈春芳进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Anborgh PH,Mutrie JC,Tuck AB,et al.Role of the metastasis-promoting protein osteopontin in the tumour microenvironment[J].J Cell Mol Med,2010,14(8):2037-2044.
[2]Song G,Cai QF,Mao YB,et al.Osteopontin promotes ovarian cancer progression and cell survival and increases HIF-1alpha expression through the PI3-K/Akt pathway[J].Cancer Sci,2008,99(10):1901-1907.
[3]Allan G,Campen C,Hodgen G,et al.Identification of genes with differential regulation in primate endometrium during the proliferative and secretory phases of the cycle[J].Endocr Res,2003,29(1):53-65.
[4]Cho S,Ahn YS,Choi YS,et al.Endometrial osteopontin mRNA expression and plasma osteopontin levels are increased in patients with endometriosis[J].Am J Reprod Immunol,2009,61(4):286-293.
[5]Rizner TL.Estrogen metabolism and action in endometriosis[J].Mol Cell Endocrinol,2009,307(1/2): 8-18.
[6]Meresman GF,Bilotas M,Buquet RA,et al.Gonadotropin-releasing hormone agonist induces apoptosis and reduces cell proliferation in eutopic endometrial cultures from women with endometriosis[J].Fertil Steril,2003,80(S2):702-707.
[7]Zhang HX.Staging and classification of endometriosis:current systems and the novel yao classification[J].Journal of International Obstetrics and Gynecology,2012,39(5):471-475.(in Chinese)
张焕晓.子宫内膜异位症分型的思考、建议及意义[J].国际妇产科学杂志,2012,39(5):471-475.
[8]Ueda M,Yamashita Y,Takehara M,et al.Gene expression of adhesion molecules and matrix metalloproteinases in endometriosis[J].Gynecol Endocrinol,2002,16(5):391-402.
[9]Han YJ,Kim HN,Yoon JK,et al.Haplotype analysis of the matrix metalloproteinase-9 gene associated with advanced-stage endometriosis[J].Fertil Steril,2009,91(6):2324-2330.
[10]Curry TE Jr,Osteen KG.The matrix metalloproteinase system:changes,regulation,and impact throughout the ovarian and uterine reproductive cycle[J].Endocr Rev,2003,24(4):428-465.
[11]Liu J,Liu Q,Wan Y,et al.Osteopontin promotes the progression of gastric cancer through the NF-κB pathway regulated by the MAPK and PI3K[J].Int J Oncol,2014,45(1):282-290.
[12]Witz CA,Thomas MR,Montoya-Rodriguez IA,et al.Short-term culture of peritoneum explants confirms attachment of endometrium to intact peritoneal mesothelium[J].Fertil Steril,2001,75(2):385-390.
[13]Huber A,Keck CC,Hefler LA,et al.Ten estrogen-related polymorphisms and endometriosis:a study of multiple gene-gene in terections[J].Obstet Gynecol,2005,106(5 Pt 1):753-781.
[14]Bulun SE,Cheng YH,Yin P,et al.Progesterone resistance in endometriosis:link to failure to metabolize estradiol[J].Mol Cell Endocrinol,2006,248(1/2):1321-1331.
[15]Pavone ME,Bulun SE.Aromatase inhibitors for the treatment of endometriosis[J].Fertil Steril,2012,98(6):1370-1379.
[16]Bulun SE,Monsavais D,Pavone ME,et al.Role of estrogen receptor-beta in endometriosis[J].Semin Reprod Med,2012,30(1):39-45.
[17]Huhtinen K,Desai R,Salminen A,et al.Endometrial and endometriotic concentrations of estrone and estradiol are determined by local metabolism rather than circulating levels[J].J Clin Endocrinol Metab,2012,97(11):4228-4235.
(本文编辑:吴立波)------------------------------------------------------------------------------------------------
【关键词】子宫内膜异位症;骨桥蛋白质;基质金属蛋白酶-9;雌激素类
杨眉,蒋春樊,哈春芳.雌激素介导骨桥蛋白/基质金属蛋白酶9通路调节子宫内膜异位症腺上皮细胞侵袭性的研究[J].中国全科医学,2016,19(5):554-559.[www.chinagp.net]
Yang M,Jiang CF,Ha CF.Up-regulation of matrix metalloproteinase-9 via activation of the osteopontin induced by estrogen correlates with migration of endometrial epithelial cells in endometriosis[J].Chinese General Practice,2016,19(5):554-559.
Up-regulation of Matrix Metalloproteinase-9 via Activation of the Osteopontin Induced by Estrogen Correlates With Migration of Endometrial Epithelial Cells in EndometriosisYANGMei,JIANGChun-fan,HAChun-fang.NingxiaMedicalUniversity,Yinchuan750004,China
【Abstract】ObjectiveTo investigate the relationship between the expression of osteopontin(OPN) and matrix metalloproteinase-9(MMP-9) and endometriotic migration of the endometrial epithelial cells(EECs) from patients with endometriosis.MethodsNine women with ovarian endometriosis cyst were recruited before surgery.All these patients underwent oophorocystectomy or adnexectomy in the General Hospital,Ningxia Medical University from August,2013 to March,2014.Ten women undergoing tubal ligation for sterilization were recruited as controls.The primary culture of EECs were performed to investigated the mRNA and protein expression of OPN and MMP-9 in normal endometrial epithelial cells(NEECs) and in the endometrial epithelial cells from patients with endometriosis(EEECs).The protein expression of OPN and MMP-9 in EEECs were investigated after those cells were treated with 17 β-estradiol at the optimum concentration and time point.The protein expression of OPN and MMP-9 in EEECs were investigated after OPN-specific siRNA or scrambled siRNA interference,the scrambled siRNA interference was used as control.When EEECs had reached 90% confluence,they were made cell suspension at concentration of 1×106/ml.500 μl 17 β-estradiol ,OPN-specific siRNA or scrambled siRNA were respectively added to the lower chamber,the cells in 16 visual fields per insert were counted and photographed after cell culture.ResultsEECs grew clonally in clumps and displayed the typical cobblestone morphology.The expression of OPN and MMP-9 was detected in the cytoplasm of most EECs.The relative protein expression levels of OPN and MMP-9 in EEECs were (2.53±0.57)and(3.12±0.69),were higher than those in NEECs (tOPN=-2.310,tMMP-9=-1.375,P<0.05).The mRNA expression levels of OPN and MMP-9 in EEECs were (2.91±0.73) and (3.33±0.54),were higher than those in NEECs(tOPN=1.681,tMMP-9=-2.362;P<0.05).OPN and MMP-9 mRNA expression levels reached their maximum 48 h after the beginning of the intervention at 10.0 nmol/L of 17 β-estradiol.The protein expression levels of OPN and MMP-9 were remarkably increased by 10.0 nmol/L of 17 β-estradiol,48 h after the beginning of the intervention compared with the untreated group or decreased by siRNA-OPN interference compared with the scrambled siRNA interference group in EEECs(P<0.05).There were significant differences after different treatment about the migration abilities of EEECs.The cells counted on the lower surface of the insert membrane were increased after cells were treated with 17 β-estradiol;on the other hand,they were reduced with siRNA-OPN interference(P<0.05).ConclusionThe up-regulation of MMP-9 via activation of OPN induced by estrogen may correlate with the migration of endometrial epithelial cells in endometriosis patients.
【Key words】Endometriosis;Osteopontin;Matrix metalloproteinase 9;Estrogens
(收稿日期:2015-08-29;修回日期:2015-11-20)
【中图分类号】R 711.71
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.05.014
通信作者:哈春芳,750004宁夏银川市,宁夏医科大学总医院妇产科;E-mail:hachunfang@163.com
基金项目:国家自然科学基金资助项目(81160078)
作者单位:750004宁夏银川市,宁夏医科大学(杨眉);湖北省文理学院附属襄阳市中心医院妇产科(杨眉),病理科(蒋春樊);宁夏医科大学总医院妇产科(哈春芳)

