林伍德连翘的组织培养技术
范淑芳, 简大为, 罗兰艳, 罗 峰, 李 伟
(1.荆楚理工学院 生物工程学院, 湖北 荆门 448000; 2.荆门市林业局, 湖北 荆门 448000; 3.荆门市林业科学研究所, 湖北 荆门 448000)
林伍德连翘的组织培养技术
范淑芳1, 简大为2*, 罗兰艳3, 罗 峰3, 李 伟2
(1.荆楚理工学院 生物工程学院, 湖北 荆门 448000; 2.荆门市林业局, 湖北 荆门 448000; 3.荆门市林业科学研究所, 湖北 荆门 448000)
为大规模工厂化生产林伍德连翘,以当年生新枝为外植体建立无菌组培苗进行增殖及生根培养试验。结果表明:林伍德连翘的增殖培养基以WPM+ZT0.5 mg/L+NAA0.01 mg/L较为适宜,生根培养基则以1/2WPM+IBA 0.50 mg/L较为适宜,生根移栽较适宜的基质为泥炭土和珍珠岩的混合基质。
林伍德连翘; 组织培养; 无菌苗
林伍德连翘(ForsythiaintermediaLynwood Gold)为木犀科连翘属落叶灌木,早春时节先开花后长叶,满枝金黄,艳丽骄人,是早春优良的观花灌木,在中国园林博物馆室外展区有栽种[1-2]。同时连翘果实为中药中的连翘,具有清热止吐、清肝利胆、除湿退黄、通调三焦、畅达血脉、保肝护心等作用[3-4],也是一种较好的中药材。苗木繁殖多为扦插繁殖,但扦插繁殖系数低,速度慢,且扦插成活当年芽生长缓慢[5]。近年来,关于连翘组培快繁技术的研究有较多报道,苏荣存[5]、武翼[6]、张进献[7]、王金玲[8]、吴潇[9]等均通过不同的基本培养基、不同的激素组合进行组织培养并取得了成功[10]。但WPM基本培养基、ZT细胞分裂素对连翘的组培影响尚无报道。因此,为加速林伍德连翘在园林绿化及中药材中的应用,笔者以WPM为基本培养基,试验不同的ZT浓度搭配NAA对增殖培养的影响、不同的IBA浓度搭配活性炭对生根培养的影响,以建立林伍德连翘快速繁殖的工艺流程,为大规模工厂化生产组培苗提供理论和实践依据。
1 材料与方法
1.1 试验材料及处理
剪取林伍德连翘当年生新枝作为外植体,留短叶柄去除叶片后将其剪成3~5 cm长的小茎段,放入大烧杯用洗衣粉水浸泡并用软毛刷轻轻刷洗5~6 min,用自来水冲洗1.5~2 h;在超净工作台上用75%的酒精振荡40~50 s,用无菌水冲洗1~2次,放入2%的次氯酸钠中振荡消毒20~25 min,用无菌水冲洗4~5次,用无菌滤纸吸干枝条上水分。切除茎段两端坏死的部分后、按每芽一段切成0.5~1.0 cm的茎段,竖接至初培培养基(WPM+0.5 mg/L ZT+0.1 mg/L NAA+30 g/L糖+8 g/L琼脂,pH 5.6)上,视丛生芽诱导情况,初培15~30 d后将丛生苗切成0.8~1.0 cm长的茎段后接种到继代培养基(WPM+0.5 mg/L ZT+0.05 mg/L NAA+30 g/L糖+8 g/L琼脂,pH 5.6)上,每20 d继代1次,继代培养2~3次后获得的组培苗。
试验中所有的组织培养条件均为温度(25±2)℃、相对湿度70%、光照度2 000 Lx,每天光照14 h。
1.2 试验设计
1.2.1 不同激素处理组合对增殖培养的影响 在带芽茎段的培养中采用ZT 0.5 mg/L、1.0 mg/L、2.0 mg/L与NAA 0.01 mg/L、0.10 mg/L、0.20 mg/L不同组合作为生长调节剂诱导芽的形成与增殖,按完全实验法进行试验处理,其中基本培养基为WPM,蔗糖30 g/L,琼脂8 g/L,pH调节到5.6。每组试验均选取生长一致的丛生苗,在超净工作台上切约0.8~1.0 cm长的小茎段,每瓶接种3株,每处理重复6次。接种后置于培养室,分别培养20 d和40 d后记录丛生芽数量和平均芽长。
1.2.2 不同处理组合对生根培养的影响 当芽增殖到足够数量时,进行瓶内生根诱导的培养试验,采用IBA 0.10 mg/L、0.25 mg/L、0.50 mg/L分别与AC0 mg/L、1 mg/L不同组合诱导瓶内生根,按完全实验法进行试验处理,其中基本培养基为1/2WPM,蔗糖20 g/L,琼脂8 g/L,pH调节到5.6。每组试验均选取生长一致的丛生苗,在超净工作台上切成2.0~2.5 cm长的小茎段,每瓶接种3株,各重复6次,接种后置于培养室,30 d后记录生根株数、每株生根条数和平均根长。
1.2.3 栽培基质对移栽的影响 选择瓶内生根较一致的组培苗,分别栽种到由泥炭土和珍珠岩按不同比例混合而成的基质中,其中泥炭土∶珍珠岩分别为1∶9,3∶7,5∶5,7∶3,9∶1,以试验栽培基质对移栽生根苗的影响。栽培容器为40孔/盘的穴盘,每处理4株,各10个重复。栽种完成后置于温室,控制温度(25±5)℃,透光率70%,通过栽培容器上搭小棚,控制棚内空气温度80%~95%。栽种60 d后记录移栽成活株数。
1.3 数据处理
采用Excel 2003和SAS 9.2软件进行数据统计处理及分析。
2 结果与分析
2.1 不同激素处理组合的增殖培养
由图示、表1可知,当ZT浓度不变时,随着NAA浓度的升高,增殖芽数逐渐降低而平均芽长逐渐增高;当NAA浓度不变时,随着ZT浓度的升高,增殖芽数也逐渐降低而平均芽长逐渐增高。在增殖培养20 d,当ZT浓度为0.5 mg/L,NAA浓度为0.01 mg/L时,增殖芽数为2.06,平均芽长为1.75 cm,且二者与其他处理间均无显著性差异。随着时间的增长,在培养40 d后,各处理间的增殖芽数和平均芽长均增加,当ZT浓度为0.5 mg/L,NAA浓度为0.01 mg/L时,增殖芽数增加幅度最大,达2.61,与处理2和处理4的差异不显著,但与其他处理存在显著性差异。综合考虑增殖芽数和芽长,低浓度的ZT和低浓度的NAA有利于增殖培养,可确定ZT 0.5 mg/L+NAA0.01 mg/L为林伍德连翘增殖培养中较好的激素组合。
2.2 不同处理组合的生根培养
由图示、表2可知,当活性炭浓度一定,随着IBA浓度的增加,生根率逐渐增加,平均生根条数也增多,而平均根长逐渐降低。当IBA浓度为0.50 mg/L,不添加活性炭时,生根率可达100%,与其他各处理的差异不显著;平均生根条数最多,达5.39,与其他各处理的差异极显著;而平均根长最低,为2.89,与其他各处理也存在极显著差异。平均根长最长的处理为4号处理,但其生根率和平均生根条数均最低。综合考虑三方面因素,可以确定IBA 0.50 mg/L为林伍德连翘生根培养较好的激素处理。

图示 林伍德连翘植株生长状况
Fig. Growth status ofF.intermediaLynwood Gold
表1 不同激素组合处理林伍德连翘的增殖培养
Table 1 Proliferation culture ofForsythiaintermediaLynwood Gold shoots cultured on media with different hormone combination
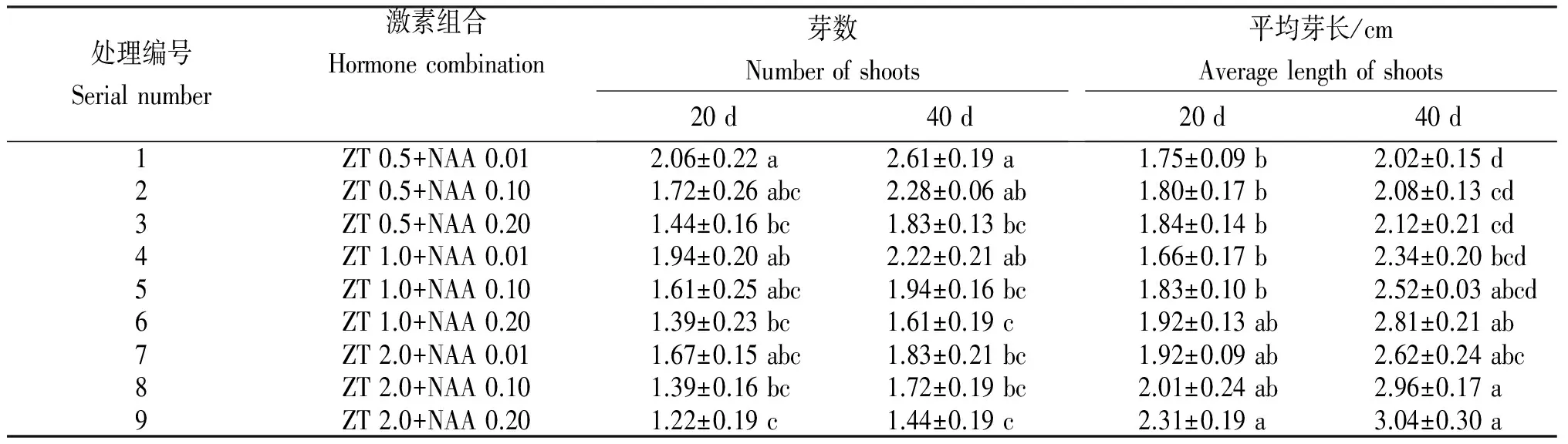
处理编号Serialnumber激素组合Hormonecombination芽数Numberofshoots20d40d平均芽长/cmAveragelengthofshoots20d40d1ZT0.5+NAA0.012.06±0.22a2.61±0.19a1.75±0.09b2.02±0.15d2ZT0.5+NAA0.101.72±0.26abc2.28±0.06ab1.80±0.17b2.08±0.13cd3ZT0.5+NAA0.201.44±0.16bc1.83±0.13bc1.84±0.14b2.12±0.21cd4ZT1.0+NAA0.011.94±0.20ab2.22±0.21ab1.66±0.17b2.34±0.20bcd5ZT1.0+NAA0.101.61±0.25abc1.94±0.16bc1.83±0.10b2.52±0.03abcd6ZT1.0+NAA0.201.39±0.23bc1.61±0.19c1.92±0.13ab2.81±0.21ab7ZT2.0+NAA0.011.67±0.15abc1.83±0.21bc1.92±0.09ab2.62±0.24abc8ZT2.0+NAA0.101.39±0.16bc1.72±0.19bc2.01±0.24ab2.96±0.17a9ZT2.0+NAA0.201.22±0.19c1.44±0.19c2.31±0.19a3.04±0.30a
注:同列中不同小写字母表示差异水平达0.05(下同)。
Note:Different lowercase letters in the same column indicate significance of difference atP<0.05. The same below.
表2 不同处理组合对瓶内林伍德连翘的生根培养
Table 2 Rooting culture ofF.intermediaLynwood Gold plantlets cultured on media with different hormone combination
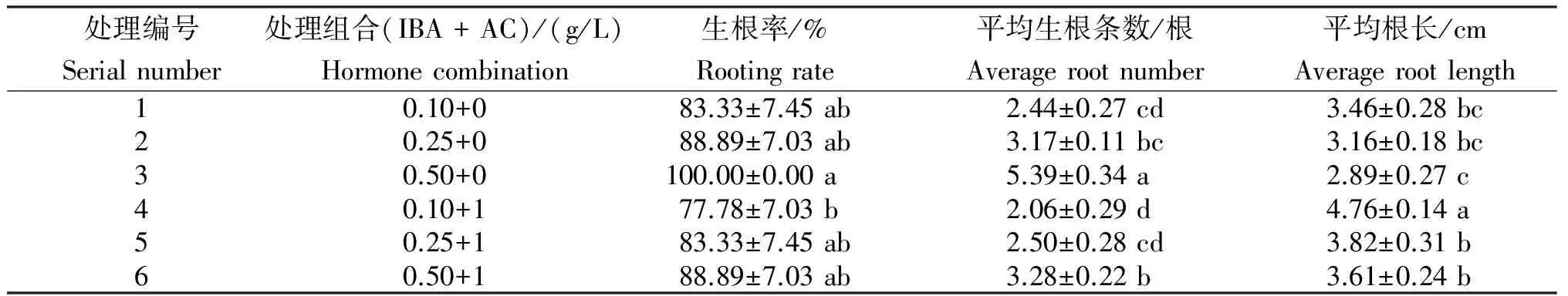
处理编号Serialnumber处理组合(IBA+AC)/(g/L)Hormonecombination生根率/%Rootingrate平均生根条数/根Averagerootnumber平均根长/cmAveragerootlength10.10+083.33±7.45ab2.44±0.27cd3.46±0.28bc20.25+088.89±7.03ab3.17±0.11bc3.16±0.18bc30.50+0100.00±0.00a5.39±0.34a2.89±0.27c40.10+177.78±7.03b2.06±0.29d4.76±0.14a50.25+183.33±7.45ab2.50±0.28cd3.82±0.31b60.50+188.89±7.03ab3.28±0.22b3.61±0.24b
表3 不同栽培基质移栽林伍德连翘的长势
Table 3 Growth vigor ofF.intermediaLynwood Gold plantlets cultured on different transplanting media
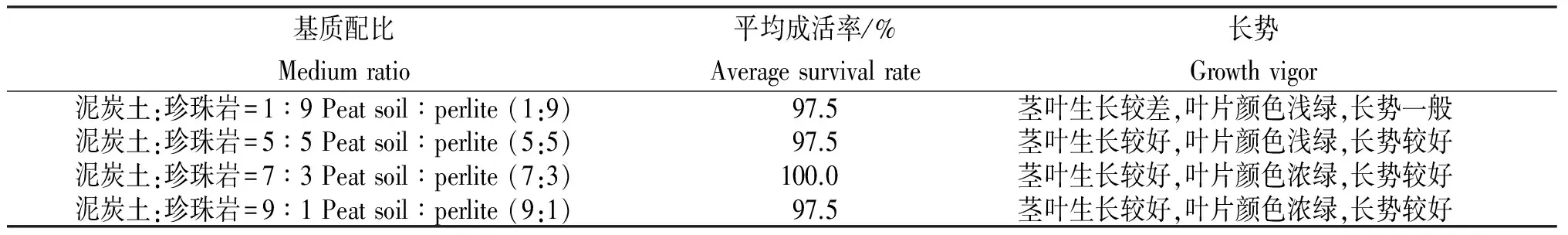
基质配比Mediumratio平均成活率/%Averagesurvivalrate长势Growthvigor泥炭土:珍珠岩=1∶9Peatsoil∶perlite(1:9)97.5茎叶生长较差,叶片颜色浅绿,长势一般泥炭土:珍珠岩=5∶5Peatsoil∶perlite(5:5)97.5茎叶生长较好,叶片颜色浅绿,长势较好泥炭土:珍珠岩=7∶3Peatsoil∶perlite(7:3)100.0茎叶生长较好,叶片颜色浓绿,长势较好泥炭土:珍珠岩=9∶1Peatsoil∶perlite(9:1)97.5茎叶生长较好,叶片颜色浓绿,长势较好
2.3 不同栽培基质下的移栽
由表3可知,将瓶内生根苗移栽到不同比例的混合基质上时,移栽成活率均达95%以上,且就移栽苗的生长状况而言(图示),泥炭土占比越大,植株生长状况越好。故林伍德连翘瓶内生根苗的移栽易成活,但在林伍德连翘生根苗移栽的过程中,栽培基质以泥炭土为主时移栽效果更好。
3 结论与讨论
在本试验中,林伍德连翘增殖培养的较适宜培养基为WPM+ZT 0.5 mg/L+NAA 0.01 mg/L;生根培养的较适宜培养基为1/2WPM+IBA 0.50 mg/L;生根移栽的较适宜基质为泥炭土和珍珠岩的混合基质,且以泥炭土为主时有利于成活植株的生长。
在林伍德连翘增殖培养中,本试验采用前人均未使用的ZT作为细胞分裂素,结果表明,低浓度ZT和低浓度NAA组合最有利于增殖培养,虽然此组合的平均芽长与其他组合的平均芽长有显著区别,但40 d后芽长也达2.02 cm,足以满足生产所需,所以确定ZT 0.5 mg/L+NAA 0.01 mg/L为林伍德连翘增殖培养中较好的激素组合。
在林伍德连翘生根培养中,添加活性炭时的生根率、平均生根条数均低于不添加活性炭的处理,而只有平均根长相反。由试验数据可知,活性炭有利于林伍德连翘根长的生长,但不利于提高生根率和生根条数,综合考虑多因素,确定不添加活性炭、IBA 0.50 mg/L为林伍德连翘生根培养较好的激素处理。
在连翘的组织培养中,苏荣存[5]、张进献[7]、王金玲[8]等均以MS作为基本培养基,6-BA作为细胞分裂素,并取得了较好的效果。而本试验中,以WPM作为基本培养基,ZT作为细胞分裂素进行增殖及生根培养,取得了较好的效果。在进一步的研究中,可以对基本培养基、激素组合等进行细化筛选,以期找出更好的组培快繁培养基,提高生产效率。
[1] 邬洪涛,张宝鑫,李炜民,等.中国园林博物馆染霞山房展区营建研究[J].风景园林,2014(3):74-77.
[2] 郭 翎,权 键,周悦玥.中国园林博物馆室外展区植物品种的选择[J].农业科技与信息(现代园林),2013,10(9):11-17.
[3] 李卫建,李先恩.连翘有效成分含量与土壤养分的量化关系研究[J].中国中药杂志,2005,30(20):1577-1580.
[4] 徐 皓.贯叶连翘的化学成分及药理作用研究[J].安徽农业科学,2011,9(2):48-49.
[5] 苏荣存,张 红,贾海慧.金叶连翘组织培养快繁技术的研究[J].吉林林业科技,2006,35(3):5-6.
[6] 武 翼,刘晓霞,冯家祺,等.变异连翘的组织培养及快速繁殖的研究[J].山东林业科技,2007(3):42-43.
[7] 张进献,张佳琪,李冬杰,等.细叶连翘的组织培养与快速繁殖[J].安徽农业科学,2009,37(22):10403,10541.
[8] 王金玲,杜凤国.金钟连翘组织培养与快速繁殖[J].北方园艺,2012(8):138-139.
[9] 吴 潇,刘 阳,张咪咪,等.山西道地药材连翘组织培养快速繁育技术研究[J].安徽农业科学,2015,43(12):41-42,47.
[10] 袁小亚,王阿丽,任士福.连翘组织培养研究进展[J].河北林果研究,2014,29(1):111-114.
(责任编辑: 刘忠丽)
Tissue Culture Technique ofForsythiaintermediaLynwood Gold
FAN Shufang1, JIAN Dawei2*, LUO Lanyan3, LUO Feng3, LI Wei2
(1.CollegeofBiologicalEngineering,JingchuUniversityofTechnology,Jingmen,Hubei448000; 2.JingmenForestryBureau,Jingmen,Hubei448000; 3.JingmenInstituteofForestryScience,Jingmen,Hubei448000,China)
The proliferation and rooting test of asepticF.intermediaLynwood Gold plantlets cultured from new shoots ofF.intermediaLynwood Gold was conducted to produceF.intermediaLynwood Gold seedlings on a large scale. Results: The optimum media for proliferation and rooting ofF.intermediaLynwood Gold plantlets are WPM + ZT 0.5 mg/L + NAA 0.01 mg/L and 1/2WPM + IBA 0.50 mg/L separately. The survival rate ofF.intermediaLynwoodGold plantlets transplanted on the mixed substrate of peat soil and perlite can reach above 95%.
ForsythiaintermediaLynwood Gold; tissue culture; aseptic plantlet
2015-08-15; 2016-02-28修回
范淑芳(1977-),女,讲师,硕士,从事植物种子资源开发与利用。E-mail:fsf03@163.com
*通讯作者:简大为(1977-),男,高级工程师(林业),硕士,从事植物新品种推广应用。E-mail:jdw0577@126.com
1001-3601(2016)03-0134-0145-03
S567.9
A

