不同温度对全缘叶绿绒蒿种子萌发及抗氧化物酶活性的影响
廖捷敏, 覃丽娜, 彭 瀚, 吴 云, 刘光立*
(1.四川农业大学 风景园林学院, 四川 成都 611130; 2.四川农业大学 研究生院, 四川 成都 611130)
不同温度对全缘叶绿绒蒿种子萌发及抗氧化物酶活性的影响
廖捷敏1,2, 覃丽娜1,2, 彭 瀚1, 吴 云1,2, 刘光立1*
(1.四川农业大学 风景园林学院, 四川 成都 611130; 2.四川农业大学 研究生院, 四川 成都 611130)
为进一步认识全缘叶绿绒蒿种子的生理特性,为后期绿绒蒿属植物引种驯化提供指导,以全缘叶绿绒蒿成熟种子为试验材料,经过变温层积处理,将其置于0℃、5℃、10℃、15℃和20℃恒温条件下萌发,测定种子发芽率以及萌发过程中种子各类酶活性的变化。结果表明:除0 ℃外,全缘叶绿绒蒿种子均有不同程度的萌发,20℃条件下萌发率最高,发芽率达18.8%;萌发早期种子淀粉酶活性较高,后期POD、SOD、CAT活性较强,峰值分别达471 U/(g·min)、262.5 U/(g·min)和44.625 U/(g·min)。温度对种子淀粉酶、POD、SOD、CAT活性均存在显著影响(P<0.05),在0~20℃,温度越高,全缘叶绿绒蒿种子萌发能力越强。
全缘叶绿绒蒿; 种子萌发; 发芽率; 酶活性; 温度
全缘叶绿绒蒿〔Meconopsisintegrifolia(Maxim.) Franch.〕系罂粟科绿绒蒿属一年生或多年生草本[1],生长于海拔2 500~5 000 m的草坡或林下,以种子进行繁殖[2]。主要分布于我国四川西部、西北部,西藏东南部,甘肃西南部,青海东南部以及缅甸东北部[3]。作为具有较高观赏价值和药用价值的野生花卉资源,全缘叶绿绒蒿可作城市花坛及小花坪的绿化材料,亦是盆栽佳品,也可作切花[1]。
种子是植物生活史的一个重要环节,与种群密切相关,对种子萌发特性的研究也是植物种群生物学特性研究的重要内容[1]。目前,国内对全缘叶绿绒蒿化学成分及药理活性方面的研究较多,对其萌发特性方面的研究相对较少。在植物种子萌发过程中,受内外多种因素的影响。其中,温度是影响种子成熟期间休眠诱导和种子萌发期间休眠表达的最重要环境因子之一,且在高寒草甸地区,温度也是种子萌发最主要的调节因子。石慧珍等[1]研究了温度对全缘叶绿绒蒿种子的萌发率、萌发速率和萌发时滞的影响,但对萌发过程中,缺乏不同温度对各种酶活性变化的影响研究。碳水化合物代谢过程中能量贮藏与分解是绿绒蒿种子萌发的基础;同时超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等保护酶对活性氧的清除,可一定程度削弱绿绒蒿种子萌发过程中不利环境因子的影响。因此,笔者对不同温度条件下全缘叶绿绒蒿种子发芽率及酶活性变化进行研究,以探讨温度对种子萌发的影响,以期为进一步认识全缘叶绿绒蒿种子的生理特性,本属植物的引种、驯化及保护提供借鉴。
1 材料与方法
1.1 种子的收集与处理
于2013年8月在四川省阿坝藏族羌族自治州小金县巴郎山阳坡(102°53.850′~102°56.806′E,30°52.828′~30°54.671′N)采集成熟的全缘叶绿绒蒿果实,带回实验室,取出种子并风干;将风干36 h的种子置于牛皮纸信封后装入塑料袋中,于4℃冰箱层积30 d后,将其放入-20 ℃冰箱层积30 d后再放入4℃冰箱层积30 d,如此循环层积处理7个月后取出待用。
1.2 种子的培养、发芽及指标测定
培养:将层积处理后的种子用清水浸泡3 h后,置于0℃、5℃、10℃、15℃和20℃培养箱培养,各处理1 000粒种子,3次重复,共计15 000粒种子。
发芽:发芽床均为150 mm的培养皿,培养皿下垫3层滤纸,盖上皿盖保湿,将培养皿放置于GXZ型智能光照培养箱(宁波江南仪器厂)中进行发芽试验。发芽当天测定各类处理种子的酶活性,并统计当日发芽率,各项测定均3次重复;此后每隔5 d测定1次各项指标,共40 d。
指标测定:淀粉酶活性采用3,5-二硝基水杨酸法[4]测定,POD活性采用愈创木酚法[5]测定,SOD活性采用氮蓝四唑(NBT)光化学还原法[6]测定,CAT活性采用紫外分光光度法[7]测定。统计种子发芽粒数以根长为种子1/2长度作为发芽标准,根长等于或大于种子1/2长度时视为发芽。
发芽率(G)= (n/N)×100%
式中,n为发芽种子数,N为试验种子总数。
1.3 数据处理及分析
采用Excel软件进行试验数据的录入和数据图表的制作,采用 SPSS 19.0 数据统计软件进行数据分析。
2 结果与分析
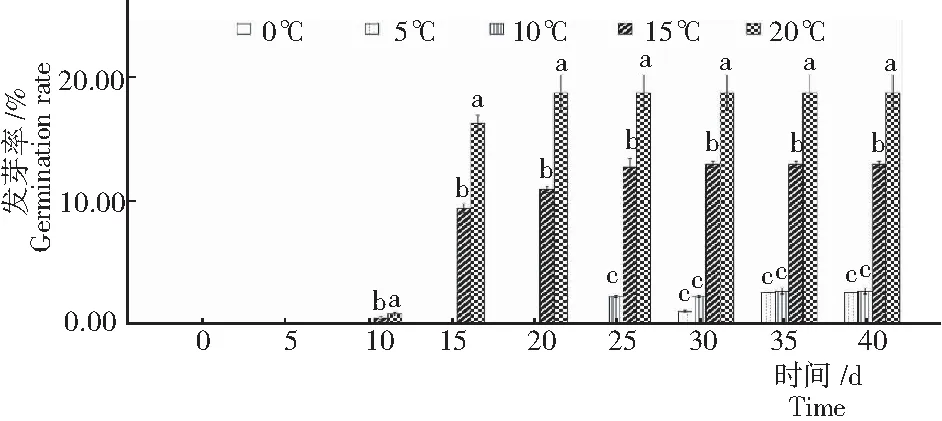
2.1 不同温度全缘叶绿绒蒿种子的萌发率
由图1可知,随着温度的升高,全缘叶绿绒蒿种子的萌发率也随之升高。在20℃时种子萌发率最高,为18.8%;5℃和10℃温度下,有少量的种子萌发,且显著低于15℃和20℃处理。同时,15℃和20℃处理下的种子也比5℃和10℃条件下种子早萌发10~15 d,也更早到达发芽率上限。虽然20℃处理下种子发芽率最高,但在整个发芽过程中发现,20℃处理下萌发的种子易伴有烂根现象。由此说明,温度是影响全缘叶绿绒蒿种子发芽的重要因素。此外,0℃处理40 d,全缘叶绿绒蒿种子均没有萌发,说明低温对该种植物种子的萌发有抑制作用。
注:图中不同小写字母表示差异显著(P<0.05)(下同)。
Note: Different lowercase letters indicated significant difference atP<0.05. The same below.
图 1 不同温度处理下全缘叶绿绒蒿种子的发芽率
Fig.1 Germination rate ofM.integrifoliaunder different temperature
2.2 全缘叶绿绒蒿种子萌发过程中淀粉酶及抗氧化物酶的活性
由图2可知不同温度处理下全缘叶绿绒蒿种子萌发过程中淀粉酶、POD、SOD及AT的活性变化。
1)淀粉酶。在种子萌发过程中起重要作用,其活性的高低直接反映种子代谢水平。淀粉酶在种子萌发过程中对淀粉的水解起主要作用,特别是在萌发初期以α-淀粉酶的作用最为明显[8]。全缘叶绿绒蒿的种子萌发过程中,在0~20℃,淀粉酶活性基本保持先迅速上升后迅速下降的变化趋势。方差分析可知,不同温度对淀粉酶活性影响显著。在0~20℃,5 d时,除0℃外,淀粉酶活性均升至最大峰值,温度越高,峰值越大,20℃条件下上升至0.281 mg/(g·min);5 d后5~20 ℃条件下淀粉酶活性均开始不同程度下降,温度越高,下降幅度越大;15 d时20℃处理的种子淀粉酶活性已迅速降至0.032 mg/(g·min),此后基本维持在该值。与之相比, 5℃处理下种子淀粉酶活性先缓慢下降,20 d后开始迅速下降,25 d时降至0.021 mg/(g·min)。0℃作为特殊的处理条件,从种子放入培养皿后,水就以固液混合体的形式存在,这不利于种子对水分的吸收,在这种极端条件下淀粉酶活性变化幅度也较大,10 d时淀粉酶活性上升至0.157 mg/(g·min),10 d后迅速下降,20 d后淀粉酶活性在0.036 mg/(g·min)左右。
2) POD。POD与植物细胞的生长及分化密切相关,其活性变化反映了细胞的生长情况[9]。在种子萌发过程中,POD影响内源激素水平,参与结构分子的合成调节,从而对细胞分化起到重要作用。POD活性伴随温度的升高而逐渐增强,20℃处理30 d时,POD活性不变。在萌发启动至5 d时,POD呈上升趋势,此阶段温度对POD活性影响显著;5 d后10~20℃处理种子POD活性逐渐下降,温度越高越早达POD活性峰值;20℃处理下25 d时达POD活性的峰值471 U/(g·min),25 d后开始下降;15℃处理下种子POD活性从20 d后迅速增强,30 d时活性达峰值984 U/(g·min);10℃处理下30 d时POD活性开始迅速增强, 35 d时升至228 U/(g·min)后开始下降。各温度下POD活性变化趋势相似,即在胚根尚未突破种皮前POD活性上升缓慢,随着种子萌发率的增高POD活性亦迅速升高,待种子基本完成萌发其POD活性呈下降趋势,萌发完成后呈下降趋势。说明,在全缘叶绿绒蒿种子萌发过程中启用参与活性氧代谢的POD比萌发完成后参与其他功能的POD过量[10]。
经方差分析,全缘叶绿绒蒿种子萌发过程中不同温度对POD活性影响显著。5℃与0℃处理下的种子POD活性变化趋势最为接近,差异不显著。
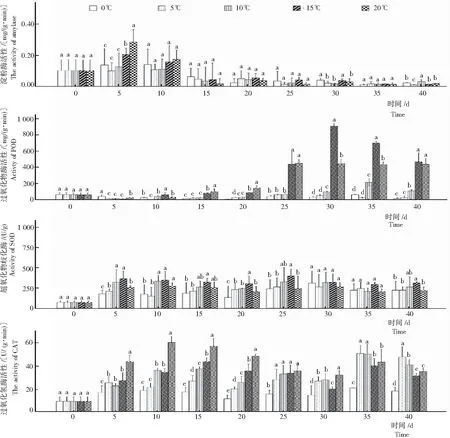
图2 不同温度下全缘叶绿绒蒿种子萌发过程中淀粉酶及抗氧化物酶的活性变化
15℃和20℃处理与其他温度下的POD活性均差异显著。
3) SOD。植物细胞中的SOD可以将细胞内积累的有毒物质清除,以保护膜系统不受自由基的伤害。经方差分析,全缘叶绿绒蒿种子萌发过程中不同温度条件对SOD活性影响显著。各温度处理下,种子SOD活性的变化趋势相近,萌发开始时SOD活性迅速增强,于5 ~10 d时上升至第1个峰值后下降,于25 d时再次上升至第2个峰值而后再次下降,如此反复使SOD活性维持在一个较高水平。从萌发初期开始,除20℃外,其余各温度下SOD活性均与温度高低成正比。与POD活性变化不同,各时间段SOD活性均与温度相关。
4) CAT。CAT作为种子中重要的保护酶之一,是氧自由基的清除剂,在种子萌发过程中对细胞膜起到保护作用。CAT普遍存在于植物的所有细胞与组织中,其活性与植物代谢强度、抗病及抗旱能力有关,CAT的增加对种子休眠的解除具有极其重要的意义[11]。种子萌发初期,CAT活性迅速上升,温度越高其活性上升速度越快。20℃条件下种子萌发至10 d时CAT升至峰值58.625 U/(g·min),15℃条件下在15 d时上升至峰值44.625 U/(g·min),20℃和15℃处理下,种子的CAT在达到峰值后开始下降。而5℃和10℃条件下,种子的CAT活性于初期迅速上升至较高值,之后稳定一段时间,在到达发芽率最高前5 d时开始迅速上升,并在发芽率最高时间(35 d)时最强,之后开始迅速下降。0℃条件下种子CAT活性出现反复波动。不同时间段,20℃处理下的全缘叶绿绒蒿种子CAT活性与其他温度处理的差异显著,0℃处理下种子CAT活性最低。
3 结论与讨论
3.1 全缘叶绿绒蒿萌发过程中淀粉酶活性的变化
种子萌发期间需要的养料和能源的主要来源是自身储藏物质的利用与转化,淀粉和脂肪的分解为种子萌发提供主要的能量和碳。全缘叶绿绒蒿种子在萌发前期淀粉酶的活性高且变化幅度大,表明种子萌发前期的代谢活性较高。在高原极端环境下全缘叶绿绒蒿种子通过短时间内迅速分解胚乳中养分,提供大量能量以保证种子萌发。试验结果表明,全缘叶绿绒蒿种子萌发过程中的淀粉酶活性受不同温度的影响显著(P<0.05),温度越高淀粉酶活性变化越大。全缘叶绿绒蒿淀粉酶活性较低,与低海拔地区植物种子萌发时淀粉酶逐渐上升的趋势不同,全缘叶绿绒蒿淀粉酶活性于萌发前期迅速上升,并在萌发过程中不断被消耗。这种生殖投资策略有助于全缘叶绿绒蒿应对严苛的高山环境,使其较好选择适宜繁殖的时机,但亦伴随着较高的繁殖风险。
3.2 全缘叶绿绒蒿种子萌发过程中抗氧化酶活性的变化
随着生物膜理论的发展和技术的进步,衰老与膜间的关系受到人们的重视,而在各项理论中膜脂过氧光氧化成为最具说服力的理论。大量研究表明,植物在逆境胁迫和衰老过程中,细胞内自由基的平衡被破坏从而有利于自由基的产生,过剩的自由基引发或加剧膜脂过氧化,造成膜系统的损伤,严重时会导致植物细胞死亡[12]。自由基一方面供给其他脂肪酸和蛋白质分子,另一方面自身进一步氧化为最终产物丙二醛(MDA)、碳氢化合物及挥发性醛类,而这些最终产物又会毒害细胞膜系统、蛋白质和DNA,最终导致细胞膜的降解和细胞功能的丧失[13-16]。试验结果表明,温度差异对POD、SOD和CAT活性变化的影响显著(P<0.05),且随温度升高抗氧化酶活性升高和变化幅度增大。说明,在0~20℃,随着温度的升高,全缘叶绿绒蒿种子抵抗逆境胁迫的能力越强。
POD活性在到达种子最大发芽率时开始大幅度上升,说明萌发完成后除参与活性氧的代谢外,其他功能亦需要POD的参与[10]。各温度下接近发芽率最高时,SOD活性降至谷底,说明参与萌发过程的SOD比完成萌发后参与其他功能的SOD活性高,萌发过程中将SOD活性维持在较高水平有利于种子抗逆性,以对抗不利环境。由于SOD活性的维持不具有持续性,且与温度和发芽速度无关,这种间断的折线形升降可能是种子对恶劣环境的一种风险平摊机制,牺牲部分能量从而保证萌发过程中的种子活性。CAT活性在胚根突破种皮前缓慢增强,待发芽率最高时,CAT活性亦达到峰值。与大部分低海拔植物相比[17],全缘叶绿绒蒿种子在萌发过程中抗氧化酶总活性较高,这反应了其在极端环境下保证发芽率的一种适应策略。
3.3 不同温度下全缘叶绿绒蒿种子的萌发情况
全缘叶绿绒蒿种子萌发属于缓萌型。恶劣的高原环境下,大多数物种通过选择较低的萌发率来避免环境骤变而导致的死亡风险[18]。大多数植物种子的这种试探性萌发,在萌发策略上表现为萌发方式的风险分担,这减少了随机性灾害导致的物种灭绝,具有相对更高的适合度[19],是对高寒气候适应的必然结果[20]。
试验结果表明,在0~20℃(0℃除外),全缘叶绿绒蒿种子均有种子萌发。这种具有较宽萌发温幅、在较低温度下仍具有相对较高萌发率的现象是罂粟科植物面对高海拔多变的环境条件而进化出的萌发策略[1,21]。在该温度范围内,温度越高发芽率越高,发芽速度也越快。15~20℃处理下,全缘叶绿绒蒿种子萌发效果较好,20℃条件下最为理想,20℃亦被认为是全缘绿绒蒿种子的最理想萌发温度。与石慧珍[1]关于全缘叶绿绒蒿及其他绿绒蒿种子需要在较低温度下萌发的研究结果存在差异,这可能是采样地点、海拔高度不同所致。
[1] 石慧珍,刘明霞,许 静,等.青藏高原高寒草甸罂粟科植物种子萌发特性研究[J].西北植物学报,2008,28(9):1880-1884.
[2] 任祝三.昆明气候条件对于绿绒蒿属幼苗生长的影响[J].云南植物研究,1993,15(1):110-112.
[3] 云南省植物研究所.云南植物志:第2卷[M].北京市:科学出版社,1979.
[4] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[5] 周金燕,张发群,舒远才.愈创木酚法测定锰过氧化物酶活力[J].纤维素科学与技术,1993(1):34-37.
[6] 孙 群,胡景江.植物生理学研究技术[M].杨凌:西北农林科技大学出版社,2006.
[7] 杨兰芳,庞 静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009,20:364-366.
[8] 杨煜峰,施天生,陆定志.杂交水稻萌发种子淀粉酶活性和GA3的调节[J].中国农业科学,1990,23(6):27-34.
[9] 王明祖,何生根,杨 遥.菜豆种子萌发过程中多胺氧化酶和过氧化物酶活性变化[J].农业与技术,2003,23(4):62-66.
[10] 田国忠,李怀方,裘维蕃.植物过氧化物酶研究进展[J].武汉植物学研究,2001,19(4):332-344.
[11] 谷建田,范双喜,宋学锋,等.番茄种子衰老过程中过氧化氢酶(CAT)活性变化[J].华北农学报,1998,13(2):112-116.
[12] 周 虹,范巧佳,郑顺林,等.春季水分胁迫对川芎叶片相对含水量及保护酶活性的影响[J].中国中药杂志,2009,34(2):132-137.
[13] 简志英,陆嘉陵,蒋瑞君.温度对赤霉素诱导α-淀粉酶的影响[J].植物生理学通讯,1989(5):44-46.
[14] 朱世东,裴孝伯,张志伟.香椿种子衰老机理[J].安徽农业科学,1999,27(1):62-63.
[15] Harman G E.Mattick L R. Association of Lipid oxidation with seed aging and death[J].Nature, 1976,260:323-324.
[16] 安 娜,朱 艳,崔秀明,等.三七种子后熟期生理生化的动态研究Ⅲ.不同贮藏条件下种子酶活性分析[J].西南农业学报,2010,23(5):1477-1480.
[17] 郝 晶,张立军,谢甫绨.低温对大豆不同耐冷性中萌发期保护酶活性的影响[J].大豆科学,2007,26(2):171-175.
[18] 吕俊平,张春辉,张 蕾,等.光照及种子大小对青藏高原东缘43种石竹目植物种子萌发特征的影响[J].兰州大学学报:自然科学版,2011,47(5):77-82.
[19] 徐秀丽,齐 威,卜海燕,等.青藏高原高寒草甸40种一年生植物种子的萌发特性研究[J].草业学报,2007,16(3):74-80.
[20] 崔现亮,陈 文,陶 川,等.青藏高原东缘11种小檗属(Berberis)植物种子萌发特性[J].生态学杂志,2010,29(8):31-36.
[21] 孙 坤,吕小旭,苏 雪,等.不同温度下中国沙棘种子的萌发策略[J].西北师范大学学报:自然科学版,2012,48(3):86-89.
(责任编辑: 孙小岚)
Effect of Different Temperature on Seed Germination and Anti-oxidant Enzyme Activity ofMeconopsisintegrifolia
LIAO Jiemin1,2, QIN Lina1,2, PENG Han1, WU Yun1,2, LIU Guangli1*
(1.CollegeofLandscapeArchitecture,SichuanAgriculturalUniversity,Chengdu,Sichuan611130; 2.GraduateUniversity,SichuanAgriculturalUniversity,Chengdu,Sichuan611130,China)
To further explore the physiological property ofM.integrifolia, and provide guidance for introduction and domestication ofMeconopsisplants in later period, taking the mature seeds ofM.integrifoliaas the experimental material. After temperature stratification, the seeds were placed in the condition of constant temperature including 0℃, 5℃, 10℃, 15℃ and 20℃. The authors measured the germination rate and the changes of enzyme activity. Results:M.integrifoliaseeds germinated in varying degrees except 0℃, 20℃ was of the highest germination rate(18.8%). Activity of amylase was higher in early stage, but activity of POD, SOD and CAT were higher in the middle and late stage, the peak values of which were respectively 471 U/(g·min), 262.5 U/(g·min) and 44.625 U/(g·min). Temperature had significant effects on the activity of amylase, POD, SOD and CAT. In the range of 0~20℃, the higher the temperature, the stronger the seed germination ability.
Meconopsisintegrifolia; seed germination; germination percentage; enzyme activity; temperature
2015-10-29; 2016-05-11修回
国家自然科学基金项目“两性花植物个体大小依赖的性分配:假说和实验论证”(31370436)
廖捷敏(1988-),女,在读硕士,研究方向:园林植物栽培应用。E-mail: 179561039@qq.com
*通讯作者:刘光立(1976-),副教授,博士,从事园林植物栽培应用及野生植物资源保护与利用研究。E-mail:liugl_@163.com
1001-3601(2016)06-0237-0017-04
S567.21
A
生理生化·耕作栽培
Physiology and Biochemistry·Tillage and Cultivation

