艾灸对EAT大鼠甲状腺功能及其IL-17、IL-23表达影响的研究
崔云华 雷 菲 赵继梦 吴焕淦 徐惠芬 吴人照 何金森余曙光 黄 艳 吴璐一 刘世敏 胡 玲 刘慧荣
(1 上海中医药大学上海市针灸经络研究所,上海,200030; 2 浙江省湖州市中医院,湖州,313000; 3 浙江省中医药研究院,杭州,310007; 4 上海中医药大学,上海,201203; 5 成都中医药大学,成都,611137; 6 安徽中医药大学,合肥,230038)
艾灸对EAT大鼠甲状腺功能及其IL-17、IL-23表达影响的研究
崔云华1雷 菲1赵继梦1吴焕淦1徐惠芬2吴人照3何金森4余曙光5黄 艳1吴璐一4刘世敏4胡 玲6刘慧荣1
(1 上海中医药大学上海市针灸经络研究所,上海,200030; 2 浙江省湖州市中医院,湖州,313000; 3 浙江省中医药研究院,杭州,310007; 4 上海中医药大学,上海,201203; 5 成都中医药大学,成都,611137; 6 安徽中医药大学,合肥,230038)
目的:观察艾灸干预实验性自身免疫性甲状腺炎(EAT)大鼠的效应,以及对炎性细胞因子IL-17、IL-23及受体表达的影响,拟阐释艾灸干预EAT的作用机制。方法:将SD大鼠随机分成5组:正常组、模型组、优甲乐组、隔附子饼灸组和温和灸组。采用碘剂和猪甲状腺球蛋白联合免疫的方法建立EAT动物模型,艾灸和西药各干预30 d。观察甲状腺组织形态学、血清抗甲状腺球蛋白抗体(TGAb)和抗甲状腺过氧化物酶抗体(TPOAb)、IL-17、IL-23和IL-23R的浓度;甲状腺组织IL-17、IL-23和IL-23R mRNA表达。结果:隔附子饼灸、温和灸和优甲乐均能纠正EAT大鼠甲状腺的组织病理学改变。与正常组比较,模型组大鼠血清FT3下降(P<0.01),血清TSH、TGAb、TPOAb浓度升高(P<0.05),血清IL-17、IL-23和IL-23R蛋白的浓度升高(P<0.05);甲状腺组织IL-17、IL-23和IL-23R mRNA的表达上调(P<0.05)。与模型组比较,优甲乐组血清FT3升高(P<0.01),TPOAb、IL-23R浓度降低(P<0.05);隔附子饼灸组大鼠血清FT3升高(P<0.01),血清TSH、TGAb、TPOAb、IL-17、IL-23和IL-23R浓度降低(P<0.05),甲状腺组织IL-17、IL-23和IL-23R mRNA表达下降(P<0.05);温和灸组大鼠血清TSH、TGAb、TPOAb、IL-17和IL-23浓度降低(P<0.05);血清IL-17、IL-23的浓度,甲状腺组织IL-17、IL-23、IL-23R mRNA的表达水平和血清中TGAb的浓度呈正相关关系;血清中IL-17、IL-23、IL-23R的浓度,甲状腺组织中IL-17 mRNA的表达水平与血清中TPOAb的浓度呈正相关关系。结论:隔附子饼灸、温和灸均能有效纠正EAT大鼠甲状腺组织病理学的变化,改善EAT大鼠的甲状腺功能,降低甲状腺自身抗体水平,可能与调节炎性细胞因子IL-17和IL-23的表达有关。
实验性自身免疫性甲状腺炎;艾灸;白细胞介素-17;白细胞介素-23;机制
桥本甲状腺炎(Hashimoto′s Thyroiditis,HT)是一种临床上常见的自身免疫性甲状腺疾病,其病理特征主要表现为甲状腺腺体肿大,腺体内出现大量的淋巴细胞,患者血清中甲状腺自身抗体阳性[1]。临床表现为青中年女性甲状腺无痛性弥漫性肿大[2]。随着病情的发展甲状腺功能失常,与自身免疫性疾病相关,是癌变的危险因素[3-5]。目前本病的治疗主要是甲状腺激素替代疗法,甲状腺肿大明显的可手术治疗[6],但复发率高[7]。因此,探讨治疗HT的安全有效的方法成为目前研究工作的热点。据其临床表现当属“瘿病”范畴,以脾肾阳虚型为主,治当温阳健脾、调补肝肾[8]。现代研究证实艾灸可改善机体的免疫功能[9],隔附子饼灸能有效改善HT患者的症状,调节患者血清中甲状腺自身抗体的浓度,提高患者的生活质量[10-15]。徐惠芬观察隔药饼灸加左旋甲状腺素钠对本病的疗效,总有效率从单用药物的75.86%提高到86.67%[16]。
本研究采用采用碘剂加抗原免疫联合诱导的方法,建立实验性自身免疫性甲状腺炎(EAT)大鼠模型[17-18],探讨艾灸对炎性细胞因子IL-17、IL-23、IL-23R表达的影响,对炎性细胞因子与甲状腺自身抗体TGAb、TPOAb浓度的相关性进行分析。
1 材料与方法
1.1 实验动物 体重为(100±20)g的清洁级SD大鼠42只,性别为雌性。动物来源于上海斯莱克实验动物有限公司。饲养于上海中医药大学实验动物中心。饲养环境:12 h昼夜节律交替,室温(20±2)℃,室内湿度50%~70%。所有动物用标准饲料、清洁饮用水适应性饲养1周后开始实验。
1.2 主要试剂与仪器 猪甲状腺球蛋白(PTg)、完全弗氏佐剂(CFA);不完全弗氏佐剂(IFA)、碘化钠均购自Sigma公司;左甲状腺素钠片(优甲乐® Euthyrox®50 μg),德国Merk KGaA生产;淡附子粉由上海市针灸经络研究所医疗门诊部中药房提供;大鼠专用线艾条购自河南南阳汉医艾绒制品厂;FT3、FT4、TSH、TPO-Ab、TGAb、大鼠IL-17、IL-23、IL-23R、IL-6均购自上海酶联生物科技有限公司;低温台式高速离心机,Thermo;全自动组织脱水机,Leica;多功能酶标仪(BioTek)NANODROP,Thermo;ABI ViiA 7 Real Time PCR System,Applied Biosystems。
1.3 实验方法
1.3.1 EAT动物模型建立[17-18]所有动物用标准饲料、清洁饮用水适应性饲养1周后随机分为正常大鼠(n=9)和造模大鼠(n=33)。将PTg用PBS按(2 mg/mL)的比例稀释,取稀释后的PTg与CFA或IFA等体积混合充分乳化。造模大鼠于实验第1天接受初次免疫:在大鼠两后肢足垫部皮下多点注射经CFA乳化的PTg100 μL/只。加强免疫:取PTg100 μg/只+IFA等体积乳化,分别于实验第14天、第21天、第28天在大鼠两后肢足垫部、两后肢内侧以及背部皮下多点注射。正常大鼠在造模大鼠免疫的同时也注射等量生理盐水做对照。正常大鼠仅予以清洁饮用水喂养,造模大鼠给予高碘水(含碘化钠500 mg/L)喂养,碘水现配现用,避光保存。
1.3.2 干预方法 造模大鼠造模结束后,从正常大鼠、造模大鼠中各随机选取1只,摘取甲状腺组织并做病理切片,观察甲状腺组织形态学变化以确定造模是否成功。鉴定模型成功后,将造模大鼠随机分为4组:模型组(n=8)、优甲乐组(n=8)、隔附子饼灸组(n=8)以及温和灸组(n=8)。见图1~图4。
优甲乐组:用优甲乐悬浊液(1 μg/2 mL)灌胃,每只2.25 μg/(kg·d),1次/d,共治疗30 d。
隔附子饼灸组:大鼠剃毛,暴露穴位处皮肤,固定于大鼠固定架上,采用隔附子饼灸。将附子切细研末,以黄酒调和做饼,厚约0.5 cm,直径约1 cm,上置大约90 mg艾炷施灸,取2组穴位:1)大椎、命门;2)天突、关元,每日取1组穴位,每次每穴灸2壮,2组穴位交替轮流施灸,1次/d,共灸30 d。
温和灸组:大鼠剃毛,暴露穴位处皮肤,固定于大鼠固定架上,采用大鼠专用线艾条(直径0.4 cm,长12 cm)2 g,以距离穴位3~5 cm的距离温和灸,取穴:1)大椎、命门;2)天突、关元2组穴位,每日取1组穴位,2组穴位交替轮流施灸,1次/d,共灸30 d。
正常组、模型组、隔附子饼灸组和温和灸组大鼠在优甲乐组大鼠灌胃的同时也给予等量的蒸馏水灌胃,正常组、模型组和优甲乐组做与隔附子饼灸组同样的抓取固定。

图1 温和灸大椎、命门穴 图2 温和灸天突、关元穴
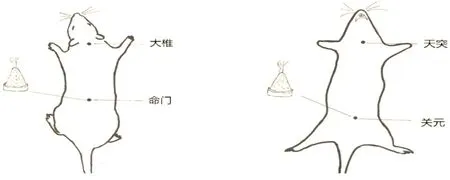
图3 隔附子饼灸大椎、 图4 隔附子饼灸天突、
1.3.3 标本的采集及观察指标 各组大鼠于治疗结束后禁食不禁水12 h,予以2%戊巴比妥钠(30~50 mg/kg)腹腔注射麻醉,腹主动脉取血,分离血清置于-20 ℃冰箱待测;分离甲状腺,部分4%的福尔马林固定,部分-80 ℃冻存待测。
HE染色观察甲状腺组织形态学变化;双抗体夹心酶联免疫吸附(ELISA)法检测大鼠血清中FT3、FT4、TSH、TGAb、TPOAb、IL-17、IL-23和IL-23R的浓度;实时荧光定量PCR(qRT-PCR)法检测甲状腺组织中IL-17A、IL-23和IL-23R mRNA的表达。

2 结果
2.1 甲状腺组织形态学观察 HE染色后,光镜下观察观察甲状腺滤泡大小、滤泡上皮细胞的形态、滤泡上皮及滤泡间淋巴细胞的浸润程度,进行甲状腺滤泡结构改变分级和淋巴细胞浸润强度分级分析。
2.1.1 甲状腺滤泡结构改变分级[19-20]分4级。0级:甲状腺滤泡结构正常;1级:甲状腺滤泡出现灶性紊乱;2级:甲状腺滤泡出现中等程度破坏;3级:甲状腺滤泡出现弥漫性损害。
2.1.2 淋巴细胞浸润强度分级 分4级。0级:没有淋巴细胞浸润;1级:有少量的淋巴细胞浸润;2级:出现多部位小范围的淋巴细胞浸润;3级:出现弥漫性淋巴细胞浸润。甲状腺病变程度=甲状腺滤泡结构改变程度+淋巴细胞浸润程度。具体观察结果如下。
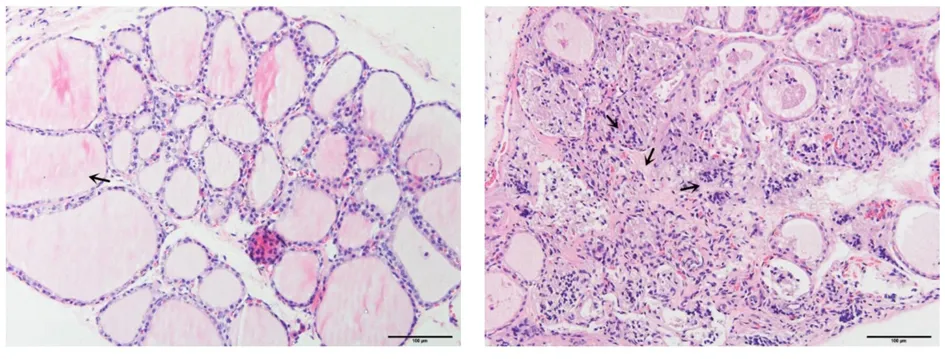

图5正常组(HE染色,×200)图6模型组(HE染色,×200) 注:甲状腺滤泡呈圆形或椭圆形,大小适中,滤泡上皮细胞呈低柱状,滤泡腔内充满胶质,未见淋巴细胞浸润。 注:大量滤泡破坏,大量淋巴细胞浸润,间质大量纤维组织增生。
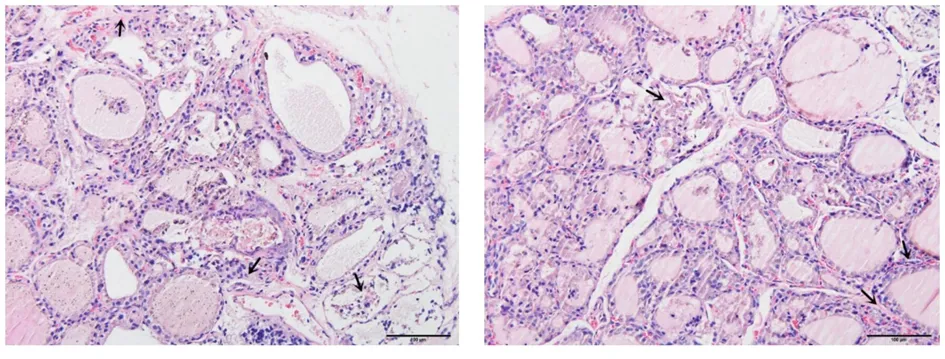

图7 优甲乐组(HE染色,×200)图8 隔附子饼灸组(HE染色,×200) 注:部分滤泡破坏,少量淋巴细胞浸润,少量纤维组织增生。 注:少量滤泡破坏消失,间质少量淋巴细胞浸润,少量纤维组织增生。
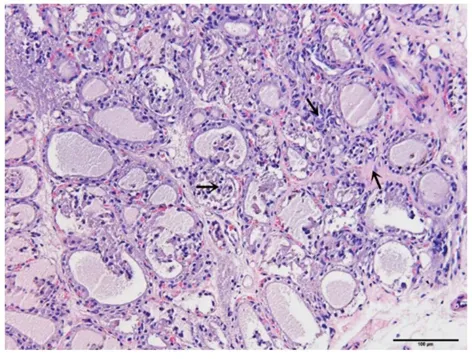
图9 温和灸组(HE染色,×200)
注:少量滤泡破坏,滤泡结构不完整,少量淋巴细胞浸润,少量纤维组织增生。
经统计学分析发现各组大鼠甲状腺滤泡结构改变比较有统计学意义(H=23.316,P<0.01),与正常组比较,模型组大鼠甲状腺滤泡破坏比正常组严重,差异有统计学意义(P<0.01);与模型组比较,隔附子饼灸组、温和灸组大鼠甲状腺滤泡结构改善,差异有统计学意义(P值分别为0.01、0.04,P<0.05)。见表1。
各组大鼠淋巴细胞浸润程度比较有统计学意义(H=27.946,P<0.01),与正常组比较,模型组的大鼠甲状腺组织淋巴细胞浸润程度比正常组严重,差异有统计学意义(P<0.01);与模型组比较,隔附子饼灸组、温和灸组大鼠甲状腺组织中淋巴细胞浸润程度改善,差异有统计学意义(P值分别为0.02、0.04,P<0.05)。见表1。
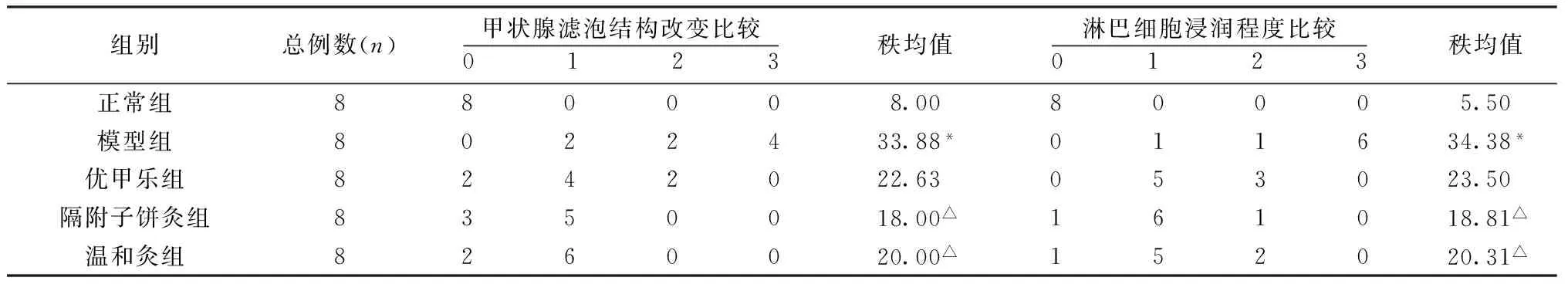
表1 各组甲状腺组织形态学比较
注:与正常组比较,*P<0.01;与模型组比较,△P<0.05。
2.2 各组大鼠血清中FT3、FT4和TSH浓度的比较
各组大鼠血清中FT3的浓度比较差异有统计学意义(F=10.819,P<0.01)。与正常组比较,模型组大鼠血清中的FT3浓度下降,差异有统计学意义(P<0.01)。与模型组比较,优甲乐组、隔附子饼灸组大鼠血清中FT3浓度升高,差异有统计学意义(P均<0.01)。与优甲乐组比较,隔附子饼灸组大鼠血清中FT3浓度升高,但差异无统计学意义(P=0.167,P>0.05)。见图10。
各组大鼠血清中FT4的浓度比较差异无统计学意义(F=0.684,P=0.608,P>0.05)。见图11。
各组大鼠血清中TSH的浓度比较差异有统计学意义(F=12.018,P<0.01)。与正常组比较,模型组大鼠血清中TSH浓度升高,差异有统计学意义(P<0.01)。与模型组比较,优甲乐组、隔附子饼灸组、温和灸组大鼠血清中TSH浓度下降,差异有统计学意义(P均<0.01)。与优甲乐组比较,隔附子饼灸组大鼠血清中TSH浓度下降,差异有统计学意义(P=0.009,P<0.01),温和灸组大鼠血清中TSH浓度下降,差异无统计学意义(P=0.423,P>0.05)。与隔附子饼灸组比较,温和灸组大鼠TSH浓度升高,但差异无统计学意义(P=0.06,P>0.05)。见图12。
2.3 各组大鼠血清中TGAb和TPOAb浓度的比较
各组大鼠血清中TGAb的浓度比较差异有统计学意义(F=9.533,P<0.01)。与正常组比较,模型组大鼠血清中TGAb浓度升高,差异有统计学意义(P=0.019,P<0.05)。与模型组比较,优甲乐组大鼠血清中TGAb浓度降低,但差异无统计学意义(P=0.982,P>0.05),隔附子饼灸组、温和灸组大鼠血清中TGAb浓度降低,差异有统计学意义(P值分别为0.017、0.025,P<0.05)。与隔附子饼灸组比较,温和灸组大鼠血清中TGAb浓度升高,但差异无统计学意义(P=0.993,P>0.05)。见图13。
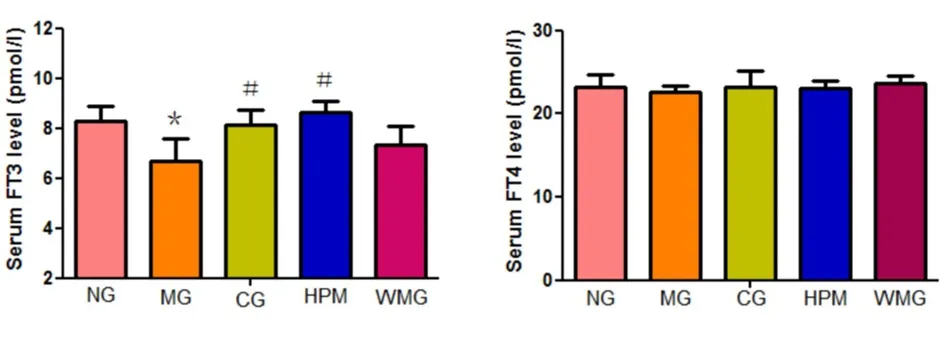

图10 各组大鼠血清FT3水平比较图11 各组大鼠血清FT4水平比较 注:与正常组比较,*P<0.01;与模型组比较,#P<0.01。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。 注:注:各组比较P均>0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
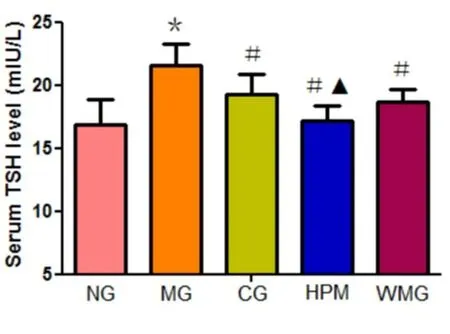
图12 各组大鼠血清TSH水平比较
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01;与优甲乐组比较,▲P<0.01。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
各组大鼠血清中TPOAb的浓度比较差异有统计学意义(F=6.786,P<0.01)。与正常组比较,模型组大鼠血清中TPOAb浓度升高,差异有统计学意义(P<0.01)。与模型组比较,优甲乐组、隔附子饼灸组、温和灸组大鼠血清中TPOAb浓度下降,差异有统计学意义(P均<0.01)。与优甲乐组比较,隔附子饼灸组大鼠血清中TPOAb浓度下降,差异有统计学意义(P=0.033,P<0.05),温和灸组大鼠血清中TPOAb浓度下降,差异无统计学意义(P=0.305,P>0.05)。与隔附子饼灸组比较,温和灸组大鼠TPOAb浓度升高,但差异无统计学意义(P=0.247,P>0.05)。见图14。
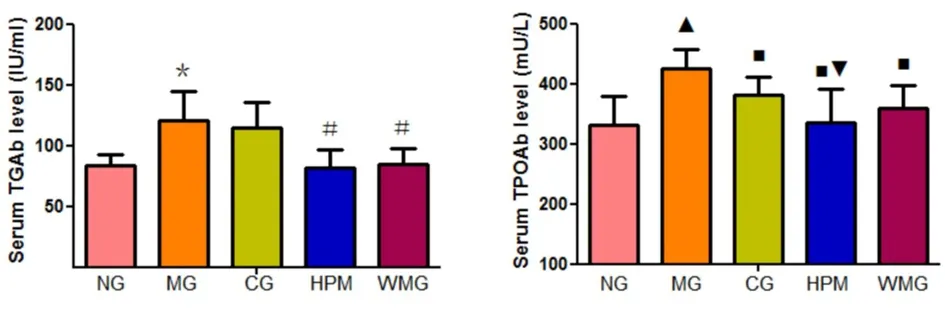

图13 各组大鼠血清TGAb水平比较图14 各组大鼠血清TPOAb水平比较 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。 注:与正常组比较,▲P<0.01;与模型组比较,■P<0.01;与优甲乐组比较,▼P<0.05。
2.4 各组大鼠血清中IL-17、IL-23和IL-23R浓度的检测结果 各组大鼠血清中IL-17浓度的比较差异有统计学意义(F=24.178,P<0.01)。与正常组比较,模型组大鼠血清中IL-17浓度升高,差异有统计学意义(P<0.01)。与模型组比较,隔附子饼灸组、温和灸组大鼠血清中IL-17浓度降低,差异有统计学意义(P均<0.01)。与隔附子饼灸组比较,温和灸组IL-17升高,差异有统计学意义(P=0.013,P<0.05)。见图15。
各组大鼠血清中IL-23R浓度的比较差异有统计学意义(F=4.301,P=0.006,P<0.01)。与正常组比较,模型组大鼠血清中IL-23R浓度升高,差异有统计学意义(P<0.01)。与模型组比较,优甲乐组、隔附子饼灸组大鼠血清中IL-23R浓度降低,差异有统计学意义(P值分别为0.039、0.003,P<0.05)。与优甲乐组比较,隔附子饼灸组大鼠血清中IL-23R浓度降低,但差异无统计学意义(P=0.29,P>0.05)。见图16。
各组大鼠血清中IL-23浓度的比较差异有统计学意义(H=14.370,P=0.006,P<0.01)。与正常组比较,模型组大鼠血清中IL-23浓度升高,差异有统计学意义(P<0.01)。与模型组比较,隔附子饼灸组、温和灸大鼠血清中IL-23R浓度降低,差异有统计学意义(P值分别为0.02、0.03,P<0.05)。与隔附子饼灸组比较,温和灸组大鼠血清中IL-23浓度下降,但差异无统计学意义(P=0.98,P>0.05)。见图17。
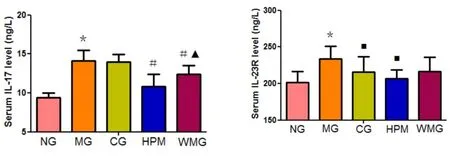

图15 各组大鼠血清IL-17水平比较图16 各组大鼠血清IL-23R水平比较 注:与正常组比较,*P<0.01;与模型组比较,#P<0.01;与隔附子饼灸比较,▲P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。 注:与正常组比较,*P<0.01;与模型组比较,■P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
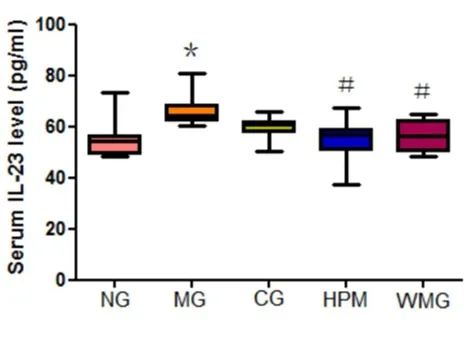
图17 各组大鼠血清IL-23水平比较
注:与正常组比较,*P<0.01;与模型组比较,#P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
2.5 各组大鼠血清中IL-17、IL-23、IL-23R的浓度和血清自身抗体水平的相关性分析 对各组大鼠血清中IL-17、IL-23、IL-23R的浓度与其自身抗体水平进行相关性分析,结果发现IL-17、IL-23的浓度均和TGAb、TPOAb水平存在正相关关系(r值分别为0.634、0.511、0.415、0.474,P均<0.05)。见图18,图19,图20,图21;IL-23R浓度和TPOAb水平存在正相关关系(r=0.355,P=0.025)。见图22。与TGAb水平存在正相关趋势,但差异无统计学意义(r=0.112,P=0.493)。
2.6 各组大鼠甲状腺组织中IL-17、IL-23和IL-23R mRNA表达水平的检测结果 各组大鼠甲状腺组织中IL-17 mRNA表达水平比较差异有统计学意义(H=15.368,P=0.004,P<0.01)。与正常组比较,模型组大鼠甲状腺组织中IL-17 mRNA表达水平增高,差异有统计学意义(P<0.01)。与模型组比较,隔附子饼灸组大鼠甲状腺组织中IL-17 mRNA表达水平下降,差异有统计学意义(P=0.03,P<0.01)。见图23。
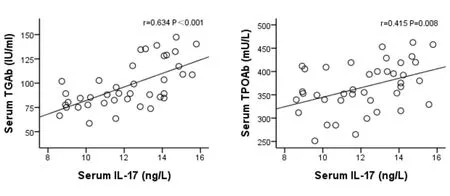
图18 血清中IL-17和 图19 血清中IL-17和
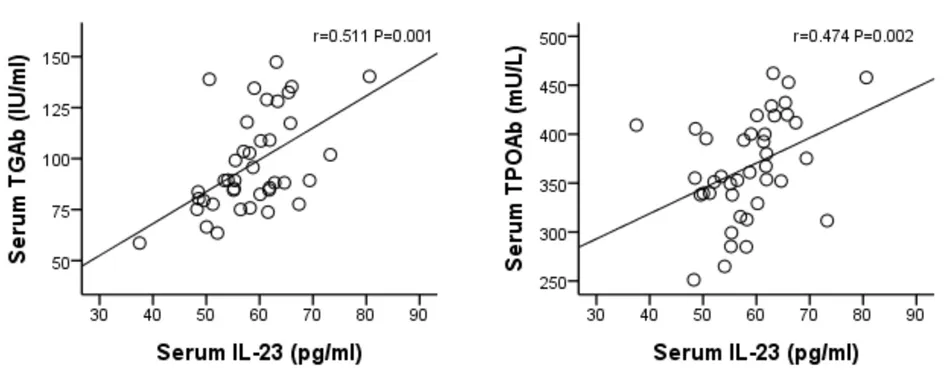
图20 血清IL-23和 图21 血清IL-23和
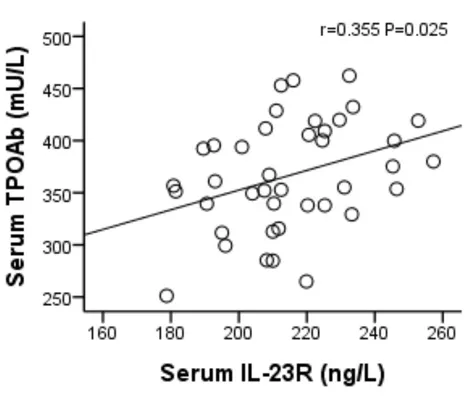
图22 血清IL-23R和TPOAb相关性
各组大鼠甲状腺组织中IL-23R mRNA表达水平比较差异有统计学意义(H=12.684,P=0.013,P<0.05)。与正常组比较,模型组大鼠甲状腺组织中IL-23R mRNA表达水平增高,差异有统计学意义(P=0.01,P<0.05)。与模型组比较,隔附子饼灸组大鼠甲状腺组织中IL-23R mRNA表达水平下降,差异有统计学意义(P=0.02,P<0.05);优甲乐组、温和灸组大鼠甲状腺组织中IL-23R mRNA表达水平下降,差异无统计学意义(P值分别为0.52、0.26,P>0.05)。见图24。
与正常组比较,模型组大鼠甲状腺组织中IL-23 mRNA表达水平升高,差异有统计学意义(P=0.013,P<0.05)。与模型组比较,隔附子饼灸组大鼠甲状腺组织中IL-23 mRNA表达水平下降,差异有统计学意义(P=0.043,P<0.05);优甲乐组、温和灸组大鼠甲状腺组织中IL-23 mRNA表达水平下降,差异无统计学意义(P值分别为0.672、0.258,P>0.05)。见图25。
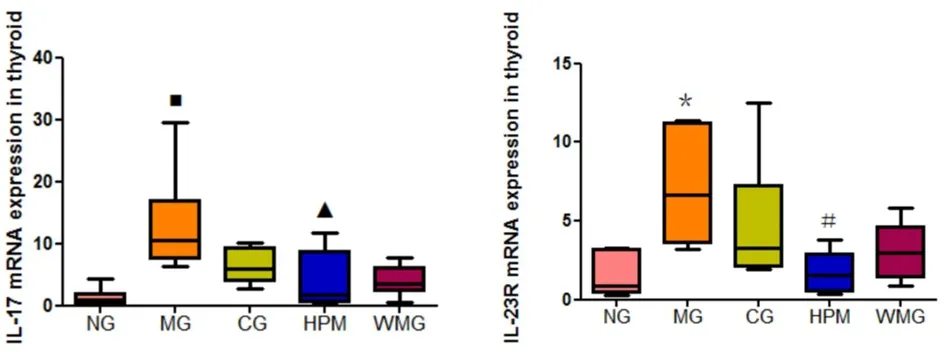

图23 各组大鼠甲状腺组织中IL-17mRNA表达水平的比较图24 各组大鼠甲状腺组织中IL-23RmRNA表达水平的比较 注:与正常组比较,■P<0.01;与模型组比较,▲P<0.01。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
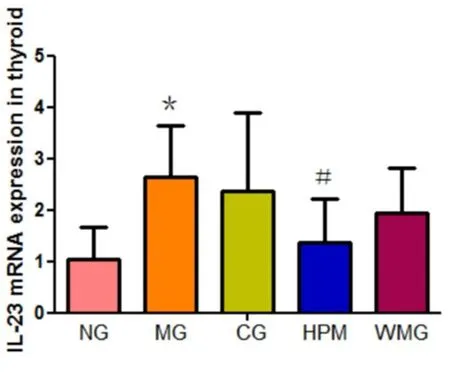
图25 各组大鼠甲状腺组织中IL-23 mRNA
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。NG:正常组;MG:模型组;CG:优甲乐组;HPM:隔附子饼灸组;WMG:温和灸组。
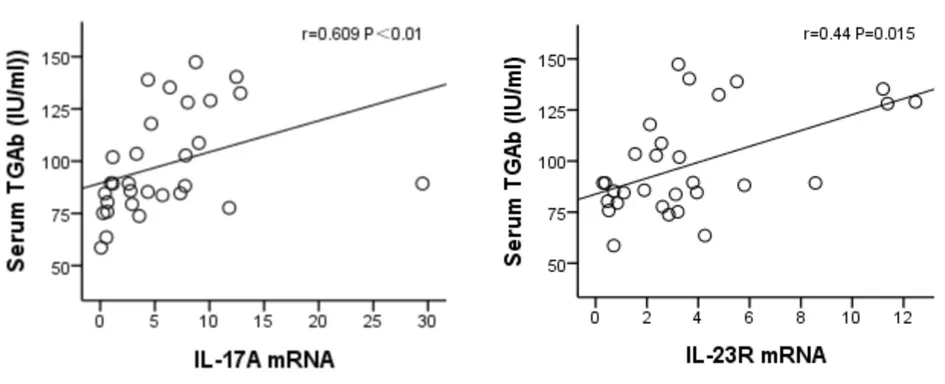

图26 甲状腺中IL-17AmRNA和TGAb相关性(r=0.609,P<0.01)图27 甲状腺中IL-23R和TGAb相关性(r=0.44,P=0.015)
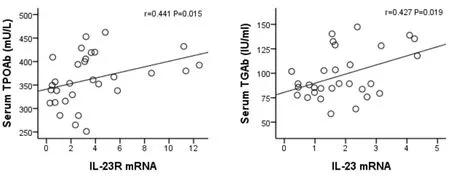

图28 甲状腺中IL-23RmRNA和TPOAb相关性(r=0.441,P=0.015)图29 甲状腺中IL-23mRNA和TGAb相关性(r=0.427,P=0.019)
2.7 各组大鼠甲状腺组织中IL-17、IL-23和IL-23R mRNA表达水平与其自身抗体水平的相关性分析
随机从每组的TGAb、TPOAb实验数据中选取6个数据与其甲状腺组织中IL-17 mRNA、IL-23 mRNA和IL-23R mRNA表达水平进行相关性分析,结果显示,甲状腺组织中IL-17 mRNA表达水平与TGAb水平呈正相关关系(r=0.609,P<0.01)。见图26。与TPOAb水平存在正相关趋势,但无统计学意义(r=0.355,P=0.054);甲状腺组织中IL-23 mRNA表达水平与TGAb水平呈正相关关系(r=0.427,P=0.019)。见图27。与TPOAb水平存在正相关趋势,但无统计学意义(r=0.310,P=0.095);甲状腺中IL-23R mRNA与TGAb、TPOAb水平均存在正相关关系(r值分别为0.44、0.441,P值均为0.015)。见图28,图29。
3 讨论
课题组前期及其他研究发现艾灸对HT有较好的疗效。胡国胜、王晓燕等[21-23]研究发现,经艾灸治疗后桥本甲状腺功能减退的患者血清中总T3、T4的含量明显升高,TSH的含量明显降低;夏勇、张育瑛等[24-26]发现隔附子饼灸能够改善HT患者甲状腺功能,隔附子饼灸合优甲乐组桥本患者TGAb、TPOAb下降率明显;徐惠芬[16]发现隔药饼灸加左旋甲状腺素钠对本病总有效率从单用药物的75.86%提高到86.67%。本实验结果发现,隔附子饼灸组能升高EAT大鼠血清过低的FT3水平,降低过高的TSH水平,温和灸组也能降低TSH浓度,两种灸法均能降低EAT大鼠血清中TGAb、TPOAP水平,且隔附子饼灸较优甲乐更能降低TPOAb的浓度,提示隔附子饼灸和温和灸均能改善甲状腺功能,不同程度上降低甲状腺自身抗体水平。TGAb、TPOAb是用来诊断HT的重要指标[27]。HT患者体内TGAb和TPOAb的阳性率分别为85%和95%[3]。但TGAb、TPOAb并不仅仅出现在甲状腺疾病患者的体内,RA[28]、SLE[29]、1型糖尿病[30]等自身免疫性疾病和内分泌疾病患者内体也内出现TGAb和TPOAb的低度或中度升高。TGAb、TPOAb的产生与机体免疫功能紊乱密切相关,活化的Th可细胞诱导B细胞分泌TGAb和TPOAb。而TGAb和TPOAb可通过抗体依赖的细胞介导的细胞毒作用[31-32]或补体依赖的细胞介导的细胞毒作用损伤甲状腺细胞。TPOAb还可以通过与TPO的结合,抑制TPO的活性,使甲状腺素合成减少,同时机体通过负反馈机制使TSH的分泌增加,从而导致甲减的发生。因此,降低HT体内自身抗体的浓度有利于控制疾病的发展[25]。为了进一步明确艾灸对本病的作用机制,本研究从免疫调节的角度采用EAT大鼠模型,探讨艾灸对HT的作用机制。
随着对HT发病机制研究的深入,Th1/Th2细胞并不能完全解释HT的发病机制,炎性细胞因子IL-17、IL-23和IL-23R也参与了HT的发病过程。本实验发现隔附子饼灸组、温和灸组大鼠血清IL-17、IL-23浓度低于模型组,隔附子饼灸组血清IL-23R浓度也低于模型组,且隔附子饼灸组血清IL-17表达水平高于温和灸组;隔附子饼灸组大鼠甲状腺组织中IL-17 mRNA、IL-23R mRNA和IL-23 mRNA表达水平低于模型组。对血清IL-17、IL-23、IL-23R浓度、甲状腺组织mRNA表达水平和血清自身抗体TGAb、TPOAb含量进行相关性分析发现,血清中IL-17、IL-23的浓度,甲状腺组织中IL-17、IL-23、IL-23R mRNA的表达水平均和血清中TGAb的浓度呈正相关关系,血清中IL-17、IL-23、IL-23R的浓度,甲状腺组织中IL-17 mRNA的表达水平均与血清中TPOAb的浓度也呈正相关关系。研究结果提示艾灸可能通过降低IL-17、IL-23、IL-23R等炎性细胞因子的表达水平,减轻炎性反应,起到保护甲状腺的作用。Konca Degertekin C等[33]研究表明,甲状腺功能正常以及功能减退的HT患者血清IL-17、IL-23水平与对照组比较明显不同,甲状腺功能正常HT患者血清IL-17、IL-23水平最高。Peng H[34]研究表明,HT患者外周血单核细胞IL-23R mRNA显著增高,并且IL-23R mRNAs水平与血清TGAb水平呈正相关关系。Xue H等[35]研究表明,与健康对照组比较,HT患者血清IL-17表达增高,差异有统计学意义。Figueroa-Vega N等[36]研究表明,HT患者甲状腺组织中IL-17、IL-23R(+)细胞表达增高,血清中IL-23表达增高。Li D等[37]发现HT患者血清IL-17水平显著增高。吴汉妮等[38]研究表明,HT患者甲状腺组织IL-23p19、IL-17蛋白以及IL-23p19、IL-17 mRNA的表达增高,并且IL-23p19 mRNA和IL-17mRNA的表达水平存在正相关,提示IL-23/IL-17可能参与了HT的发病过程。IL-23是IL-12家族中的一员,由P40和P19两个亚单位组成,其中P40与IL-12共用,P19是IL-23独特的亚单位,IL-23由因微生物刺激而活化的树突状细胞和巨噬细胞产生[39-40]。IL-23能够通过诱导STAT3的磷酸化[41],起到促进IL-17分泌的作用,是IL-17产生的一个关键的因素[41]。IL-23受体(IL-23R)只表达于活化的Th细胞或记忆T细胞,与IL-12Rβ1共同组成IL-23的受体复合物,通过与其配体IL-23结合发挥作用。
总之,基于临床艾灸对HT有效,本研究首先明确艾灸对EAT大鼠保护效应,接着探讨了艾灸对EAT大鼠的免疫因子IL-17、IL-23及其受体的影响,发现隔附子饼灸能降低EAT大鼠血清及甲状腺组织的IL-17、IL-23和IL-23R浓度及mRNA表达水平,纠正EAT大鼠甲状腺组织病理学改变,改善EAT大鼠的甲状腺功能。但该类炎性细胞因子的受什么调节,其调节的具体途径与疾病因果关系还需要进一步深入研究。
[1]Wang S,Baidoo S E,Liu Y,et al.T cell-derived leptin contributes to increased frequency of T helper type 17 cells in female patients with Hashimoto′s thyroiditis[J].Clinical & Experimental Immunology,2013,171(1):63-68.
[2]Akamizu T,Amino N,Degroot L J.Hashimoto′s Thyroiditis[M].South Dartmouth(MA):MDText.com,Inc.; 2000-.:Available from:https://www.ncbi.nlm.nih.gov/books/ NBK285557/.
[3]Xue H,Yang Y,Zhang Y,et al.Macrophage Migration Inhibitory Factor Interacting with Th17 Cells May Be Involved in the Pathogenesis of Autoimmune Damage in Hashimoto′s Thyroiditis[J].Mediators of Inflammation,2015,2015:1-9.
[4]Radetti G.Clinical aspects of Hashimoto′s thyroiditis[J].Endocr Dev,2014,26:158-170.
[5]Noureldine S I,Tufano R P.Association of Hashimoto′s thyroiditis and thyroid cancer[J].Curr Opin Oncol,2015,27(1):21-25.
[6]Caturegli P,De Remigis A,Rose N R.Hashimoto thyroiditis:clinical and diagnostic criteria[J].Autoimmun Rev,2014,13(4/5):391-397.
[7]李凤红,周静.疏肝散结法治疗桥本氏甲状腺炎42例的临床报告[J].贵阳中医学院学报,2011,33(6):53-55.
[8]高卫卫,姚昶.温阳化痰法治疗桥本氏甲状腺炎60例临床观察[J].云南中医中药杂志,2010,31(1):18-19.
[9]胡国胜,陈汉平,何金森,等.艾灸感应传导与循环免疫复合物含量变化的关系[J].上海针灸杂志,1987(3):1-2.
[10]夏勇,夏鸣喆,李艺,等.艾灸配合药物改善桥本氏甲状腺炎患者生活质量的观察[J].上海针灸杂志,2012,31(4):219-221.
[11]夏勇,夏鸣喆,李艺,等.艾药并用对桥本氏甲状腺炎患者TPOAb和TGAb的调节[J].上海针灸杂志,2011,30(12):807-809.
[12]张育瑛,夏勇,游世晶,等.艾药结合治疗84例桥本氏甲状腺炎中医证候分析[J].辽宁中医药大学学报,2013,15(3):95-96.
[13]张育瑛,夏鸣喆,李艺,等.隔附子饼灸对桥本氏甲状腺炎血清特异抗体与甲状腺功能的相关性分析[J].上海针灸杂志,2013,32(1):25-27.
[14]夏勇,夏鸣喆,李艺,等.隔附子饼灸关元、命门为主对桥本甲状腺炎患者甲状腺功能的影响[J].中国针灸,2012,32(2):123-126.
[15]Xia Y,Xia MZ,Li Y,et al.Clinical Study on Combined Moxibustion and Medication for Hashimoto′s Thyroiditis[J].J Acupunct Tuina Sci,2012,10(6):359-363.
[16]徐惠芬.隔药饼灸加左旋甲状腺素钠治疗慢性淋巴细胞性甲状腺炎[J].浙江中西医结合杂志,2013,23(6):459-461.
[17]Brazillet MP,Mignon-Godefroy K,Charreire J.Induction of experimental autoimmune thyroiditis(EAT)by heat-denaturated thyroglobulin(Tg)[J].Exp Clin Endocrinol Diabetes,1996,104(Suppl 3):23-25.[18]姜玲,胡玲,黄慧钟.实验性自身免疫性甲状腺炎动物模型的比较[J].实用临床医学,2010(3):7-9.
[19]Li M,Eastman C J,Boyages S C.Iodine induced lymphocytic thyroiditis in the BB/W rat:early and late immune phenomena[J].Autoimmunity,1993,14(3):181-187.
[20]Allen E M,Appel M C,Braverman L E.The effect of iodide ingestion on the development of spontaneous lymphocytic thyroiditis in the diabetes-prone BB/W rat[J].Endocrinology,1986,118(5):1977-1981.
[21]胡国胜,陈汉平,何金森.129.艾灸治疗桥本氏甲状腺炎的临床研究[C].世界针灸学会联合会成立暨世界针灸学术大会,1987.
[22]胡国胜,陈汉平,侯永建,等.隔药灸治疗桥本氏甲状腺炎临床观察[J].中医杂志,1992,33(5):30-32.
[23]王晓燕.隔药饼灸治疗慢性淋巴细胞性甲状腺炎[J].中国针灸,2003,23(1):10-12.
[24]夏勇,夏鸣喆,刘世敏,等.隔附子饼灸关元、命门为主对桥本甲状腺炎患者甲状腺功能的影响[J].中国针灸,2012,32(2):123-126.
[25]夏勇,夏鸣喆,李艺,等.艾药并用对桥本氏甲状腺炎患者TPOAb和TGAb的调节[J].上海针灸杂志,2011,30(12):807-809.
[26]张育瑛,夏鸣喆,李艺,等.隔附子饼灸对桥本氏甲状腺炎血清特异抗体与甲状腺功能的相关性分析[J].上海针灸杂志,2013,32(1):25-27.
[27]Liu Y,Liu M,Zhang Y,et al.The expression of Fcgamma receptors in Hashimoto′s thyroiditis[J].Cell Immunol,2015,294(1):33-38.
[28]Pan X F,Gu J Q,Shan Z Y.Increased risk of thyroid autoimmunity in rheumatoid arthritis:a systematic review and meta-analysis[J].Endocrine,2015,50(1):79-86.
[29]Pan X F,Gu J Q,Shan Z Y.Patients with systemic lupus erythematosus have higher prevalence of thyroid autoantibodies:a systematic review and meta-analysis[J].PLoS One,2015,10(4):e123291.
[30]Metwalley K A,El-Saied A R.Thyroid abnormalities in Egyptian children and adolescents with type 1 diabetes mellitus:A single center study from Upper Egypt[J].Indian J Endocrinol Metab,2014,18(5):637-641.
[31]Zhang Y,Gao Y,Li M,et al.Avidity of thyroglobulin antibody in sera from patients with Hashimoto′s thyroiditis with different thyroid functional status[J].Clin Exp Immunol,2010,161(1):65-70.
[32]Trbojevic B,Djurica S.Diagnosis of autoimmune thyroid disease[J].Srp Arh Celok Lek,2005,133(Suppl 1):25-33.
[33]Konca D C,Aktas Y B,Balos T F,et al.Circulating Th17 cytokine levels are altered in Hashimoto′s thyroiditis[J].Cytokine,2016,80:13-17.
[34]Peng H,Liu Y,Tian J,et al.Decreased expression of microRNA-125a-3p upregulates interleukin-23 receptor in patients with Hashimoto′s thyroiditis[J].Immunol Res,2015,62(2):129-136.
[35]Xue H,Yu X,Ma L,et al.The possible role of CD4(+)CD25(high)Foxp3(+)/CD4(+)IL-17A(+)cell imbalance in the autoimmunity of patients with Hashimoto thyroiditis[J].Endocrine,2015,50(3):665-673.
[36]Figueroa-Vega N,Alfonso-Perez M,Benedicto I,et al.Increased circulating pro-inflammatory cytokines and Th17 lymphocytes in Hashimoto′s thyroiditis[J].J Clin Endocrinol Metab,2010,95(2):953-962.
[37]Li D,Cai W,Gu R,et al.Th17 cell plays a role in the pathogenesis of Hashimoto′s thyroiditis in patients[J].Clin Immunol,2013,149(3):411-420.
[38]吴汉妮,余玲,屈新才,等.IL-23、IL-17在桥本氏甲状腺炎患者甲状腺组织中的表达[J].细胞与分子免疫学杂志,2008,24(12):1182-1184.
[39]Zambrano-Zaragoza J F,Romo-Martinez E J,Duran-Avelar M J,et al.Th17 cells in autoimmune and infectious diseases[J].Int J Inflam,2014,2014:651503.
[40]Morrison P J,Ballantyne S J,Kullberg M C.Interleukin-23 and T helper 17-type responses in intestinal inflammation:from cytokines to T-cell plasticity[J].Immunology,2011,133(4):397-408.
[41]Zambrano-Zaragoza J F,Romo-Martinez E J,Duran-Avelar M J,et al.Th17 cells in autoimmune and infectious diseases[J].Int J Inflam,2014,2014:651503.
(2016-12-07收稿 责任编辑:洪志强)
Effect of Moxibustion on Experimental Autoimmune Thyroiditis and Inflammatory Cytokines in Rats
Cui Yunhua1,Lei Fei1,Zhao Jimeng1,Wu Huangan1,Xu Huifen2,Wu Renzhao3,He Jinsen4, Yu Shuguang5,Huang Yan1,Wu Luyi4,Liu Shimin4,Hu Ling6,Liu Huirong1
(1ShanghaiResearchInstituteofAcupunctureandMeridian,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200030,China; 2HuzhouHospitalofTraditionalChineseMedicine,ZhejiangProvince,Huzhou313000,China; 3ZhejiangProvincialInstituteoftraditionalChineseMedicine,Hangzhou310007,China; 4ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 5ChengduUniversityofTCM,Chengdu611137,China; 6AnhuiUniversityofTraditionalChineseMedicine,Hefei230038,China)
Objective:To observe the effect of moxibustion on rats with experimental autoimmune thyroiditis (EAT), and to study the effect of moxibustion on the expression of IL-17, IL-23 and its receptor. Methods:Sprague-Dawley rats were randomly divided into 5 groups:the normal group, the model group, the euthyrox group, the aconite cake-separated moxibustion group and the mild moxibustion group. Model rats were immunized with porcine thyrogiobulin followed high iodine water to established animal models. The EAT model was identified after the last immunization. After 30 days′intervention of moxibustion and western medicine, the concentration of TGAb, TPOAb, IL-17, IL-23, IL-23R in serum, as well as the expression levels of L-17, IL-23, IL-23R mRNA in thyroid gland were detected. Results:All of the aconite cake-separated moxibustion, the mild moxibustion and the euthyrox could correct the histopathological changes of thyroid gland in EAT rats. Compared with the normal group, the levels of serum FT3 decreased (P<0.01), the concentration of serum TSH, TGAb and TPOAb increased (P<0.05), and the levels of IL-17, IL-23 and IL-23R mRNA expressionin in the thyroid tissue were increased in model group (P<0.05). Compared with the model group, the levels of serum FT3 increased (P<0.01), the concentration of serum TPOAb, IL-23 decreased in euthyrox group (P<0.05); and the levels of serum FT3 increased (P<0.01), the concentration of serum TSH, TGAb, TPOAb, IL-17, IL-23, IL-23R decreased (P<0.05), and the levels of IL-17, IL-23 and IL-23R mRNA expression in the thyroid tissue increased in aconite cake-separated moxibustion group (P<0.05); the concentration of serum TSH, TGAb, TPOAb, IL-17, IL-23 decreased (P<0.05), the concentration of serum IL-17, IL-23 and the levels of IL-17, IL-23 and IL-23R mRNA expression in the thyroid tissue were positively correlated with serum TGAb, the concentration of serum IL-17, IL-23, IL-23R and the IL-23R mRNA expression in the thyroid tissue were positively correlated with serum TPOAb in mild moxibustion group. Conclusion:Aconite cake-separated moxibustion and mild moxibustion can effectively correct the pathological changes of thyroid tissue in EAT rats, improve the thyroid function of EAT rats and reduce the thyroid autoantibody level, which may be related to the regulation of inflammatory cytokines IL-17 and IL-23 Expression.
Experimental autoimmune thyroiditis; Moxibustion; Interleukin-17; Interleukin-23; Mechanism
国家重点基础研究发展计划(”973”计划)项目(编号:2009CB522900;2015CB554501);上海市卫生和计划生育委员会中医药科研项目(编号:2016LQ013)
崔云华、雷菲、赵继梦为并列第一作者
吴焕淦(1956—),男,博士,上海中医药大学首席教授,博士研究生导师,研究方向:针灸作用的基本原理与应用规律研究
R245.81
A
10.3969/j.issn.1673-7202.2016.12.011

