生活污水对白骨壤和红海榄叶片指标及结构的影响
余如凤,邓 妹,陈文莲,袁柳娇,刘锴栋
(岭南师范学院生命科学与技术学院,广东 湛江 524048)
生活污水对白骨壤和红海榄叶片指标及结构的影响
余如凤,邓 妹,陈文莲,袁柳娇,刘锴栋*
(岭南师范学院生命科学与技术学院,广东 湛江 524048)
为了探讨2种红树植物叶片对生活污水环境的适应性,采用石蜡切片法和显微拍照法观察了白骨壤和红海榄2种红树植物的叶片结构。结果表明:污染区的白骨壤叶片的上角质层厚度、表皮层厚度、上内皮层厚度等均比无污染区的白骨壤大,而污染区的红海榄叶片则在下角质层厚度、上表皮层厚度、下内皮层厚度等指标上比污染区的红海榄显著增大,表明生活污水对红树植物的生长有一定的影响。
生活污水;红树植物;生理指标;抗污染性
红树林是生长于港湾河口地区特有的森林植物,其结构与功能不同于陆地生态系统和海洋生态系统的特性,它们对海陆边缘的生态平衡起着重要的作用。随着沿海地区现代工业化的发展以及人口增长,大量的废水直接排入河流,导致河口海岸的水体污染逐渐加重[1]。近年来,由于江河流域及沿海城市经济的发展,大量的工农业污染物排放于河口、海湾这些临海地区,使红树植物的生长受到影响。红树植物正面临着退化与消失的严重趋势,保护红树林已成为全球的共识[2]。
作为典型的热带、亚热带带生态系统,海岸红树林湿地对泥滩中的污染物和有毒物质有着较强的耐受及吸附作用。成片的红树林可以通过汲取、蓄积各种重金属离子来净化水体和湿地土壤[3-4]。红树植物一方面可以从排放的污水中摄取营养物质,有利于植物的生长;但另一方面,污水中的重金属离子也会对红树植物造成毒害[5]。陈桂葵等[6]研究了人工污水对白骨壤(Avicennia marina)生长的影响,蔡建秀等[7]研究了铅胁迫对桐花(Aegiceras corniculatum)树幼苗根叶蛋白质及根抗氧化酶活性的影响,袁彦婷等[8]研究了汞胁迫对白骨壤幼苗生理生态的影响。但目前大多数研究是针对污染环境下红树植物的生理特性进行了研究,关于污染状态下红树植物叶片结构特征的研究则比较少。叶片是植物进化过程中对环境比较敏感的可塑性较大的器官,植物对环境的适应也较多的表现在叶的形态结构上[9]。
本实验以对白骨壤、红海榄在生活污水胁迫下的叶片结构的特点进行观察研究,为利用红树植物净化生活污水提供科学依据,同时对于开展红树植物的研究及其推广应用具有重要的意义。
1 材料和方法
1.1 试验材料
试验材料分别采自广东省湛江市霞山区观海长廊污染区和无污染区的健康、长势一致的红树林树种枝条以及它们生长的土壤,选取的植物分别有:污染的白骨壤、红海榄(Rhizophora stylosa)以及正常的白骨壤、红海榄。
1.2 土壤和植物样品的采集
在两个取样地中各选择成熟健康、年龄、高度及生长状况较为相似的白骨壤和红海榄。然后将采集回来的白骨壤和红海榄叶片进行初处理,挑选发育较为完整、成熟的叶片枝条,每种植物各挑选5株,每一小枝带有3对叶片,在实验室用自来水将其清洗干净,并晾干水分备用。同时,将带回来的两种土壤共6份平摊开放在阴凉处,每半天翻一次土,经过4 ~ 5 d风干后再进行土壤分析检测。
取叶片样品的同时,在这两个样地处采集土壤作样本。由于海潮经常冲刷,土壤表层的成分不稳定,因此土壤应采自20 ~ 60 cm处的土层较为合理。由岭南师范学院测定红树植物叶片及土壤的各生理生化指标。
1.3 试验方法
待叶片晾干后,参照潘叶等[10]的方法进行叶片横切处理,即剪取成熟叶片的中脉两侧约 5 mm×5 mm 小块放置离心管中,然后用FAA对其固定,接着经过50%、70%、85%、95%直至纯酒精脱水后,再用番红—固绿对叶片进行染色,最后再用中性树胶封片,制成永久切片。
然后用OLYMPUS显微镜(SZX7)进行拍片、观察,切片经番红—固绿染色后,部分细胞被染成红褐色的小体,有红褐色的小体则说明有单宁存在,由于单宁细胞中的单宁化合物可氧化成褐色和红褐色的鞣酐[11]。采用剪纸衡重法测量叶片面积。
2 结果与分析
2.1 试验点的土壤成分状况
污染区的污水是城市排放的生活污水。污染区和无污染区的土壤成分测量结果如表1可知,pH值在无污染区比污染区要高。土壤中的重金属如汞、铅、镉、铜、铬、砷和锌的标准含量均为无污染区比污染区低。有效养分中,相差最大的是有效磷含量,污染区中的有效磷明显高于无污染区,但有效钾则相反。

表1 土壤成分分析标准物质检验值
2.2 两种红树植物叶片细胞解剖特征
2.2.1 表皮结构
在显微镜下观察下得知,与非污染区的白骨壤相比,污染区的白骨壤叶片具有明显较厚的上角质层,而红海榄的上角质层厚度在污染区和非污染区差异不大(表2,图2)。
从表2可以看出,在污染环境下,白骨壤的上表皮层及下表皮层厚度均有显著增加,而污染条件下红海榄则只在上表皮层厚度出现显著增加。
白骨壤和红海榄2种红树植物的内皮层变化程度不同。污染区的白骨壤的上内皮层厚度整体上有所增加。污染红海榄的上内皮层厚度差异不明显,下内皮层明显增厚(表2,图2)。
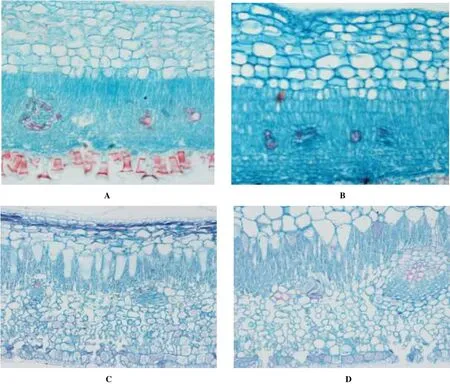
图1 非污染与污染环境下2种红树植物叶片显微结构

表2 污染与非污染环境下2种红树植物叶片结构单一指标
2.2.2 叶脉结构
从横切面看,红海榄的主脉由十个小的维管束组成,这些维管束属于外韧维管束,呈花环状。木质部导管径向放射排列。木质部上表皮方向不发达,而偏下表皮方向较为发达,呈横向长圆形。污染区的白骨壤和红海榄木质化作用的较早发生。叶片维管束内的形成层变得明显。
2.2.3 生活污水对叶片面积的影响
由表2的数据可知,无污染区的白骨壤和红海榄的叶片面积分别为6.75 cm2和51.39 cm2,均显著大于污染区的。污染区的白骨壤和红海榄的叶片面积则为4.53 cm2和44.16 cm2,由此说明污染对这两种红树植物的生长有所影响。
3 讨论
污水排放中含有营养物质N、P及一些重金属元素,如Cu、Zn、Cr等,当这些物质排入到红树林湿地系统时,红树植物对它们具有一定的吸收作用。同时,一部分污染物沉积在红树林土壤中,因此红树林湿地系统可缓解海水体的富营养化,减少赤潮的发生[12-13]。
植物角质层能够减少植物表面水分非气孔性散失,削弱紫外辐射对植物的伤害及防止病菌侵害的作用[14]。污染区的氮元素和磷元素含量均大于无污染区,更容易引发富营养化。而本实验中,所研究的2种红树植物的角质层均是污染区的大于非污染区的,说明红树植物叶片结构能随着环境的不同而发生相应性的变化。
表皮细胞的作用主要是保护内部组织,有研究发现红树植物叶片吸收的重金属主要分布在表皮细胞、亚表皮细胞和表皮毛中[15-16],因此,这几个部位受重金属的影响也比较大。
有研究表明,叶片面积减小可防止水分蒸腾散失[17]。本研究的结果显示,无污染区的白骨壤和红海榄的叶片面积均显著大于污染区的。这说明在污染条件下,白骨壤和红海榄可能通过减少叶面积来减少水分散失,从而维持其生长。
本文的研究结果表明,在生活污水条件下生长的白骨壤和红海榄其叶片结构和生理指标均发生了明显的变化,这些变化在一定程度上抑制了它们的生长和繁殖。因此,本研究为进一步研究生活污水的浓度对红树植物的生长和繁殖提供了一定的科学依据。
[1] 李晓菊,靖元孝,陈桂珠.红树林湿地系统污染生态及其净化效果的研究概况[J].湿地科学,2005,3(4): 1672‒5948.
[2] 张乔民,隋淑珍.中国红树林湿地资源及其保护[J].自然资源学报,2001,16(1):28‒36.
[3] 张凤琴,王友绍,李小龙,等. 复合重金属胁迫对秋茄幼苗某些生理特性的影响[J].生态环境,2008,17(6): 2234‒2239.
[4] Li R L,Chai M W, Qiu G Y. Distribution, fraction, and ecological assessment of heavy metals in sediment‒plant system in Mangrove forest, South China Sea[J].PLoS One,2016,11(1): e0147308.
[5] Zhang Z W, Xu X R, Sun Y X, et al. Heavy metal and organic contaminants in mangrove ecosystems of China: a review[J].Environmental Science and Pollution Research,2014,21(20):11938‒11950.
[6] 陈桂葵,陈桂珠,黄玉山,等.人工污水对白骨壤生长的影响[J].海洋环境科学, 2003,22(3):39‒43.
[7] 蔡建秀,王慧云,王春风.铅胁迫对桐花树幼苗根叶蛋白质及根抗氧化酶活性的影响[J].安徽农业学报,2010, 38(6):2903‒2905.
[8] 袁彦婷,丁振华,张玲.汞胁迫对白骨壤生理生态的影响[J].生态学杂志,2011,30(5):1013‒1017.
[9] 戴叶辉,王琳,邢福武,等.13种榕属植物的叶片结构及其对环境的适应性[J].仲恺农业工程学院学报, 2012,25(4):5‒13.
[10] 潘叶,冯永庆,马焕普.一种适用于植物组织的快速石蜡制片法[J].中国农学通报,2008,24(3):112‒115.
[11] Esau K(李正理译).种子植物解剖学[M].上海:上海人民出版社,1973.
[12] 朱颖,吴纯德.红树林对水体净化作用研究进展.生态科学,2008,27(1):55‒60.
[13] 马骅.人工合成污水对桐花树模拟湿地的影响及湿地净化效应研究[D]. 广州:中山大学,1996.
[14] Lee S B,Sub M C.Recent advances in cuticular wax biosynthesis and its regulation in Arabidopsis[J]. Molecular Plant,2013, 6(2):246‒249.
[15] Bacelar E A,Correia C M,Moutinho‒Pereira J M,et al.Sclerophylly and leaf anatomical traits of five field‒grown olive cultivars growing under drought conditions[J]. Tree Physiology,2004,24(2): 223‒239.
[16] 杨肖娥,尤新宪,倪吾钟.超积累植物吸收重金属的生理及分子机制[J].植物营养与肥料学报,2002,8(1): 8‒15.
[17] 李翠,程明,唐宇丹,等.青藏高原2种柳属植物叶片解剖结构和光合特性的比较[J].西北植物学报,2009,29(2): 275‒282.
Impact of Domestic Sewage on Leaf Structures and Physiological Indices of Two Mangrove Species
YU Ru-feng, DENG Mei, CHEN Wen-lian, YUAN Liu-jiao, LIU Kai-dong
(Life Science and Technology School, Lingnan Normal University, Zhanjiang524048, Guangdong, China)
The leaves of Avicennia marina and Rhizophora stylosa were observed using the ‘paraffin method’and also an optical microscope, to evaluate the potential adaptability of these two mangrove species to tolerate waters polluted with domestic sewage. The results showed that leaves of A. marina and R. stylosa growing in polluted areas had thicker uper cuticles, epidermis and uper endodermis compared to those growing in unpolluted waters, though the lower cuticles, uper epidermis and lower endodermis of R. stylosa in polluted areas were also significantly thicker. Consequently, domestic sewage can have significant effects on mangrove plants growing in waters that have been polluted by it.
Domestic sewage; mangrove; physiological index; pollution tolerance
Q494;X171.5
:A
广东省林业科技创新项目(2013KJCX011-03; 2015KJCX025)、国家级大学生创新创业训练计划项目(201510579277)、岭南师范学院自然科学研究项目(LZL1507) 、湛江市热带特色资源植物技术开发重点实验室项目(2014A06008)
余如凤(1993— ),在读本科生,主要从事红树林结构研究. E-mail: 504787424@qq.com
*通讯作者:刘锴栋(1982— ),男,硕士,副研究员,主要从事植物分子生物学研究. E-mail: liukaidong2001@126.com

