鱼藤属植物内生青霉菌代谢产物的提取及杀蚜活性分析
孙 涛, 孙之潭, 胡美英, 钟国华
(华南农业大学 昆虫毒理研究室,广东 广州 510642)
鱼藤属植物内生青霉菌代谢产物的提取及杀蚜活性分析
孙涛†, 孙之潭†, 胡美英, 钟国华
(华南农业大学 昆虫毒理研究室,广东 广州 510642)
摘要:【目的】从鱼藤属Derris植物的内生真菌中筛选代谢物具有杀虫活性的内生真菌,并验证其代谢产物的杀蚜活性。【方法】以毛鱼藤D.elliptica、白花鱼藤D.alborubra、蜜花鱼藤D.thyrisiflora和肇庆鱼藤D.hacei等鱼藤属植物的内生真菌为研究对象,采用经典形态学方法鉴定所分离内生真菌,对其代谢产物进行高效液相色谱(HPLC)检测,筛选出目的菌株。利用不同提取方法和提取溶剂优化目的菌株代谢产物的提取,采用浸虫法研究其代谢产物的杀蚜活性。【结果】从毛鱼藤根部筛选到1株代谢产物具有杀虫活性的内生青霉菌,其菌丝体的提取试验和发酵液的萃取试验表明,三氯甲烷是最好的提取溶剂和萃取溶剂,超声波法能够有效提取内生青霉菌丝体中的杀虫活性物质,提取率达4.156%。三氯甲烷提物对萝卜蚜成蚜活性最高,24和48 h的LC50分别为1.570和0.953 mg·mL-1。【结论】确定了鱼藤属植物内生真菌代谢产物的提取方法,并证实了代谢产物具有类似鱼藤酮的杀虫活性,其具体化学结构仍待进一步确证。
关键词:鱼藤; 内生真菌; 代谢产物; 萝卜蚜
为了适应复杂的生态环境,自然界中绝大多数植物都与某类微生物共生着, 形成多种形式的植物-微生物共生体系统[1]。随着对植物-微生物共生体系统的深入研究, 内生真菌作为一种新的微生物资源受到了广泛的关注。 至于内生真菌的定义,根据现在普遍接受的观点, 是指那些在某一段时期生活在植物体内, 但对寄主植物组织并不引起任何明显病害症状的真菌[2]。 此定义实际上包括那些专性寄生真菌、营表面腐生的腐生真菌、潜伏性病原真菌和菌根真菌。 内生真菌在进化过程中与植物寄主建立了和谐的共生关系, 其次生代谢产物十分丰富,具有多种生物活性如抗肿瘤、抗虫、抗病等,其中某些产物与宿主的次级代谢产物相同或相似[3]。自Strobel等[4]在1993年首次从短叶红豆杉内生真菌—安德氏紫杉霉Taxomycesandreanae的发酵产物中分离出抗癌活性物质——紫杉醇以来, 从药用植物内部筛选与开发具有药用价值的真菌资源, 寻找新的抗菌活性物质, 进而为植物源药物的生产开辟新途径, 已成为该领域的研究重点与热点。
近年来, 植物内生真菌及其次生代谢物在医学方面的研究较多, 在农业上应用的研究也逐渐成为热点。 目前农用内生真菌的研究主要集中在2个方面: 一是农作物的内生真菌对农作物本身的影响; 二是对植物内生真菌次生代谢产物的研究, 重点是发现具有农用生物活性的新化合物[5]。国外有文献报道:从巴布达橄榄Bontiadaphnoides中可分离得到多节孢属内生真菌Nodulisporium sp.,该菌会产生一种具有杀灭大苍蝇幼虫活性的吲哚二萜类球孢子酸(Nodulisporic acids)[6]。从蓖麻Ricinuscommunis中可分离到1株链格孢属霉Alternariasp.,其发酵产物中可分离得到具有抑制乙酰胆碱酯酶活性的物质,低浓度即对斜纹夜蛾Spodopteralitura具有较高的致死率[7]。从天然产物中发现新型先导化合物, 是新农药创制的重要途径。 内生真菌凭借其可增强作物抗逆性、促进作物生长和防治病虫害的特点,满足防治效果好、环境影响低、成本较低和节省农药等植保方面的要求,将成为新农药研发的重点方向[8]。 目前鱼藤酮主要从鱼藤的根中提取,受到自然资源相对匮乏的限制, 而组织培养的费用较高, 很难应用于农业生产实际。 本研究以传统杀虫植物鱼藤的内生真菌为研究对象, 以期从中发现具有产生类似鱼藤酮的杀虫活性物质的内生真菌,以改善鱼藤资源匮乏的局面。
1材料与方法
1.1供试菌株
鱼藤内生青霉菌Penicilliumsp.菌株及其他菌株均为笔者从华南农业大学昆虫毒理研究室杀虫植物标本园内的毛鱼藤Derriselliptica、白花鱼藤D.albo-rubra、蜜花鱼藤D.thyrsiflora和肇庆鱼藤D.hacei等鱼藤属杀虫植物中分离得到。
1.2培养基
固体培养基:马铃薯葡萄糖琼脂培养基(PDA)[9]。马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH自然。马铃薯去皮,切成块煮沸2 min,打浆1~2 min,冲洗打浆机,再加葡萄糖和琼脂,溶化后补足水至1 000 mL。
液体培养基:马铃薯葡萄糖液体培养基(PD)。
1.3供试昆虫
萝卜蚜Lipaphiserysimi:同翅目蚜科,采自华南农业大学教学试验农场及昆虫毒理研究室试验菜地,蚜虫采回后,挑选生长良好、大小一致的无翅成蚜进行试验。
1.4内生真菌的分离、纯化和培养
采用内生真菌常用的分离方法:采集新鲜供试植物的根和嫩枝,进行表面消毒。首先分别以自来水和无菌水冲洗3~4次,然后用体积分数为75%的乙醇漂洗5~15 min, 并用无菌水冲洗3~4次,再置于次氯酸钠溶液 (有效氯体积分数为10%) 漂洗1 min,最后用无菌水冲洗 4次。 在超净工作台上将消毒过的植物组织切割成0.5 cm×0.5 cm小片, 移入PDA平板上,于25 ℃培养箱中恒温培养。 3~5 d待植物样品边缘长出菌丝体后,根据菌丝体的形态特点(包括菌丝体的颜色、形状和质地等),采用尖端菌丝体挑取法对不同菌株进行分离纯化。 采用组织印迹法检验植物组织的灭菌效果:即将消毒而未切割的植物组织与固体平板接触3~5 min,培养3~5 d,根据平板上菌落的有无判定分离结果的有效性[10]。
内生真菌的液体培养采用摇瓶发酵法。将纯化菌株在无菌条件下接入装有150 mL PD培养基的500 mL三角瓶中,将其置于摇床中(25~28 ℃,RH 75%~85%,光照∶黑暗=12 h∶12 h)培养,摇床转速120 r·min-1,培养7~9 d。
1.5内生真菌活性物质的提取
用100目筛将菌丝体由发酵液滤出,置于45 ℃烘箱中鼓风烘干,得干菌丝体。
方法1(冷浸法):称取一定量的干菌丝体,加入10倍体积的甲醇。置于避光暗处,冷浸每次持续48 h以上,浸提3次,提取液合并,减压浓缩得粗提物。
方法2(组织研磨法):称取一定量的干菌丝体,移入研钵中,再加入适量甲醇,研磨至菌丝体完全粉碎,然后倒出,浸泡提取,提取液减压浓缩得粗提物。
方法3(超声波提取法):称取一定量的干菌丝体,加入10倍体积的甲醇,置于超声波仪上,在室温下提取3~5 min,过滤。 反复提取3次,滤液合并,浓缩得到超声波粗提物。
方法4(索氏抽提法):称取一定量的干菌丝体,用滤纸包好放入索氏提取器中,加入20倍量的甲醇回流至溶剂为无色时停止。 将提取液在旋转蒸发仪内减压浓缩,得粗提物。
1.6发酵液中活性物质的萃取
采用液-液分配萃取法:量取一定量的发酵液,用等体积的有机溶剂对发酵液萃取3次,然后将有机相45 ℃减压浓缩得粗提物,放入冰箱中备用。
1.7内生真菌活性物质的分析
对菌丝体甲醇提取物进行高效液相色谱分析(HPLC),以筛选产鱼藤酮或其类似物的内生真菌。 HPLC的检测条件:HP-1000型高效液相色谱仪为美国惠普公司制造;HEWLWTT PACKARD色谱柱(ODS HYPERSIL,5 μm,125 mm×4 mm);检测波长=295 nm;流动相为V(甲醇)∶V(水)=75∶25;流速为1 mL·min-1;检测灵敏度AUFS=0.001;柱温为常温;进样量为10 μL。 鱼藤酮纯品,质量分数为97%,购自美国Sigma公司。
1.8对萝卜蚜的毒杀活性测定
对萝卜蚜的毒杀活性测定采用浸虫法。 挑取30~50头成蚜放在新鲜的芥蓝叶中,放置 1~2 h稳定后,在供试样品溶液中浸3 s后取出,用滤纸吸除多余溶液,待溶剂干后放入垫有保湿滤纸的9 cm培养皿。 稀释溶剂为V(丙酮)∶V(水)=1∶1的溶液,按下列公式计算死亡率和校正死亡率:


2结果与分析
2.1毛鱼藤等鱼藤属植物内生真菌甲醇提取物的高效液相色谱分析
对毛鱼藤、白花鱼藤、蜜花鱼藤和肇庆鱼藤等鱼藤属植物的内生真菌进行了分离,分离纯化的菌株总数为81株。 将所分离纯化的菌株进行扩大培养,所得菌丝体甲醇冷浸提取,提取物进行高效液相色谱分析(HPLC),以筛选产鱼藤酮类似活性化合物的内生真菌。 从上面供试的81个菌株中,筛选到1株代谢产物具有鱼藤酮类似活性的内生真菌,该菌代谢产物的HPLC图谱中含有与鱼藤酮标样保留时间相近的色谱吸收峰(图1),其是否为鱼藤酮或其类似物还有待进一步鉴定。 该内生真菌用经典形态学方法鉴定为青霉属真菌。 该内生青霉菌株在PDA平板上的菌落呈墨绿色,色彩较暗,培养基背面鲜红色,可见水珠状无色渗出液。菌丝体墨绿色、浅黄色,表面光滑。 生长的适温范围为21~28 ℃,喜低温,其分类鉴定地位有待进一步的研究。
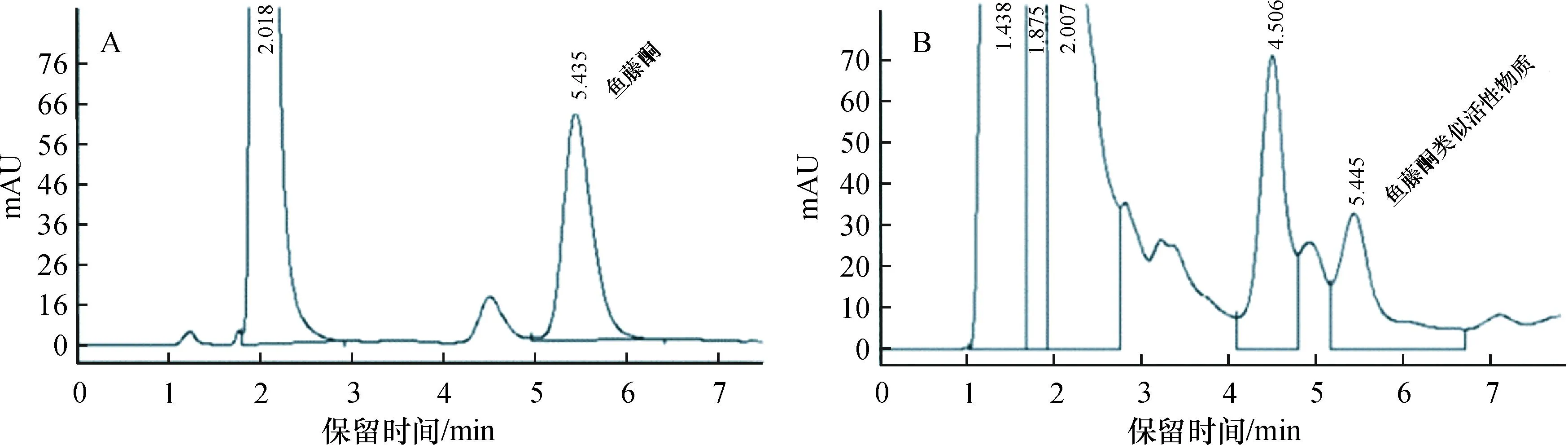
A:鱼藤酮标样;B:内生青霉菌代谢产物。
2.2内生青霉菌不同提取方法甲醇提取物对萝卜蚜的生物活性
用4种常规提取方法对内生青霉菌丝体进行提取,提取率见表1。
采用浸虫法,对内生青霉菌丝体不同提取方法的甲醇提取物进行了生物活性测定,结果见表2。 从表2中可以看出,4种不同提取方法的提取物对萝卜蚜均有一定的毒杀活性。 其中, 以超声波提取法提取物的毒杀效果最强, 处理蚜虫24和48 h的LC50分别为3.056和1.848 mg·mL-1, 杀虫活性随处理时间的增加而增强。 结合前面提取率的研究可以看出, 超声波提取法提取物的毒杀效果最强可能与其能够提取内生青霉菌丝体中大量的活性物质有关。
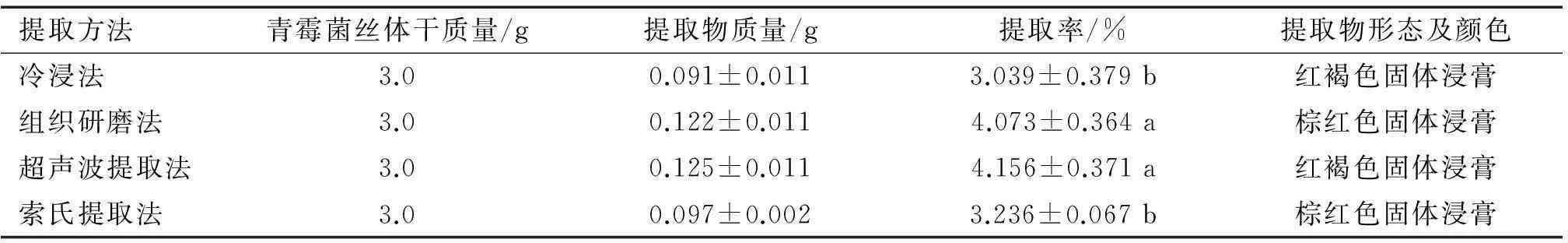
表1 内生青霉菌丝体不同提取方法的提取结果1)
1) 表中结果为3次重复的平均值,同列数据后凡是有一个相同小写字母者,表示在5%水平差异不显著(DMRT法); 提取溶剂为甲醇。
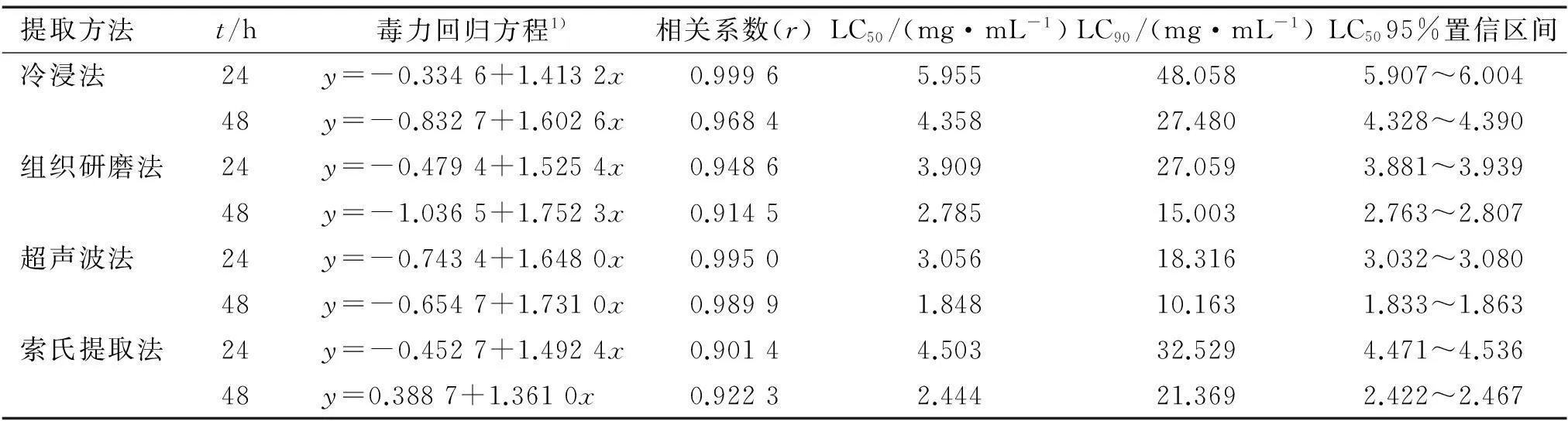
表2 内生青霉菌丝体不同提取方法甲醇提取物对萝卜蚜无翅成蚜的毒力
1)x为浓度的对数值,y为死亡几率。
2.3内生青霉菌丝体不同溶剂提取物对萝卜蚜的生物活性
不同溶剂对内生青霉菌丝体的提取效果如表3。
采用浸虫法,测定了内生青霉菌丝体6种溶剂提取物对萝卜蚜成蚜的毒力,其结果见表4。 由表4可以看到,内生青霉菌丝体不同溶剂提取物的活性差异较大,活性最高的是三氯甲烷提取物,24和48 h的LC50分别为1.570、0.953 mg·mL-1。 活性顺序依次是三氯甲烷>甲醇>正丁醇>乙醇>丙酮>乙酸乙酯提取物,活性最低的乙酸乙酯提取物24和48 h的LC50分别为4.784、3.631 mg·mL。
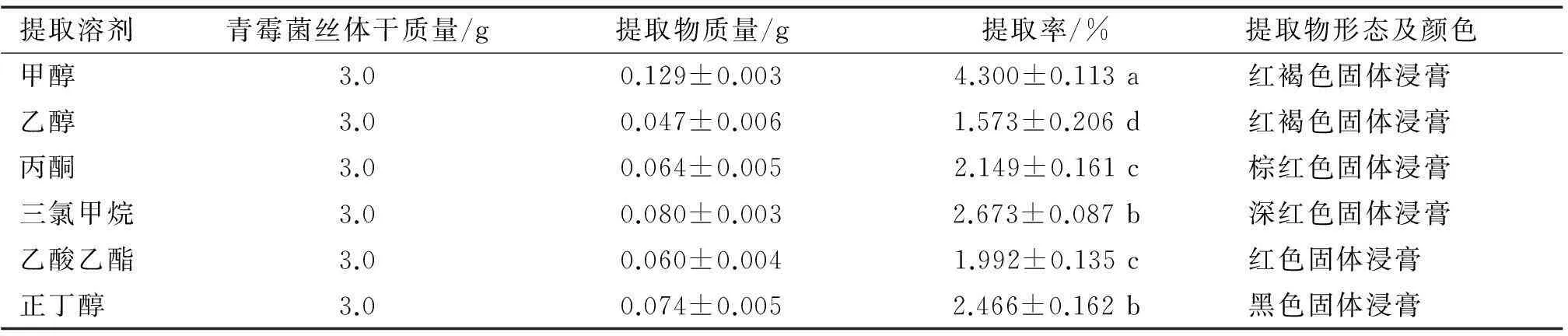
表3 内生青霉菌丝体不同提取溶剂的提取结果1)
1) 表中结果为3次重复的平均值,同列数据后凡是有一个相同小写字母者,表示在5%水平差异不显著(DMRT法)。
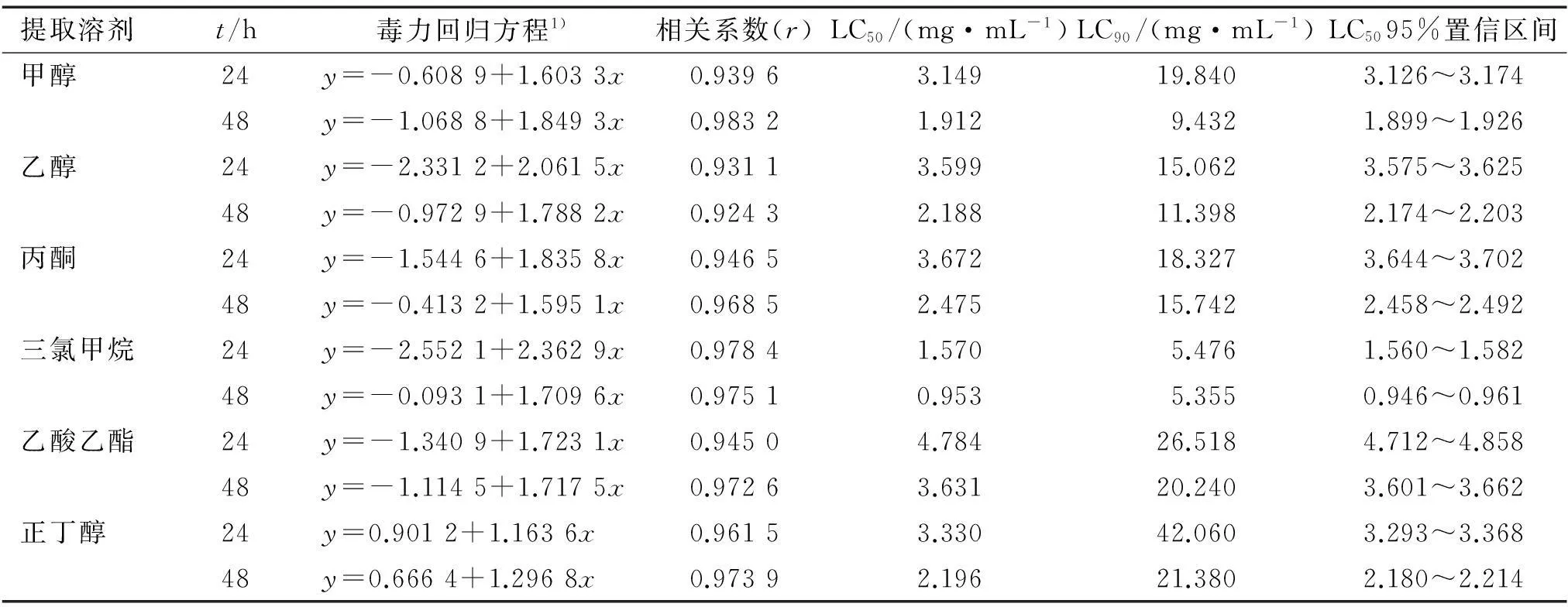
表4 内生青霉菌丝体不同溶剂提取物对萝卜蚜无翅成蚜的毒力
1)x为浓度的对数值,y为死亡几率。
2.4内生青霉发酵液不同溶剂萃取物对萝卜蚜的生物活性
内生青霉发酵液不同溶剂萃取物对萝卜蚜无翅成蚜的毒力测定结果如表5。内生青霉发酵液的不同溶剂萃取物中以三氯甲烷萃取物对萝卜蚜成蚜的毒杀活性最强,24和48 h的LC50分别为2.967、1.787 mg·mL-1。 其次为正丁醇萃取物,24和48 h的LC50分别为3.445、2.202 mg·mL-1。 结合前面的活性追踪过程,三氯甲烷对内生青霉菌的活性物质具有较好的提取效果,提取和萃取试验的活性测定结果均证实了这一点。
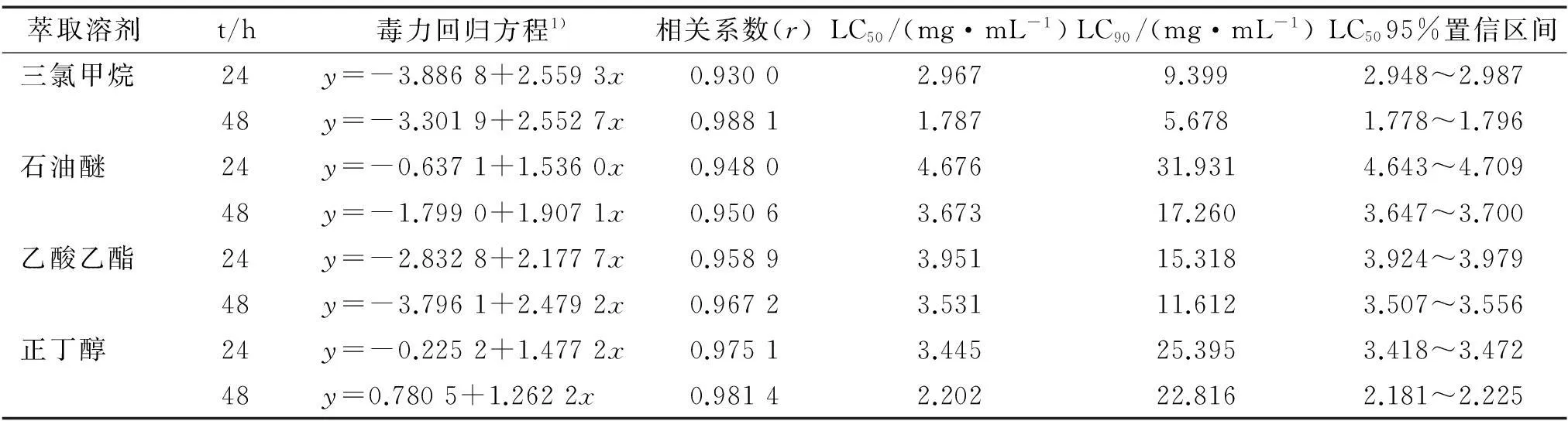
表5 内生青霉发酵液不同溶剂萃取物对萝卜蚜无翅成蚜的毒力
1)x为浓度的对数值,y为死亡几率。
3讨论与结论
植物与内生真菌的关系是互惠共生的,一方面植物为内生真菌提供光合产物和矿物质;另一方面内生真菌的代谢物能刺激植物的生长发育, 提高宿主植物对生物胁迫和非生物胁迫的抵抗能力[11]。 现代的内共生理论认为,植物与内生真菌在长期的协同进化过程中,生物化学途径的连续演化会导致信息物质在内生真菌与宿主间的相互传递[12]。 这一理论或许能够解释某些植物内生真菌可以产生与宿主相同或相似的生理活性成分的原因[13]。 本研究便是以传统杀虫植物毛鱼藤、白花鱼藤、蜜花鱼藤和肇庆鱼藤等鱼藤属植物的内生真菌为研究对象,对鱼藤内生真菌的代谢产物初步进行HPLC检测,从毛鱼藤根部分离到1株代谢产物具有杀虫活性的内生青霉菌,该菌代谢产物的HPLC图谱中含有与鱼藤酮标样保留时间相似的色谱吸收峰,其是否为鱼藤酮或其类似物还有待进一步鉴定。 蚜虫为鱼藤酮类化合物的敏感试虫,用鱼藤酮喷雾处理甘蓝蚜的LC50为7.44 μg·头-1[14]。 因此本研究采用萝卜蚜进行生物活性测定,以进一步确定鱼藤酮类似活性化合物的产生菌。
内生青霉菌丝体4种方法甲醇提取物的生物活性测定结果表明, 超声波提取法能够提取内生青霉菌丝体中大量的活性物质,提取率为4.156%。内生青霉菌丝体6种溶剂提取物和内生青霉发酵液4种溶剂萃取物的生物活性测定结果表明,三氯甲烷是最好的提取溶剂和萃取溶剂。三氯甲烷提取物对萝卜蚜成蚜24和48 h的LC50分别为1.570、0.953 mg·mL-1;三氯甲烷萃取物对萝卜蚜成蚜24和48 h的LC50分别为2.967、1.787 mg·mL-1。但本研究中内生青霉菌的代谢产物数量较少, 菌丝体甲醇提取物的产量约为0.15 g·L-1。根据HPLC检测数据结果来看,鱼藤酮类似活性化合物在内生青霉甲醇粗提物中仅为1/1 000左右,不足以完成所有的结构鉴定程序, 因此该内生青霉菌产生的鱼藤酮类似活性化合物的具体化学结构仍待进一步确证。
参考文献:
[1]BRUNDRETT M C.Coevolution of roots and mycorrhizas of land plants[J].New Phytol,2002,154(2): 275-304.
[2]杨润亚,冯培勇,李清.植物内生真菌农药活性的研究进展[J].农药,2006,45(7):440-444.
[3]易晓华.植物内生真菌次生代谢产物研究进展[J].中国农学通报,2009,25(21):255-260.
[4]STROBEL G,STIERLE A,STIERLE D,et al.Taxomyces andreanae,a proposed new taxon for a bulbilliferous hyphomycete associated with Pacific yew (Taxusbrevifolia)[J]. Mycotaxon,1993,47:71-80.
[5]官珊,钟国华,孙之潭,等.植物内生真菌的研究进展[J].仲恺农业技术学院学报,2005,18(1):61-66.
[6]STROBEL G,DAISY B,CASTILLO U,et al.Natural products from endophytic microorganisms[J].J Nat Prod,2004,67(2):257-268.
[7]SINGH B,THAKUR A,KAUR S,et al.Acetylcholinesterase inhibitory potential and insecticidal activity of an endophyticAlternariasp.fromRicinuscommunis[J].Appl Biochem Biotech,2012,168(5):991-1002.
[8]左玮.植物内生真菌在植保上的应用[J].安徽农学通报,2014,20(1):90-91.
[9]丁浩,张帆,曹研,等.马铃薯葡萄糖培养基制作方法的改进[J].中国酿造,2012,31(4):141-144.
[10]STURZ A V,CHRISTIE B R,MATHESON B G,et al. Biodiversity of endophytic bacteria which colonize red clover nodules,roots,stems and foliage and their influence on host growth[J].Biol Fert Soils,1997,25(1):13-19.
[11]林燕青,洪伟.植物内生真菌研究及应用前景[J].福建林业科技,2012,39(3):186-193.
[12]邵爱娟,林淑芳,张思巨,等.一种能产生紫杉醇类化合物内生真菌的分离[J].中国医学科学院学报,2001,23(6):642-644.
[13]王聪艳,周志国,武汉琴.植物内生真菌研究进展[J].生物学教学,2015,40(3):2-4.
[14]曾鑫年,张善学,方剑锋,等.毛鱼藤酮与鱼藤酮杀虫活性的比较[J].昆虫学报,2002,45(5):611-616.
【责任编辑柴焰】
Extraction of secondary metabolites of Penicillium sp. in Derris
plants and bioactivity assay against Lipaphis erysimi
SUN Tao†, SUN Zhitan†, HU Meiying, ZHONG Guohua
(Laboratory of Insect Toxicology, South China Agricultural University, Guangzhou 510642, China)
Abstract:【Objective】 To screen out one strain of endophytic fungi which might produce insecticidal secondary metabolites and test its insecticidal activity againstLipaphiserysimi.【Method】Endophytic fungi in insecticidal plants, includingDerriselliptica,D.alborubra,D.thyrsifloraandD.hacei, were studied. Endophytic fungi isolated fromDerrisplants were identified by classical morphological method, and their secondary metabolites were identified using high-performance liquid chromatograph(HPLC) to obtain the objective strains. Various extraction methods and extraction solvents were used to optimize the extraction of secondary metabolites. Insecticidal activity againstL.erysimiwas studied by immersion of the insect bodies.【Result】One strain of endophytic fungi ofPenicilliumsp., which produced insecticidal metabolites, was screened out from the roots ofD.elliptica. Extracting tests on the mycelia and fermentation of endophyticPenicilliumsp. indicated that chloroform was the best extracting solvent, and bioactive compounds could be effectively extracted using supersonic method with an extracting rate of 4.156%. Chloroform extract had the highest efficiency against the adults ofL.erysimi, of which LC50was 1.570 mg·mL-1after 24 h and 0.953 mg·mL-1after 48 h. 【Conclusion】This study determines the extraction method of the secondary metabolites from endophytic fungi ofDerrisplants, and confirmes that these metabolites have insecticidal activity similar to rotenone. However, the specific chemical structures of the secondary metabolites remains to be further confirmed.
Key words:Derris; endophytic fungi; metabolites;Lipaphiserysimi
中图分类号:S481.1
文献标志码:A
文章编号:1001-411X(2016)01-0046-06
基金项目:广东省自然科学基金(05006634)
作者简介:孙涛(1989—),男,硕士研究生,E-mail:nkxsuntao@163.com;孙之潭(1979—),男,硕士,E-mail:zhitansun2001@yahoo.com;†对本文贡献相同;通信作者:钟国华(1973—),男,教授,博士,E-mail:guohuazhong@scau.edu.cn
收稿日期:2015-04-09优先出版时间:2015-12-07
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20151207.1116.016.html
孙涛, 孙之潭, 胡美英,等.鱼藤属植物内生青霉菌代谢产物的提取及杀蚜活性分析[J].华南农业大学学报,2016,37(1):46-51.

