sirt2基因高表达对人脐带间充质干细胞衰老的抑制作用*
马珊珊,崔渊博,姚 宁,邢 衢,韩 康,宋及时,张彦婷,关方霞
1)郑州大学生命科学学院干细胞研究室 郑州 450001 2)郑州大学附属郑州中心医院转化医学中心 郑州 450007 3)郑州大学第一附属医院干细胞研究室 郑州450052
sirt2基因高表达对人脐带间充质干细胞衰老的抑制作用*
马珊珊1),崔渊博2),姚宁1),邢衢1),韩康1),宋及时1),张彦婷1),关方霞1,3)#
1)郑州大学生命科学学院干细胞研究室 郑州 4500012)郑州大学附属郑州中心医院转化医学中心 郑州 4500073)郑州大学第一附属医院干细胞研究室 郑州450052
关键词sirt2;腺病毒;人脐带间充质干细胞;衰老
摘要目的:观察sirt2基因高表达对人脐带间充质干细胞(hUC-MSCs)衰老的影响。方法:扩增人sirt2 ORF序列,利用腺病毒载体构建sirt2基因高表达的重组腺病毒(pAd-sirt2),空斑法测定病毒滴度;感染hUC-MSCs,倒置荧光显微镜下观察荧光表达情况;实验分为P3组(第3代hUC-MSCs)、P15组(第15代hUC-MSCs)和感染组(用pAd-sirt2腺病毒感染第15代hUC-MSCs),CCK-8检测细胞增殖情况,流式细胞术分析细胞周期变化,β-半乳糖苷酶染色后检测阳性细胞率。结果:成功制备pAd-sirt2重组腺病毒,病毒滴度为1.8×1011pfu/L;荧光观察证实Sirt2蛋白在hUC-MSCs中有效表达;与P15组相比,sirt2高表达可促进hUC-MSCs增殖,并将细胞周期阻滞在S期,β-半乳糖苷酶阳性细胞率降低(P均<0.05)。结论:sirt2基因高表达可促进hUC-MSCs增殖,延长细胞周期,并有效抑制hUC-MSCs的衰老。
AbstractAim: To construct a recombinant adenovirus containing sirt2 gene and to explore the impact of sirt2 overexpression on the aging of human umbilical cord mesenchymal stem cells(hUC-MSCs). Methods: Human sirt2 ORF was generated by RT-PCR and the recombinant adenovirus(pAd-sirt2) was constructed.The viral titer was determined by air-dilution method.After being transfected into hUC-MSCs, the green fluorescence was observed under fluorescence microscope. hUC-MSCs were allocated into P3 group(P3 hUC-MSCs), P15 group(P15 hUC-MSCs) and transfected group(transfected hUC-MSCs by pAd-sirt2). CCK-8 assay was performed to detect the proliferation of hUC-MSCs and flow cytometry, to analyze the cell cycle. SA-β-Gal was used to detect the cell senescence. Results: The recombinant adenovirus was constructed and the titer was 1.8×1011pfu/L. After infection by pAd-sirt2, P15 hUC-MSCs expressed green fluorescence protein clearly under the fluorescence microscope. Compared with P15 group, sirt2 overexpression could promote the cell proliferation, induced more cells at S phase,and decrease the positive rate of SA-β-Gal(P<0.05). Conclusion: sirt2 overexpression could promote hUC-MSCs proliferation,extend cell cycle,and inhibit cell senescence.
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有自我更新和多向分化潜能,为脊髓损伤、脑损伤等神经系统疾病的治疗带来希望[1-2]。但是体外培养的hUC-MSCs同正常细胞一样,也会呈现衰老变化,从而限制干细胞的使用[3]。研究发现sirt2参与调控微管蛋白、P53、细胞周期蛋白依赖性激酶的乙酰化[4-5],进而延缓细胞和机体的衰老[6]。但是sirt2在干细胞衰老中的作用和机制还不清楚。课题组前期研究[7]发现衰老的hUC-MSCs中sirt2的表达降低。因此,该实验构建含有人sirt2基因的重组腺病毒,观察sirt2高表达对hUC-MSCs增殖和细胞周期的影响,初步探讨sirt2对hUC-MSCs的抗衰老作用。
1材料与方法
1.1材料和试剂CCK-8、β-半乳糖苷酶染色试剂盒购自碧云天生物技术公司;引物设计和测序由生工生物工程(上海)股份有限公司完成;Trizol、逆转录和qRT-PCR试剂盒购自TaKaRa公司。hUC-MSCs为作者所在的实验室前期分离、鉴定和传代培养的细胞。

1.3重组腺病毒的扩增吸取5 μL包装好的腺病毒,感染80%融合的HEK293 细胞,常规培养 3~5 d,当 HEK293细胞出现明显的细胞病变时,收集细胞,于液氮、37 ℃反复冻融4次,每次10~15 min,12 000 r/min离心1 min后取上清,即得到在HEK293细胞中扩增的腺病毒,反复感染HEK293细胞即可获得大量腺病毒。
1.4重组腺病毒的滴度测定采用空斑法测定病毒滴度。pAd-sirt2腺病毒原液用DMEM/高糖培养基以10倍梯度依次稀释,取20 μL各浓度病毒感染80%融合的HEK293细胞,每组3个复孔,使病毒稀释液与细胞充分接触,37 ℃细胞培养箱中孵育1 h后弃培养液,每孔加入1 mL琼脂培养基使其均匀覆盖细胞,待琼脂培养基凝固后将板置于培养箱中继续孵育;每天定时观察各孔中空斑形成情况并计数1次,待空斑数目稳定不变(7~10 d)时停止;根据发生细胞完全病变的孔中的细胞数量计算腺病毒滴度。
1.5pAd-sirt2感染hUC-MSCs取第15代hUC-MSCs,用MOI为10 的pAd-sirt2感染第15代hUC-MSCs作为感染组,以正常培养的第15代hUC-MSCs为对照组(P15组),每组3个复孔。将2组细胞置于37 ℃、体积分数5%CO2细胞培养箱中培养,48 h后用荧光倒置显微镜观察细胞形态变化和荧光表达情况。
1.6Western blot检测Sirt2蛋白的表达收集上述感染组和P15组细胞,用RAPI裂解获得总蛋白,BCA法测量蛋白浓度,进行SDS-PAGE电泳。电泳结束后切取目的蛋白条带,以200 mA转膜1.5 h后于50 g/L脱脂奶粉溶液中室温封闭1 h,Sirt2一抗(11 000稀释)、内参β-actin一抗(1500稀释)4 ℃过夜孵育,TBST洗膜3次,每次15 min。用辣根过氧化物酶标记的山羊抗鼠二抗室温孵育2 h,TBST洗膜3次,ECL化学发光显影成像。
1.7CCK-8法检测pAd-sirt2对hUC-MSCs增殖的影响实验分为3组,分别为P3组(正常培养的第3代hUC-MSCs)、P15组(正常培养的第15代hUC-MSCs)和感染组(pAd-sirt2感染第15代hUC-MSCs),将细胞接种于96孔板,每孔各接种约2 500个细胞,每组3个复孔。分别于第1、2、3、4、5天避光下每孔加10 μL CCK-8溶液并继续培养2 h,酶标仪检测450 nm处的吸光度(OD)值,绘制各组细胞的生长曲线。
1.8PI染色法检测pAd-sirt2对hUC-MSCs细胞周期的影响细胞分组及处理同1.7。取1 mL、2×106mL-1的各组细胞悬液,离心去上清,PBS清洗后加入1 mL预冷的体积分数70%乙醇固定过夜。预冷PBS清洗加入0.5 mL PI染色液,37 ℃避光孵育30 min。流式细胞仪检测细胞周期变化。
1.9衰老相关β-半乳糖苷酶染色细胞分组及处理同1.7。弃各组细胞的培养液,加入1 mL β-半乳糖苷酶染色固定液,4 ℃固定30 min;PBS洗涤3次后每孔加入1 mL染色工作液,37 ℃孵育过夜。100倍镜下选取5个视野观察蓝染细胞,即阳性的衰老细胞,并计算阳性细胞率。
1.10统计学处理采用SPSS 19.0分析数据。采用单因素方差分析比较各组细胞的细胞周期分布和β-半乳糖苷酶阳性细胞率,两两比较采用LSD-t检验。检验水准α=0.05。
2结果
2.1重组腺病毒pAd-sirt2的构建所提的RNA具有清晰的28S和18S条带,满足实验要求(图1左)。RT-PCR扩增出大小为1 200 bp的特异性条带(图1中),测序验证为人sirt2 ORF序列。pAdTrack-CMV-sirt2质粒与pAdEasy1在BJ5183菌体内同源重组后,PacⅠ酶切得到1条大于23 000 bp的片段和1条4 500 bp的片段(图1右)。
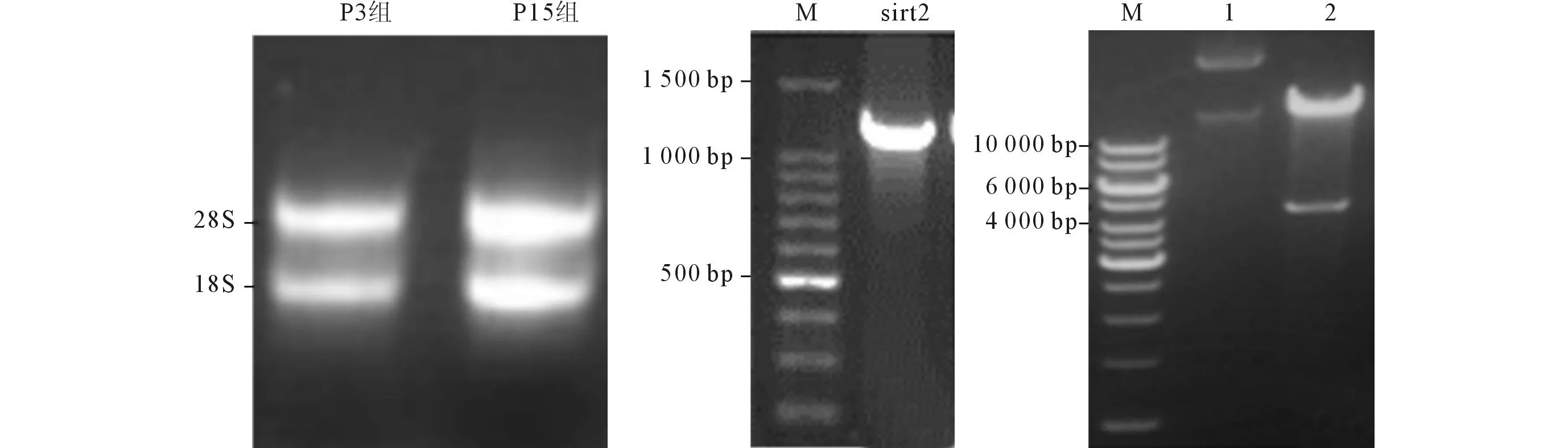
左:P3组和P15组hUC-MSCs总RNA提取结果;中:RT-PCR扩增人sirt2 ORF序列;右:pAd-sirt2质粒电泳图。M:Marker;1:pAd-sirt2同源重组质粒;2:PacⅠ酶切重组质粒。 图1 重组腺病毒pAd-sirt2的构建
2.2pAd-sirt2的滴度测定结果见图2。利用空斑法测定pAd-sirt2的滴度为1.8×1011pfu/L。
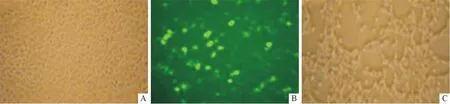
A:正常培养的HEK293细胞;B:转染48 h后荧光显微镜下观察;C:转染48 h后。图2 pAd-sirt2转染HEK293细胞(×100)
2.3pAd-sirt2感染hUC-MSCs结果见图3,说明pAd-sirt2腺病毒已经进入hUC-MSCs并在细胞中成功表达。

A:感染组可见光下观察结果(×100);B:感染组荧光显微镜下观察结果(×100);C:Western blot检测Sirt2蛋白的表达。图3 pAd-sirt2感染hUC-MSCs 48 h后检测结果
2.4pAd-sirt2对hUC-MSCs增殖的影响结果见图4。

图4 各组细胞生长曲线
2.5hUC-MSCs感染pAd-sirt2后细胞周期的变化结果见表1。由表1可知,pAd-sirt2感染hUC-MSCs后将细胞周期阻滞在S期。
2.6各组细胞β-半乳糖苷酶染色结果见图5、表2。

表1 各组细胞周期的变化 %
*:与P3组相比,P<0.05;#:与P15组相比,P<0.05。

A:P3组;B:P15组;C:感染组。图5 各组细胞β-半乳糖苷酶染色结果(×100)

表2 各组细胞β-半乳糖苷酶阳性细胞率比较 %
F=913.570,P<0.001;*:与P3组相比,P<0.05;#:与P15组相比,P<0.05。
3讨论
干细胞衰老学说认为体内外的干细胞随着传代次数或者年龄的增加,其增殖和分化能力降低,相关基因表达发生改变[8-9],呈现衰老特征。Sirt2 是哺乳动物沉默信息调节因子家族成员之一,参与调控细胞周期、衰老等过程。实验室前期研究[7]发现sirt2与hUC-MSCs的衰老有关。因此,该研究采用腺病毒载体系统构建pAd-sirt2重组腺病毒,研究sirt2高表达对hUC-MSCs衰老的影响。与普通质粒载体和逆转录病毒载体相比,腺病毒载体通过包装腺病毒以感染的方式实现转染,具有自带荧光标签方便检测、重组效率高、宿主范围广泛、转染效率高等特点[10]。pAd-sirt2感染P15 hUC-MSCs 48 h后即可观察到明显的荧光,且Sirt2蛋白表达明显升高,说明腺病毒感染hUC-MSCs的效率非常高。另外作者发现,pAd-sirt2能够将细胞周期阻滞在S期,延长细胞分裂期,促进增殖,衰老特异的β-半乳糖苷酶染色阳性细胞率明显降低。该结果与以往研究[11-12]发现的sirt2激活细胞周期检测点激酶进而延长寿命的结果具有一致性。
综上,该研究发现sirt2高表达可以抑制hUC-MSCs的衰老,为进一步探索细胞衰老的机制和寻求有效延缓干细胞衰老的方法及途径奠定了基础。
参考文献
[1]CHENG Q,ZHANG Z,ZHANG S,et al.Human umbilical cord mesenchymal stem cells protect against ischemic brain injury in mouse by regulating peripheral immunoinflammation[J].Brain Res,2015,1594:293
[2]CHENG T,YANG B,LI D,et al.Wharton′s jelly transplantation improves neurologic function in a rat model of traumatic brain injury[J].Cell Mol Neurobiol,2015,35(5):641
[3]张琳琳,毕春升,陈发明,等.间充质干细胞衰老的研究进展[J].牙体牙髓牙周病学杂志,2014,24(12):734
[4]HARTING K,KNÖLL B.SIRT2-mediated protein deacetylation:an emerging key regulator in brain physiology and pathology[J].Eur J Cell Biol,2010,89(2/3):262
[5]朱建国,周杨,段新平,等.与细胞衰老相关的sirtuin家族[J].生命的化学,2010,30(5):744
[6]DE OLIVEIRA RM,SARKANDER J,KAZANTSEV AG,et al.SIRT2 as a therapeutic target for age-related disorders[J].Front Pharmacol,2012,3:82
[7]姚宁,马珊珊,崔渊博,等.单细胞海藻提取物对人脐带间充质干细胞的抗衰老作用[J].郑州大学学报(医学版),2015,50(4):458
[8]BRAIDY N,POLJAK A,GRANT R,et al.Differential expression of sirtuins in the aging rat brain[J].Front Cell Neurosci,2015,9:167
[9]谢振华,吴耀炯.主要干性基因与衰老相关基因表达水平的相互拮抗关系[J].生物化学与生物物理进展,2014,41(7):627
[10]单志新,林秋雄,李晓红,等.腺病毒表达载体对骨髓间充质干细胞分化能力的影响[J].南方医科大学学报,2008,28(7):1132
[11]NORTH BJ,ROSENBERG MA,JEGANATHAN KB,et al.SIRT2 induces the checkpoint kinase BubR1 to increase lifespan[J].EMBO J,2014,33(13):1438
[12]郭亦琦,施冬云,王君晖,等.Sirt基因家族及其对细胞寿命的调节[J].生物物理学报,2006,22(1):7
*国家自然科学基金资助项目U1404313,81471306;河南省高校科技创新团队基金资助项目15IRTSTHN022;河南省科技创新人才计划基金
资助项目154200510008
Inhibition of sirt2 overexpression on aging of human umbilical cord mesenchymal stem cells
MAShanshan1),CUIYuanbo2),YAONing1),XINGQu1),HANKang1),SONGJishi1),ZHANGYanting1),GUANFangxia1,3)
1)StemCellLaboratory,CollegeofLifeSciences,ZhengzhouUniversity,Zhengzhou4500012)TranslationalMedicineCenter,theAffiliatedZhengzhouCentralHospital,ZhengzhouUniversity,Zhengzhou450007
3)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordssirt2;adenovirus;human umbilical cord mesenchymal stem cell;aging
中图分类号Q291
通信作者#,女,1969年2月生,博士,教授,研究方向:生物医学,E-mail:guanfangxia@126.com
doi:10.13705/j.issn.1671-6825.2016.01.003

