肿瘤疗效影像学评价标准进展*
经 慧, 宋晶园综述, 郑骏年,2△审校
(1.徐州医学院肿瘤防治研究所, 江苏 徐州 221002;2.徐州医学院附属医院肿瘤中心 江苏省协同创新中心, 江苏 徐州 221002)
肿瘤疗效影像学评价标准进展*
经 慧1, 宋晶园1综述, 郑骏年1,2△审校
(1.徐州医学院肿瘤防治研究所, 江苏 徐州 221002;2.徐州医学院附属医院肿瘤中心 江苏省协同创新中心, 江苏 徐州 221002)
在过去的30年里,出现了许多依赖于影像学的肿瘤疗效评价标准。随着治疗手段的多样化及影像学技术的发展,新的评价标准不断产生。本文将对WHO标准、RECIST标准以及肿瘤靶向治疗评价标准进行综述,并比较它们的区别及阐明各自优势。
肿瘤; 疗效评价; 影像学
恶性肿瘤患者接受治疗后,对病灶缓解程度的评价至关重要,在过去的30年里,为了得到客观的疗效评价,出现了许多依赖于影像学的评价标准。1978年世界卫生组织(World Health Organization, WHO)首次制定了双径测量肿瘤大小的疗效评价标准。2000年国际著名专家工作组推出了“实体瘤疗效评价标准”(Response Evaluation Criteria in Solid Tumors, RECIST),并于2009年修订为RECIST 1.1版。WHO和RECIST标准在细胞毒性化疗药物应用的时代迅速发展并广泛应用。然而仅用肿瘤大小评判疗效具有一定的局限性,尤其是对胃肠间质瘤、肝细胞癌等特殊肿瘤的疗效评价。近年来,WHO和RECIST标准也不断地被修订,通过把瘤体大小、形态学以及代谢特点结合起来评价疗效以弥补传统标准的不足。
1 WHO标准
1981年,WHO第一次颁布了评价肿瘤治疗疗效的标准[1]。WHO标准介绍了评估肿瘤负荷的方法即测量肿瘤直径之和(肿瘤最长的直径和垂直于该线的最长径之和,sum of the products of diameters, SPD),并提出在治疗过程中通过测量SPD值变化确定疗效。变化分为四组a.完全缓解;b.部分缓解;c.疾病进展;d.疾病稳定[2](表1)。
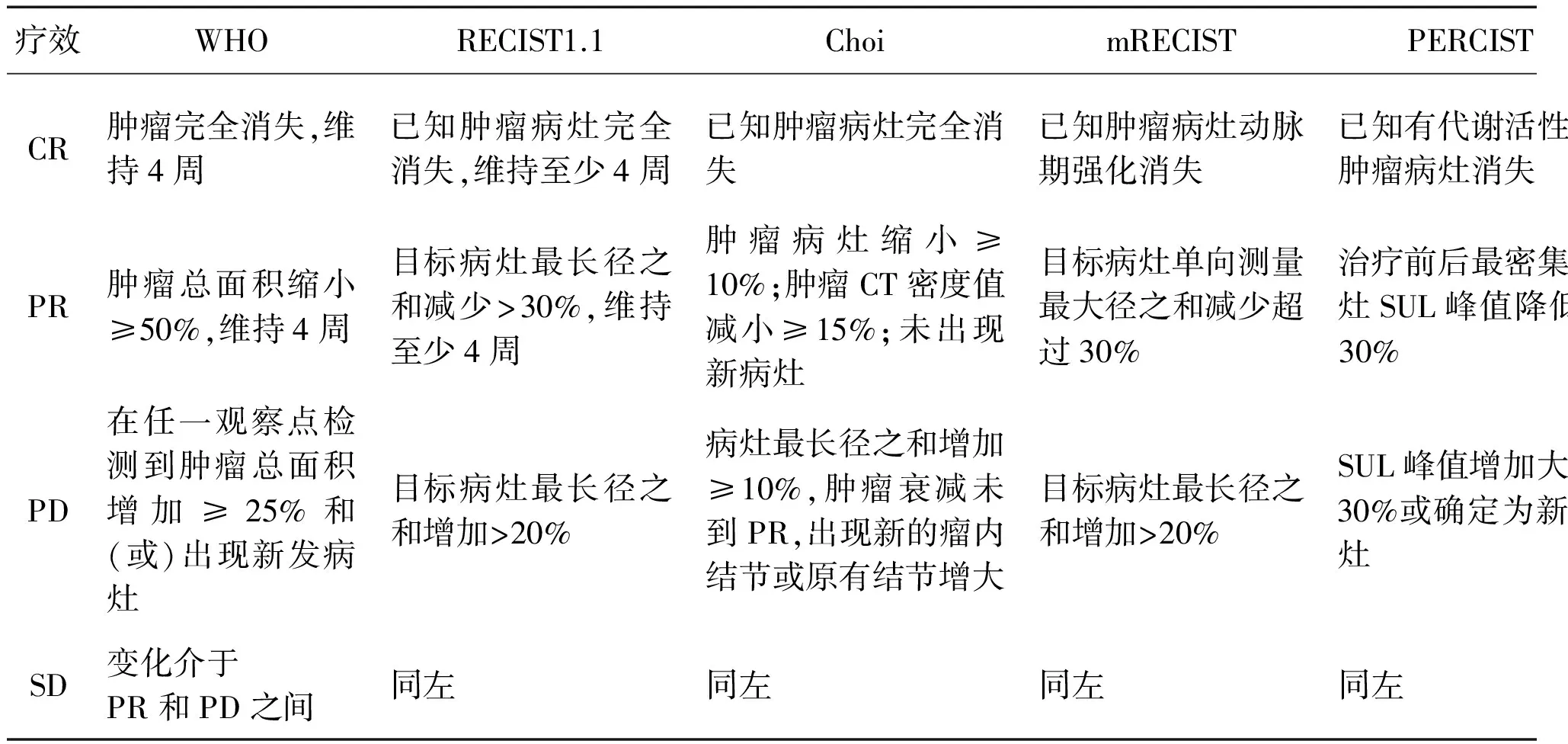
表1 WHO, RECIST1.1, Choi, mRECIST, PERCIST及IrRC评价标准比较[3]
(IrRC: Immune-related Response Criteria免疫相关反应标准; CR完全缓解;PR部分缓解;PD疾病进展;SD疾病稳定)
最初的WHO标准没有明确应测量的病灶数,最小需要测量的病灶大小以及病灶的分级。并且,肿瘤大小轻微的改变或是因为测量误差会让人们误以为肿瘤进展,例如病灶每一个测量尺寸增加12%就会导致肿瘤大小增加25%。
2 RECIST 1.0
2000年,美国国立癌症研究所(NCI)、加拿大国立癌症研究所(NCIC)和欧洲癌症研究与治疗协会(EORTC)提出新的RECIST标准。RECIST 1.0主要根据对569位患者回顾性测量获得数据制定。RECIST 1.0的特点主要包括定义最小测量病灶值,只使用一个测量尺寸即最长径,涉及螺旋CT成像技术。进展期疾病定义更改为出现新的病灶或者最长径之和增加20%以上,且出现可疑病灶即可诊断为疾病进展。文献报道,该标准使用CT容积测量在预测肿瘤患者总生存率方面具有优势[4]。
3 RECIST 1.1
考虑到RECIST1.0未阐明淋巴结的评估方法和新图像技术多层螺旋CT、MRI的应用,2009年RECIST合作组织重新修订了RECIST[5]。RECIST1.1是基于6 500例患者大数据分析得到的结果。表2比较了WHO、RECIST1.0、RESIST1.1的异同。RECIST1.1推荐使用CT或者MRI测量软组织组成来评估融骨或混合型骨骼病灶。所有病灶都应计算亚致死损伤作为基线。这个基线值可在以后的测量时间点用于肿瘤的客观评估。

表2 WHO、RECIST1.0、RESIST1.1标准的不同
(SLD: sum of the longest diameters最长径之和)
RECIST 1.1对评估疾病稳定、肿瘤进展、疾病进展时间有益。患者的最佳疗效评价将依赖于靶和非靶病灶的发现,也将考虑新病灶的出现。例如,患者在第一次评估为部分缓解,在接下来治疗后第二次评估为疾病稳定,如果在接下来的研究中出现新的病灶,就被认定为疾病部分缓解。RECIST 1.1对不可测量病灶也进行了说明,最大径小于可测量病灶规定的大小(即常规技术测量<20mm,螺旋CT<10mm)、骨病灶、膀胱胆囊病灶、脑脊膜病灶、胸、腹腔/心包/盆腔积液、炎性乳腺癌等都认为是不可测量病灶。近期有文献报道,对于进展期或已发生转移的使用靶向药物治疗的肺癌患者以及使用血管内皮生长因子靶向药的肾透明细胞癌患者,RECIST1.0与RECIST1.1评价结果具有高度的一致性[6-7]。
4 靶向治疗的肿瘤疗效评价
靶向治疗是使用特异性药物,通过影响肿瘤细胞相关特殊分子,导致细胞凋亡或阻断细胞增殖来抑制肿瘤生长转移。其机制与传统化疗药有明显不同。因此,传统解剖学大小为基础的标准不适宜用于靶向药物治疗效果的评价,二者评价标准应该是不同的[8]。
4.1 恶性淋巴瘤Cheson标准
淋巴瘤由于其疾病特殊的复杂性,肿瘤大小基础测量不能准确反映疾病状况,因此有其独自的评价标准[9]。1997年Cheson标准首次公开,2007年又重新修订[10]。修订版引入了PET-CT扫描检查并取消了完全缓解/不确定(CRu)的概念。PET利用18F脱氧葡萄糖(FDG: 2-[fluorine 18]fluoro-2-deoxy-D-glucose)进行功能显像,已成为淋巴瘤分期、治疗后再分期以及评价疗效的有效手段[11]。为了保证肿瘤测量的一致,修订版推荐使用6个最大淋巴结或结节状肿块的SPD,这些淋巴结必须要有清晰可测量的双径,尽可能来自身体不同部位,如果纵隔或腹膜后淋巴结阳性,评价过程中必须要包括这些淋巴结。在治疗中或治疗结束时出现任何径线超过1.5 cm的新病灶,即使其他病灶缩小都认为是疾病复发或进展(表3)。在淋巴瘤的疗效评价过程中要特别注意,通常在化疗3个周期以及全部化疗结束以后4周进行一次疗效评价,最迟不晚于治疗结束后两月。对于淋巴瘤的疗效评价检查除了影像学(CT、PET)结果还应包括临床检查以及骨髓活检[12]。

表3 Cheson标准疗效定义
4.2 Choi评价标准
2007年美国M.D.Anderson癌症中心提出Choi标准,该标准以肿瘤密度和大小变化作为疗效判断指标(详见表1)。在使用伊马替尼治疗胃肠道间质瘤(gastrointestinal stromal tumor,GIST)过程中肿瘤体积通常减小,但肿瘤大小变化不能很好说明疗效[13]。有时内出血、坏死、粘液样变等继发效应会导致肿瘤体积增大。在GIST患者中治疗有效最突出的变化是瘤块内肿瘤密度的明显降低,瘤内血管数减少,但RECIST不能反映肿瘤密度的变化。Choi评价标准认为对于GIST,肿瘤密度的变化可以作为评价伊马替尼治疗后的另一指标。PET对于发现早期改变更为敏感且对预测伊马替尼治疗GIST的疗效有益。且Choi标准更适宜评价接受索拉菲尼治疗的进展期肝癌[14]。Thian等[15]发现与RECIST标准相比,使用Choi标准评价使用舒尼替尼治疗后的转移性肾细胞癌患者的疗效与临床结果有高度的一致性。Choi等[13]报道通过螺旋增强CT、FDG-PET检查对伊马替尼治疗前和治疗2个月后的173个病灶进行评估。肿瘤密度由 CT检测的衰减系数来确定,采用Hu单位。发现伊马替尼治疗2周后CT检测中Hu的下降与PET的SUVmax (standardized uptake value,SUV)下降具有很好的一致性,提示前者可作为伊马替尼早期疗效的判断指标。然而采用RECIST标准,75%的患者仅达到SD,但实际上有70%的患者PET的SUVmax下降的水平达到99%。Choi等[16]还证实了CT可作为预后指标预测伊马替尼对转移性GIST生存期的影响。
4.3 修订版RECIST
RECIST是通过肿瘤大小变化评价细胞毒性药物的疗效,但在晚期肝癌患者治疗过程中因肿瘤血管减少和坏死的发生可能导致肿瘤体积增大,而肿物内部已无存活肿瘤,或很少存活肿瘤,因此该标准不能准确评价索拉非尼或介入的疗效[16-17]。2009年,美国肝脏病研究协会(AASLD)针对肝癌疗效评估做了修订,发表了改良的实体瘤疗效评价标准(mRECIST: modified RECIST)。mRECIST标准以“存活肿瘤”作为评估对象,能更客观真实地评估疗效。存活肿瘤定义是指在动态增强CT或MRI检查中动脉期造影剂的摄取。以此定义为基础,病灶动脉期强化消失代表完全有效(表1)。该标准着重提出,对原发性肝癌的评估要采用CT或 MRI动态增强,避开液化坏死区测量残存肿瘤,结合测量解剖径线的同时考虑肿瘤内部成分的改变。这一重大改进尤其是对肝癌TACE术后患者的疗效评价,更为简便客观。
4.4 PERCIST评价标准
FDG摄取主要和细胞代谢有关,好的肿瘤治疗反应可能没有病灶缩小,而是新陈代谢降低,所以代谢反应比形态学标准更适合用于预测肿瘤治疗疗效[10-11]。PERCIST (PET response criteria in solid tumors)在2009年被提出,于2011年第一次公开使用[18]。该标准依赖PET技术对RECIST中评价困难的不可测量病灶,特别是对骨病灶、放疗后改变及食管病变的评价提供了新标准。采用PERCIST进行疗效评价需选取SUVmax最大处,勾画1个直径为1.2 cm的球体(入选病灶直径均<1.2 cm),以瘦体质量进行校正得出1cm3球体内的SULpeak,保证该处SULpeak>1.5倍肝血池SULmean+2SD。根据前后两次PET/CT得出的SULpeak的变化值,将评价结果分为代谢完全缓解(CMR),代谢部分缓解(PMR),代谢稳定(SMD)和疾病代谢进展(PMD)(表1)。有文献报道在使用PERCIST标准时,与SUV、SUV based on LBMPE(LBMPE:lean body mass derived from a predictive equation预测方程预测的瘦体质量)相比,SUV based on LBMCT (LBMCT:CT-based lean body mass依据CT的瘦体质量) 可以更为精确地反映患者的肿瘤负荷情况[19]。
研究证明18F-FDG PET与肿瘤组织反应,其影像结果与接受靶向药物治疗的实体瘤患者生存期有着密切的关系[20-21]。Agrawal等[22]报道,43例肿瘤患者进行了节拍式化疗,用RECIST 1.1及PERCIST分别进行疗效评价,有32例(占74%)评价一致,11例(占26%)评价不同。节拍式化疗时肿瘤有休眠状态,因此用PERCIST评价疗效更合适。Costelloe等[23]对比了RECIST与PERCIST对骨转移的疗效评价,认为PERCIST体现了功能影像的作用,可通过骨转移活跃程度的变化评估疗效,更有优势。
5 免疫相关评价标准
WHO和RECIST指南认为使用细胞毒药物治疗时,肿瘤体积增大或出现新的占位都代表肿瘤进展,从而导致原治疗终止。Patel等[24]研究单克隆抗体ipilimumab治疗黑色素瘤时发现,肿瘤炎症导致疾病加重是ipilimumab治疗的正常反应,而且出现新病灶并不能说明ipilimumab治疗失败。临床经验证明在肿瘤负荷增加的同时,仍可出现完全缓解、部分缓解或稳定。因此,传统的评价标准并不适宜来评价免疫治疗效果[25]。国际免疫治疗协会专家于2009年在《Clinical Cancer Research》杂志上提出了新的免疫相关疗效标准,即IrRC[26]。IrRC采用SPD评价肿瘤大小,与WHO标准对每个病灶分别评价不同,IrRC以所有可测量指标病灶总的肿瘤负荷进行比较,肿瘤负荷定义为所有病灶SPD之和,包括新病灶的SPD(表1)。其中IrPD与IrCD、IrPR需要在两个连续的时间点进行验证。随着生物治疗在肿瘤治疗中的地位越来越高,正确地评价其疗效也显得越来越重要。
6 展 望
影像学评价是肿瘤疗效的传统评价方法之一。随着肿瘤治疗的多样性及影像学技术的发展,基于影像学的评价标准将会更加细化,更加客观地反映肿瘤疗效。然而,肿瘤治疗的多样性也要求我们在影像学评价的基础上,发展更多的评价标准,如相关组织代谢指标,机体免疫状态检测等。各类评价标准的发展将会更加全面地反映治疗效果,也将更有利于指导医师对患者的进一步治疗。
[1] World Health Organization. WHO handbook for reporting results of cancer treatment[M]. Geneva,Switzerland: World Health Organization,1979:1-3.
[2] Miller AB, Hoogstraten B, Staquet M,et al. Reporting results of cancer treatment[J]. Cancer, 1981,47(1):207-214.
[3] Tirkes T,Hollar MA,Tann M,et al. Response criteria in oncologic imaging: review of traditional and new criteria[J]. Radiographics, 2013, 33(5):1323-1341.
[4] Hayes SA,Pietanza MC, O’Driscoll D,et al. Comparison of CT volumetric measurement with RECIST response in patients with lung cancer[J]. EUR J Radiol,2016, 85(3):524-533.
[5] Eisenhauer EA, Therasse P, Bogaerts J,et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer,2009,45(2):228-247.
[6] Kim JH. Comparison of the RECIST 1.0 and RECIST 1.1 in patients treated with targeted agents: a pooled analysis and review[J]. Oncotarget, 2016,7(12):13680-13687.
[7] Krajewski KM, Nishino M, Ramaiya NH, et al. RECIST 1.1 compared with RECIST 1.0 in patients with advanced renal cell carcinoma receiving vascular endothelial growth factor-targeted therapy[J]. AJR Am J Roentgenol,2015,204(3):W282-288.
[8] Zhao B, Schwartz LH, Larson SM. Imaging surrogates of tumor response to therapy: anatomic and functional biomarkers[J]. Nucl Med, 2009,50(2): 239-249.
[9] Jochelson M, Mauch P, Balikian J, et al. The significance of the residual mediastinal mass in treated Hodgkin’s disease[J]. Clin Oncol, 1985, 3(5):637-640.
[10]Yanagawa M, Tatsumi M, Miyata H, et al. Evaluation of response to neoadjuvant chemotherapy for esophageal cancer: PET response criteria in solid tumors versus response evaluation criteria in solid tumors[J]. Nucl Med, 2012, 53(6):872-880.
[11]Cheson BD,Pfistner B,Juweid ME,et al. Revised response criteria for malignant lymphoma[J]. Clin Oncol, 2007, 25(5):579-586.
[12]Fourniera L, Ammari S, Thiam R, et al. Imaging criteria for assessing tumour response: RECIST, mRECIST, Cheson [J]. Diagn Interv Imaging, 2014, 95(7-8), 689-703.
[13]Choi H,Charnsangavej C,de Castro Faria S,et al. CT evaluation of the response of gastrointestinal stromal tumors after imatinib mesylate treatment: a quantitative analysis correlated with FDG PET findings[J]. AJR Am J Roentgenol, 2004,183(6):1619-1628.
[14]Gavanier M, Ayav A, Sellal C,et al. CT imaging findings in patients with advanced hepatocellular carcinoma treated with sorafenib: Alternative response criteria (Choi, European Association for the Study of the Liver, and modified Response Evaluation Criteria in Solid Tumor (mRECIST)) versus RECIST 1.1[J]. EUR J Radiol, 2016, 85(1),103-112.
[15]Thian Y, Gutzeit A, Koh DM, et al. Revised Cho imaging criteria correlate with clinical outcomes in patients with metastaticrenal cell carcinoma treated with sunitinib[J]. Radiology, 2014, 273(2), 452-461.
[16]Choi H. Response evaluation of gastrointestinal stromal tumors [J]. Oncologist, 2008, 13(2):4-7.
[17]Forner A, Ayuso C, Varela M, et al. Evaluation of tumor response after locoregional therapies in hepatocellular carcinoma: are response evaluation criteria in solid tumors reliable? [J]. Cancer, 2009,115(3):616-623.
[18]Engels B, Everaert H, Gevaert T, et al. Phase Ⅱ study of helical tomotherapy for oligometastatic colorectal cancer [J]. Ann Oncol, 2011, 22(2):362-368.
[19]Narita A, Shiomi S, Katayama Y, et al. Usefulness of standardized uptake value normalized by individual CT-based lean body mass in application of PET response criteria in solid tumors (PERCIST)[J]. Radiol Phys Technol, 2016,9(2):170-177.
[20]Kus T, Aktas G, Sevinc A, et al. Prognostic impact of initial maximum standardized uptake value of (18)F-FDG PET/ CT on treatment response in patients with metastatic lung adenocarcinoma treated with erlotinib[J]. Onco Targets Ther, 2015, 8(1):3749-3756.
[21]Schmitt RJ, Kreidler SM, Glueck DH, et al. Correlation between early 18F-FDG PET/CT response to BRAF and MEK inhibition and survival in patients with BRAF-mutant metastatic melanoma[J]. Nucl Med Commun,2016,37(2):122-128.
[22]Agrawal A, Purandare N, Shah S, et al. Response assessment in metronomic chemotherapy: RECIST or PERCIST?[J]. Indian J Nucl Med, 2014, 29(2):74-80.
[23]Costelloe CM, Chuang HH, Madewell JE, et al. Cancer Response Criteria and Bone Metastases: RECIST 1.1, MDA and PERCIST[J]. J Cancer, 2010,1(1):80-92.
[24]Patel SP, Woodman SE. Profile of ipilimumab and its role in the treatments of metastatic melanoma[J]. Drug Des Devel Ther, 2011,5(1):489-495.
[25]Wolchok JD,Hoos A,O’Day S,et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria[J]. Clin Cancer Res, 2009, 15(23): 7412-7420.
[26]Hoos A, Parmiani G, Hege K, et al. A clinical development paradigm for cancer vaccines and related biologics[J]. Immunother, 2007, 30(1):1-15.
2016- 03- 18
2016- 08- 02
*国家自然科学基金(81301806);江苏省博士后科研资助计划(1501060A);江苏省研究生创新课题(SJLX15_0727)
经 慧(1991-),女,江苏徐州人,在读研究生,主要研究方向:肿瘤生物治疗。
△郑骏年,教授,E-mail:jnzheng@xzmc.edu.cn
R730.49
A
10.3969/j.issn.1674- 0904.2016.04.008

