宝石CT能谱成像在乳腺浸润性导管癌腋窝转移淋巴结诊断中的初步应用
黄 丹, 刘启榆, 何川东, 周 莹, 林 华, 陈 娇, 管 彬, 王晋秋, 廖丽萍
(1.西南医科大学附属医院放射科, 四川 泸州 646000; 2.绵阳市中心医院放射科, 四川 绵阳 621000)
宝石CT能谱成像在乳腺浸润性导管癌腋窝转移淋巴结诊断中的初步应用
黄 丹1, 刘启榆1, 何川东2, 周 莹2, 林 华2, 陈 娇2, 管 彬2, 王晋秋2, 廖丽萍2
(1.西南医科大学附属医院放射科, 四川 泸州 646000; 2.绵阳市中心医院放射科, 四川 绵阳 621000)
目的:探讨宝石CT能谱成像(gemstone spectral imaging,GSI)在乳腺浸润性导管癌腋窝转移淋巴结诊断中的价值。方法: 收集绵阳市中心医院2013年2月~2014年12月期间经病理证实并行GSI检查的乳腺浸润性导管癌患者32例,所有患者均行腋窝淋巴结清扫术。GSI扫描时间为动脉后期(33s),图像后处理采用ADW4.6工作站及GSI-view软件。根据手术病理结果将纳入研究的淋巴结分为转移组(15枚)和非转移组(62枚)。由软件自动生成KeV-CT值(电子千伏值-CT值)曲线,同时记录每枚淋巴结的碘基值和相应层面主动脉碘基值、不同KeV下淋巴结CT值和相应层面主动脉的CT值。计算每枚淋巴结40~70KeV的斜率值(斜率K=(HU40KeV-HU70KeV)/30)、标化碘基值(淋巴结碘基值/主动脉碘基值)、不同KeV下的标化CT值(淋巴结CT值/主动脉CT值)。统计分析运用spss17.0。结果: 在40~70KeV区间内,转移组淋巴结与非转移组淋巴结的KeV-CT值曲线斜率差异具有统计学意义(P<0.05)。转移组的碘基值、标化碘基值均小于非转移组,差异有统计学意义(P<0.05)。不同KeV下标化CT值的差异均无统计学意义。以曲线斜率3.92作为诊断转移淋巴结的阈值时,灵敏度和特异度分别为77.4%、71.4%;以碘基值19.44作为诊断阈值时,灵敏度和特异度分别为73.3%、72.6%;以标化碘基值0.1677作为诊断阈值时,灵敏度和特异度分别为82.3%、80.0%。结论: CT能谱成像作为一种新的无创性检查方法,对诊断乳腺浸润性导管癌腋窝转移淋巴结有重要价值。
能谱CT成像;乳腺浸润性导管癌;转移/非转移淋巴结
乳腺癌是女性最常见的恶性肿瘤之一。乳腺癌的发病率逐年上升且发病年龄趋于年轻。根据2014年全国肿瘤登记中心报告数据显示,乳腺癌占所有女性恶性肿瘤的25.89%,每年新发病例约13万,为女性恶性肿瘤发病的首位[1]。腋窝淋巴结转移为乳腺癌常见的转移方式,评价腋窝淋巴结转移情况,对术前准确分期、选择正确治疗方案具有重要意义。宝石能谱CT成像(gemstone spectral imaging,GSI)是具有多参数定量分析的新成像模式,能提供更多、更全面的信息,提高诊断的准确性,对多种肿瘤的定位、定性诊断较常规CT成像有较明显的优势[2]。本研究旨在初步探讨GSI对乳腺浸润性导管癌腋窝转移淋巴结的诊断价值。
1 资料与方法
1.1 一般资料
2013年2月~2014年12月绵阳市中心医院行乳腺肿块穿刺活检术证实为乳腺浸润性导管癌并行GSI检查患者,在排除已行放疗、化疗的病例后,将32例患者纳入研究,所有患者均在检查后行乳腺癌改良根治术及腋窝淋巴结清扫术。患者均为女性,年龄35~68岁,中位年龄54岁,术前检查均知晓并签署知情同意书。选取腋窝淋巴结77枚进行分析。
为使GSI显示的腋窝淋巴结同手术切除的淋巴结能逐一对应,按解剖学标准,以胸小肌为界,将腋窝分为三个水平[3]:Ⅰ水平位于胸小肌外侧;Ⅱ水平位于胸小肌下方;Ⅲ水平位于胸小肌内侧。每个水平内选取的淋巴结按从大到小不超过3个,淋巴结短径≥4mm,密度均匀,排除液化、坏死、出血、钙化。术前将选取的腋窝淋巴结情况告知手术医生和病理科医生,确保淋巴结病理结果同GSI选择淋巴结的准确对应。
由两位从事乳腺影像工作的副主任医师负责淋巴结选取及能谱分析。一位医师根据上述标准选取纳入研究的淋巴结,另一位医师在不知情的情况下分析淋巴结的能谱特征。
1.2 仪器与扫描方法
采用GE Discovery CT750 HDCT扫描仪。扫描时取仰卧位,双手上举交叉放于头两侧,扫描范围从颈根部至乳房下缘。经肘静脉泵注非离子型对比剂碘海醇350(mgI/mL)80mL,注射流速约2.9mL/s,于注射后33秒开始扫描。扫描参数:管电压80KeV和140KeV瞬时(0.5ms)切换,管电流550mA,螺距1.375:1,转速0.8s/r,扫描视野 50cm,重建视野 50cm,层厚及层间距均为5mm,能谱数据重建层厚为1.25mm。
1.3 图像及数据分析
图像后处理采用ADW4.6工作站和GSI-view软件。每个淋巴结放置3~5个感兴趣区(region of interest,ROI),最终数据取平均值。由软件自动生成KeV-CT值曲线,记录每枚淋巴结的碘基值和相应层面主动脉碘基值、不同KeV下淋巴结CT值和相应层面主动脉的CT值。分别做出转移组同非转移组淋巴结的平均KeV-CT值曲线;计算转移淋巴结和非转移淋巴结的KeV-CT值曲线斜率(K=(HU40KeV-HU70KeV)/30);运用标化碘基值(淋巴结碘基值/主动脉碘基值)及不同KeV下的标化CT值(淋巴结CT值/主动脉CT值)来减少患者个体差异对结果的影响。
1.4 统计学分析
以转移组及非转移组各项有差异的数据作为分析对象,将所有可能的切点作为诊断阈值进行灵敏度和特异度计算后,以灵敏度为纵坐标、(1-特异度)为横坐标做出受试者操作特性曲线(receiver operating characteristic,ROC)。根据ROC曲线,选择曲线上靠近左侧上方并结合统计结果得到Younden指数(Younden=敏感性+特异性-1)最大的切点作为临界点,确定转移淋巴结的诊断阈值,并计算相应的敏感性、特异性、阳性预测值及阴性预测值。
2 结 果
患者显示的腋窝淋巴结多位于Ⅰ、Ⅱ水平,多数患者Ⅲ水平未见淋巴结显示,结合纳入条件,每位患者实际能纳入研究的淋巴结数目为1~4枚。共纳入淋巴结数目为77枚。77枚腋窝淋巴结按病理结果分为转移组(15枚)和非转移组(62枚)。对比观察平均KeV-CT值曲线,发现转移淋巴结同非转移淋巴结在40~70KeV之间斜率差异明显(图1);在40~70KeV间,转移组KeV-CT值曲线斜率平均值为3.72±0.60,呈缓慢下降型;非转移组曲线斜率的平均值为4.93±1.25,呈速降型;转移组曲线斜率小于非转移组(图2、3)。转移组淋巴结同非转移组淋巴结的碘基值平均值分别18.07±3.43和23.53±6.73;转移组与非转移组的标化碘基值分别为0.1429±0.0059、0.2112±0.0090;以上指标差异均有统计学意义(表1)。不同KeV下转移淋巴结、非转移淋巴结标化CT值(共11组数据)差异均无统计学意义(P>0.05)(表2)。

图1 两组淋巴结的平均KeV-CT值曲线
40~70KeV区间曲线斜率差异明显,两曲线在80KeV以上的区间内逐渐趋于水平。
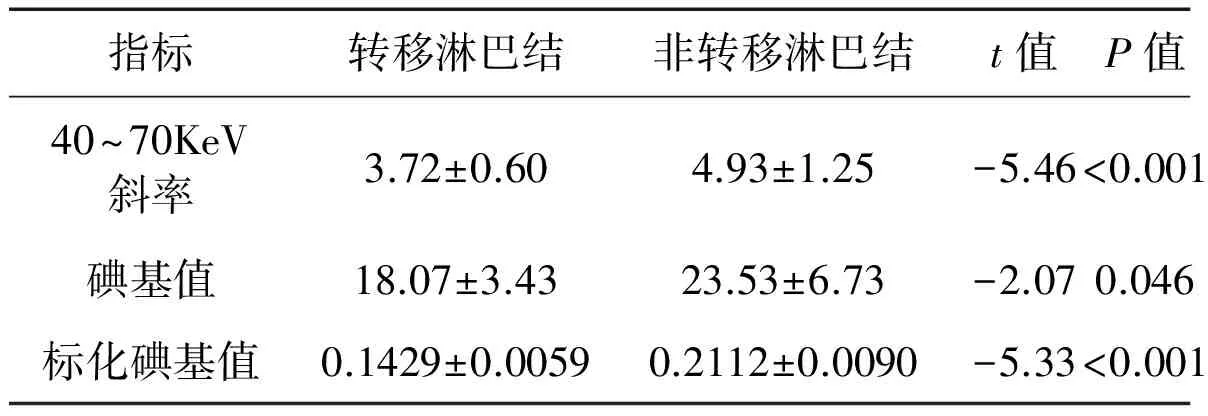
表1 转移组、非转移组淋巴结各指标t检验
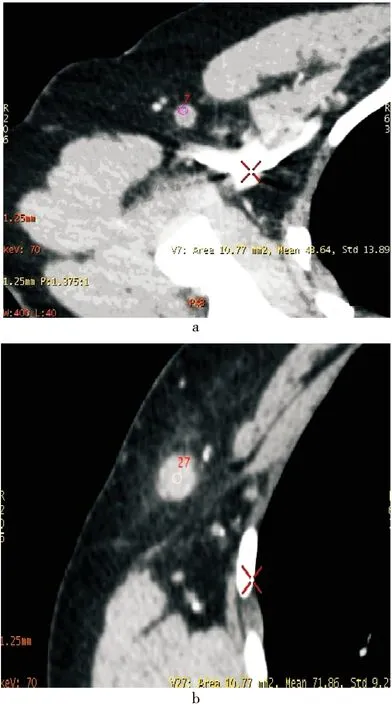
图2 GSI增强扫描图像
分别显示右侧腋窝非转移淋巴结(a)及转移淋巴结(b),从两者形态上看,难以确定两者的性质;在非转移淋巴结中取ROI(7),在转移淋巴结中取ROI(27)。
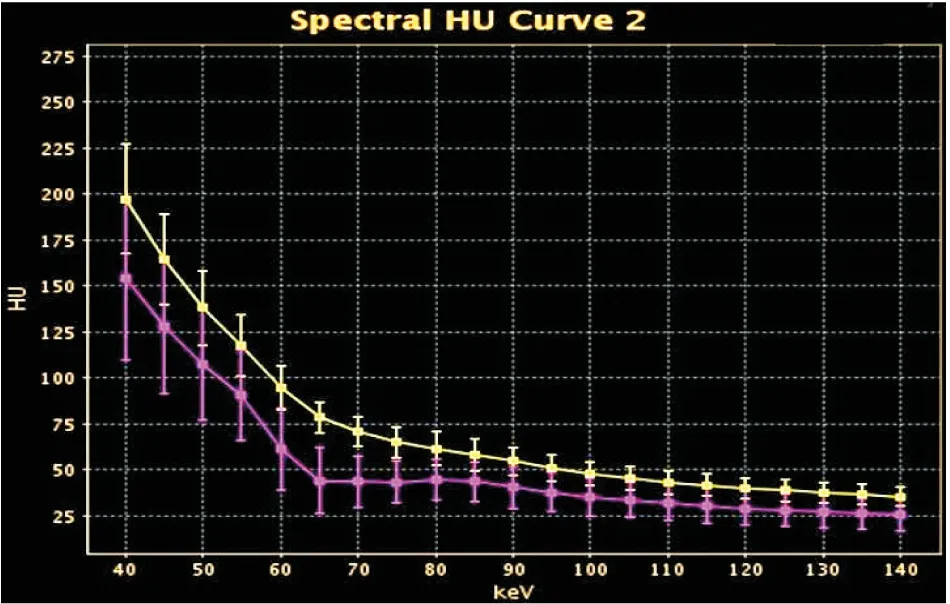
图3 KeV-CT值曲线
图2ROI中组织的KeV-CT值曲线,黄色为转移淋巴结,红色为非转移淋巴结;转移淋巴结CT值随KeV的升高逐步降低,非转移淋巴结CT值在65~80KeV间随能量升高稍有升高。两曲线均在80KeV以上的区间内逐渐趋于水平。
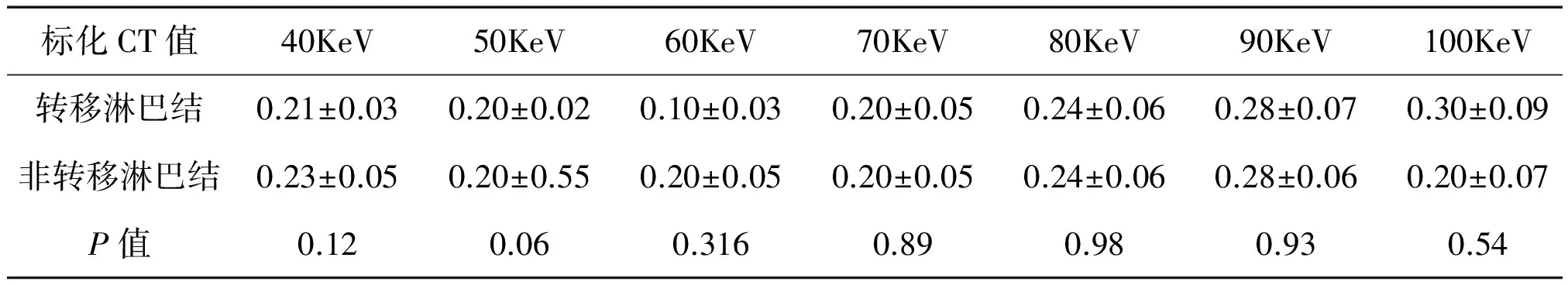
表2 不同KeV下转移组、非转移组淋巴结的标化CT值差异性检验
曲线斜率值的ROC曲线下面积(Area under curve,AUC)为0.805,碘基值AUC为0.784,标化碘基值AUC为0.873(图4)。分别将曲线斜率小于3.92、碘基值小于19.44、标化碘基值小于0.1676作为诊断转移淋巴结标准时得出相应敏感性、特异性、阳性预测值(PPV)及阴性预测值(NPV)(表3)。

图4 转移淋巴结与非转移淋巴结KeV-CT值曲线斜率、碘基值及标化碘基值ROC曲线
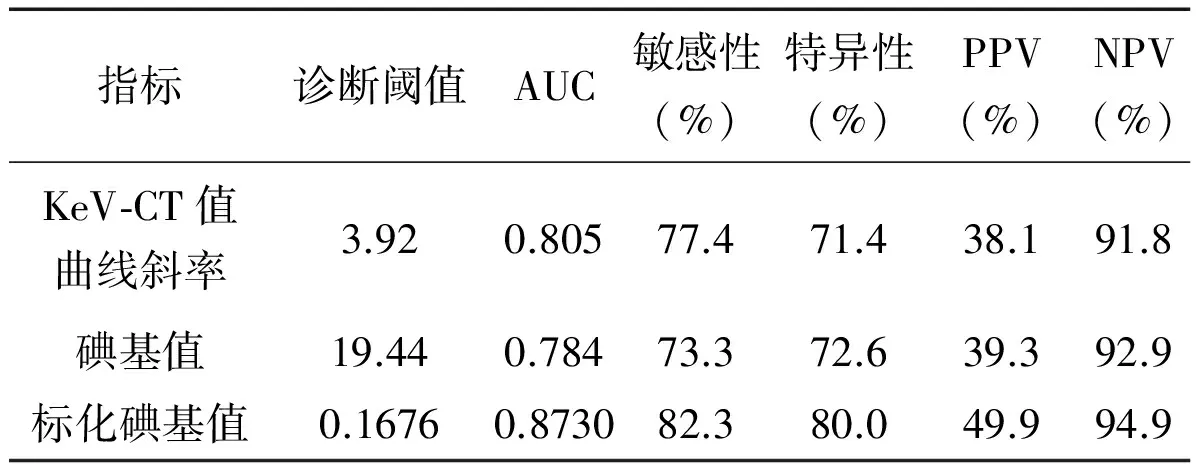
指标诊断阈值AUC敏感性(%)特异性(%)PPV(%)NPV(%)KeV⁃CT值曲线斜率3.920.80577.471.438.191.8碘基值19.440.78473.372.639.392.9标化碘基值0.16760.873082.380.049.994.9
3 讨 论
腋窝淋巴结转移为影响乳腺癌预后的重要因素,术前准确评价腋窝淋巴结转移情况对准确分期、指导全身治疗及判断患者预后有重要意义[4]。了解腋窝淋巴结转移情况最可靠的方法是腋窝淋巴结清扫术(axillary lymph node dissection,ALND)及术后病理结果,但ALND有淋巴水肿、感觉损伤、感染等并发症,目前多根据前哨淋巴结活检(sentinel lymph node dissection,SLND)结果来确定是否行ALND,SLND阳性为进行ALND的指征。但SLND阳性患者中只有53%患者有非前哨淋巴结转移[5],并不能完全反映腋窝淋巴结的性质,并且SLND为有创检查,检查难度大、需要多专业医生配合、检查医生需长时间严格培训,目前在国内应用还不广泛。
在术前准确地判断淋巴结性质是影像学研究的热点及难点。目前诊断腋窝转移淋巴结常用影像检查手段有超声、MRI、常规CT及PET/CT。超声主要通过淋巴结形态、结构及淋巴结血流情况来判断淋巴结性质,但对位置较深的淋巴结显示较差,诊断标准较为主观,诊断价值有限。MRI具有良好的软组织分辨率,可清晰、全面地显示腋窝淋巴结,运用多种序列、不同成像技术,对乳腺癌前哨淋巴结的检出具有较高的敏感性和特异性[6],能更准确地评价淋巴结性质。但MRI检查禁忌症多、检查费用高、费时,临床认识不足,限制了广泛应用。常规CT仅以淋巴结大小、形态、密度、强化程度作为依据判断性质[7],对转移淋巴结的诊断准确性同诊断医师经验水平相关,用来判断淋巴结性质的可靠性较差。PET/CT是形态与功能成像的结合,敏感性及特异性分别可达91.8%和98.9%[8],但由于其检查费用高昂,临床普及率不高,目前尚不能作为常规检查手段。
宝石能谱CT是具有多参数定量分析的新成像模式,可以从定性、定量等更深层次判断淋巴结性质。通过球管高低电压的瞬时切换技术,可生成40~140KeV的101个单能量图像,有利于消除常规CT产生的线束硬化伪影并避免平均衰减效应,从而提高图像对比噪声[9]。物质在不同的KeV值下都对应一个精确的CT值,相应CT值与其所对应的能量水平间的变化关系在二维坐标系内构成能谱曲线(即KeV-CT值曲线),它反映了物质的质量吸收系数随能量变化的关系[10]。本研究中,转移淋巴结同非转移淋巴结平均KeV-CT值曲线在40~70KeV间斜率较大并有明显差异,80KeV以上的区间内曲线斜率明显降低并逐渐趋于水平,这是由于能量较高时物质CT值随KeV值的变化不大[10],这也是本研究将40~70KeV间曲线的斜率来作为曲线的特征参数的原因。本研究所选取的腋窝淋巴结中,转移组KeV-CT值曲线斜率平均值为3.72±0.60,非转移组曲线斜率的平均值为4.93±1.25,差异有统计学意义(P<0.05),转移组淋巴结曲线斜率小于非转移组淋巴结,李明英等[11]对肺癌纵隔淋巴结转移的研究中,转移淋巴结曲线斜率小于非转移淋巴结,与本研究结果相似。黄玮等[12]对胃癌、食管癌、肺癌的转移淋巴结能谱特征进行比较,发现不同类型原发病灶的转移淋巴结能谱特征有差异,由此可建立不同原发灶转移淋巴结能谱特征数据库,从而判断肿大淋巴结的来源,为肿瘤诊断提供更多信息。碘基图能够反映增强后组织内碘浓度而间接反映组织血供情况,能更加准确地反映病变组织与正常组织的血供差异[13],本研究中用标化CT值及标化碘基值来减小个体间强化差异对淋巴结碘含量的影响,不同KeV下两组淋巴结标化CT值差异均无统计学意义,而转移组标化碘基值小于非转移组且差异有统计学意义,证实了碘基值能体现不同组织增强后含碘量的细微差别,较CT值可反映更多的诊断信息。转移淋巴结碘基值小于非转移淋巴结,与沈静娴[14]、饶艳莺[15]对肺癌纵隔转移淋巴结的研究中所得到的结果相同,间接反映了转移淋巴结血供低于非转移淋巴结,这可能与转移淋巴结结构破坏、血管畸形而使血供减少有关,其原因还有待于进一步研究。以标化碘基值0.1676作为诊断转移淋巴结的阈值时,敏感性及特异性分别为82.3%和80.0%,同沈静娴[14]等对肺癌转移淋巴结的研究中标化碘基值诊断能力相似。
本研究的不足之处在于病理类型单一;选取入组淋巴结时对淋巴结所在区域及大小、密度都有一定要求,具有一定的选择性偏倚;仅评价了宝石能谱CT定量指标的诊断意义,将在以后的研究中结合图像和定量参数进行评价;样本量较小,还需在今后的研究中扩大样本量,提高研究结论的可靠性。
综上所述,宝石能谱CT能较为准确地判断乳腺浸润性导管癌腋窝淋巴结的性质,对术前治疗方案的制定有一定意义。
[1] 陈万青,张思维,曾红梅, 等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[2] 林晓珠,李卫侠,朱延波,等. 宝石能谱CT在肿瘤诊断中的初步应用[J]. 诊断学理论与实践,2010,9(2):155-160.
[3] Berg JW.The significance of axillary node levels in the study of breast carcinoma[J].Cancer,1955,8(4):776-778.
[4] 姚宇锋,唐金海,秦建伟. 乳腺癌腋窝淋巴结清扫术后阴性淋巴结数目的临床意义[J]. 肿瘤预防与治疗,2012,25(1):9-11.
[5] Kim T,Giuliano AE,Lyman GH.Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma[J].Cancer,2005,106(1):4-16.
[6] 张延伟.淋巴结影像学在乳腺癌淋巴结转移中的应用[J].癌症进展,2011,9(2):151-153.
[7] 刘春英,何晓鹏,舒 健,等.MSCT在浸润性导管癌腋窝淋巴结转移术前N分期的诊断价值[J].实用放射学杂志,2014,30(1):65-68.
[8] Jeong HS,Back CH,Son YL,et al.Use of integrate18F-FDG PET/CT to improve the accuracy of initial cervical nodal evaluation in patients with head and neck squamous cell carcinoma[J].Head Neck,2007,29(3):203-210.
[9] 任庆国,滑炎卿,李剑颖.CT能谱成像的基本原理及临床应用[J].国际医学放射学杂志,2011,34(6):559-563.
[10]刘金刚, 刘 亚, 李丽新, 等. CT 能谱成像在诊断肿瘤淋巴结转移和肿瘤性质中的作用[J]. 中华放射学杂志, 2011, 45(8): 731-735.
[11]李明英,邓 凯,张成琪,等.能谱CT在原发性肺癌纵隔淋巴结转移中的诊断价值[J].实用放射学杂志,2013,29(6):906-909.
[12]黄 玮,田 添,孙国平.宝石能谱CT成像在鉴别不同病理类型肿瘤及其转移淋巴结中的作用[J].安徽医药,2013,17(11):1877-1880.
[13]王 乐,刘 斌,余永强,等.能谱成像测量单能量CT值与碘含量的相关性分析[J].实用放射学杂志,2012,28(5):784-787.
[14]沈静娴,谢传淼,习 勉,等. 能谱CT定量指标在鉴别诊断非小细胞肺癌转移淋巴结与非转移淋巴结中的价值[J].中山大学学报(医学科学版),2014,35(5):738-743.
[15]饶艳莺,杨文洁,刘 博,等.双能CT对肺癌淋巴结分期的可行性研究:碘浓度与纵隔淋巴结转移的相关性分析[J].放射学实践,2013,28(7):759-762.
Preliminary Study of Gemstone Spectral Imaging in the Diagnosis of Axillary Lymph Nodes Metastasis in Patients with Infiltrating Ductal Breast Carcinoma
(1.DepartmentofRadiology,AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,Sichuan,China;2.DepartmentofRadiology,MianyangCentralHospital,Mianyang621000,Sichuan,China)
Objective: To evaluate the clinical feasibility of gemstone spectral imaging(GSI) in the diagnosis of axillary lymph nodes metastasis in patients with infiltrating ductal breast carcinoma. Methods: Thirty-two cases of pathologically proven infiltrating ductal breast carcinoma from Feb. 2013 to Dec.2014 were included in this study. All cases underwent GSI scan in lateral artery phase (33s). Images were retrospectively analyzed using GSI viewer on ADW 4.6 work station. The axillary lymph nodes were classified as metastatic group (n=15) or non-metastatic group (n=62) according to the pathological diagnosis. The KeV-CT value curve was generated by the computer automatically, the iodine-based value and CT value of each lymph nodes and the corresponding strata of the artery were recorded. The slope of KeV-CT value curve [defined as: K= (HU40KeV-HU70KeV)/30], normalized iodine-based value (lymph node iodine-based value/arterial iodine-based value), normalized CT values (lymph node CT value/arterial CT value) under different KeVs were compared between the metastatic and non-metastatic lymph nodes. Spss17.0 software was used for analysis andP<0.05 was considered statistically different. Results: The slope of KeV-CT value curve of axillary metastatic lymph nodes was significantly different from that of non-metastatic lymph nodes (P<0.05) in 40~70KeV area. The Iodine-based value and the normalized Iodine-based value of metastatic lymph nodes were significantly lower than those of the non-metastatic group(P<0.05). No statistically significant difference was found of the normalized CT value between the metastatic and non-metastatic group. When the threshold of the slope of KeV-CT value curve was set at 3.92, the sensitivity and specificity were 77.4% and 71.4%, respectively. When the threshold of the Iodine-based value was set at 19.44, the sensitivity and specificity were 73.3% and 72.6%, respectively.While sensitivity and specificity for the normalized Iodine-based value were 82.3% and 80.0%,respectively when the threshold of the nomarlized Iodine-based value was set at 0.1677. Conclusion: GSI as a new non-invasive examination, is an important way for the detection of axillary lymph nodes metastasis in patients with infiltrating ductal breast carcinoma.
Gemstone Spectral Imaging; Infiltrating Ductal Breast Carcinoma; Metastatic/Non-metastatic Lymph Node
2015- 06- 16
2016- 07- 26
黄 丹(1989-),女,四川泸州人,在读硕士研究生,主要研究方向:肿瘤的影像诊断与介入治疗。
R736.8;R730.44
A
10.3969/j.issn.1674- 0904.2016.04.003
Huang Dan1, Liu Qiyu1, He Chuandong2, et al

