卷曲螺旋结构域蛋白74B对纤毛生成和细胞周期调控作用研究
李 萍,方 霞,曹雨娜,陆惠娜,梁爱斌,张 虹
·论著·
卷曲螺旋结构域蛋白74B对纤毛生成和细胞周期调控作用研究
李 萍,方 霞,曹雨娜,陆惠娜,梁爱斌,张 虹
【摘要】背景卷曲螺旋结构域蛋白(CCDC)参与基因转录、细胞凋亡及细胞周期过程,并调控恶性肿瘤细胞的侵袭和转移等多种生物学行为,然而多数CCDC的生物学功能目前尚未明确。目的探讨CCDC74B的细胞定位及对纤毛生成和细胞周期的影响。方法2013年3—9月通过构建在人视网膜色素上皮(RPE1)中的Tet-On表达系统,实现CCDC74B在细胞内的蛋白表达,然后通过细胞免疫荧光染色观察CCDC74B的细胞定位,通过小干扰RNA(siRNA)转染敲除CCDC74B在RPE1细胞中的表达,分为对照组、siRNA#1组、siRNA#2组,采用反转录聚合酶链式反应(RT-PCR)法检测CCDC74B mRNA 表达水平;采用细胞免疫荧光染色及流式细胞术观察下调CCDC74B表达后纤毛生成情况和对细胞周期分布的影响。结果在正常上皮细胞中,CCDC74B位于中心体,细胞免疫荧光染色示,下调CCDC74B表达后细胞初级纤毛生成。siRNA#1组及siRNA#2组转染后36 h及48 h纤毛生成率分别高于对照组(P<0.05)。RT-PCR法结果显示,siRNA#1组及siRNA#2组均有效抑制了CCDC74B mRNA表达。细胞免疫荧光染色示,下调CCDC74B表达后cyclin A表达减少,提示存在细胞周期停滞;流式细胞术检测示,下调CCDC74B表达后G1期细胞比例增高,S期及G2/M期细胞比例减少。结论中心体蛋白CCDC74B在细胞增殖过程中参与对纤毛生成和细胞周期的调控。
卷曲螺旋结构域蛋白(CCDC)是其序列中存在一个或数个卷曲螺旋结构域而被命名的一类蛋白[1]。CCDC结构折叠形式多变,可通过空间构象改变而实现许多不同的分子生物学功能,对细胞再生和存活、在细胞及分子的相互识别过程中起着确定性的作用。已有研究表明,部分CCDC参与基因转录、细胞凋亡及细胞周期过程,并调控恶性肿瘤细胞的侵袭和转移等多种生物学行为[2-3]。CCDC有百余种,然而多数蛋白生物学功能目前尚未知。本研究首先通过构建在人视网膜色素上皮(RPE1)细胞中的Tet-On表达系统,实现在细胞内的CCDC74B表达,使用细胞免疫荧光染色方法观察CCDC74B的细胞定位;然后通过小干扰RNA(siRNA)转染敲除CCDC74B表达后观察细胞纤毛生成及细胞周期变化情况,以初步探讨CCDC74B在细胞中的生物学功能。
1材料与方法
1.1试剂与抗体DMEM/F-12培养基、 胎牛血清、总RNA提取试剂盒、反转录聚合酶链式反应(RT-PCR)试剂盒及LipofectamineTMLTX转染试剂盒均为美国Invitrogen公司产品;抗cyclin A抗体、细胞周期碘化丙啶(PI)/RNase染色液为美国BD公司产品;抗Myc抗体(9E10)为瑞士Roche公司产品;抗乙酰化tubulin抗体(6-11B-1)、抗tubulin抗体为美国Sigma公司产品。
1.2细胞系及细胞培养2013年3—9月,RPE1细胞由本实验室传代培养。RPE1细胞培养于含有10%胎牛血清的DMEM/F-12培养基中,于37 ℃、5%CO2恒温培养箱中培养。
1.3利用Tet-On表达系统构建稳定表达CCDC74B的RPE1细胞株Tet-On表达系统的构建过程参照Inoko等[4]报道,进行相同操作。具体步骤如下:将CCDC74B DNA亚克隆至pENTR4-Myc载体,构建pENTR4-Myc-CCDC74B质粒,然后再通过LR重组反应将Myc-CCDC74B克隆至Tet应答的慢病毒载体pCSII-TRE-Tight-RfA(从Inakaki教授研究室获得)。重组后的pCSII-TRE-Tight-RfA-Myc-CCDC74A/B质粒通过慢病毒感染Tet-On RPE1细胞,并使用G418(250 μg/ml)和潮霉素B(50 μg/ml)双重筛选感染细胞。在细胞株建立后,使用适量多西环素(doxycycline,DOX)诱导CCDC74B在RPE1细胞内的蛋白表达后进行后续实验。
1.4细胞免疫荧光染色观察CCDC74B细胞定位、纤毛形成和cyclin A 表达情况将RPE1细胞预培养于底部放置载玻片的培养皿中,磷酸盐缓冲液(PBS)清洗3次后,使用100%甲醇或3.7%甲醛溶液固定细胞,后者固定的细胞需予以0.1% Triton X-100通透5 min。然后予以1%牛血清清蛋白(BSA)封闭1 h后,分别加入抗Myc抗体、抗乙酰化微管蛋白(ac-tubulin)抗体、抗tubulin抗体及抗cyclin A抗体孵育1 h或4 ℃过夜;孵育荧光二抗后,最后用DAPI进行细胞核染色,封固,在荧光显微镜下进行观察。
1.5siRNA合成及计算纤毛生成率从Qiagen公司购买敲除CCDC74B基因两种不同的siRNA序列#1(siRNA#1组)和#2(siRNA#2组)及control siRNA(对照组),具体序列如下:siRNA#1:CAGACAGCCTCTCCACGTCAA,siRNA#2:CACGTTACA
AGCTCATAATGA;Control siRNA:TTCTCCGAACGTGTC
ACGT。使用含有10%胎牛血清的DMEM/F-12培养液培养RPE1细胞24 h后,适量siRNA与LipofectamineTMLTX及PLUSTM试剂混合后转染细胞36 h和48 h,观察纤毛生成情况。观察100个细胞中纤毛生成个数,计算纤毛生成率。
1.6RT-PCR法检测CCDC74B mRNA 表达收集siRNA转染48 h后的RPE1细胞,使用Trizol一步法从细胞中抽提总RNA,取2 μg总RNA通过反转录反应合成互补DNA(cDNA)片段,反转录体系:(1)OligodT Primer 1 μl,dNTP Mixture 1 μl,RNase free 蒸馏水(dH2O)6.0 μl,RNA 2.0 μg;65 ℃ 5 min;(2)10×RT Buffer 2.0 μl,25 mmol/L氯化镁(MgCl2) 4 μl,0.1 mol/L二硫苏糖醇(DTT)2 μl,RNaseOut 1 μl,SuperScript Ⅲ RT 1.0 μl,RNase free dH2O 4.5 μl,50 ℃×50 min,85 ℃×5 min;(3)RNase H 1 μl 37 ℃ 20 min;PCR反应体系为:E×Taq Polymerase 0.25 μl上下游引物(CCDC74B或内参基因GADPH)各2 μl,10×Reaction Buffer 5.0 μl,模板1.0 μl,重蒸水(ddH2O)35.75 μl。PCR反应条件为:98 ℃预变性10 s;98 ℃ 10 s、55 ℃ 30 s、72 ℃ 15 s,30 个循环。产物进行琼脂糖凝胶电泳,拍照,观察。
1.7流式细胞术检测细胞周期变化收集siRNA转染48 h后的RPE1细胞,使用Cycle test Plus kit试剂盒,对DNA进行PI染色。待流式细胞仪检测后,使用CellQuest软件分析计算各细胞周期的细胞数目。
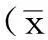
2结果
2.1细胞免疫荧光染色观察CCDC74B细胞定位在RPE1细胞中成功构建了表达带有Myc标记的人类基因CCDC74B(Myc-CCDC74B)的Tet-On表达系统。使用DOX(25 ng/ml)预处理24 h,在诱导Myc-CCDC74B在RPE1细胞中蛋白表达后,使用抗tubulin抗体与抗Myc抗体进行双重细胞免疫荧光染色观察到CCDC74B的绿色荧光与tubulin的红色荧光重合而变色,提示CCDC74B在细胞分裂间期位于中心体(见图1,本文图1~4彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.2下调RPE1细胞中的CCDC74B表达对细胞纤毛生成的影响细胞免疫荧光染色示,下调CCDC74B表达后细胞初级纤毛生成(见图2)。siRNA#1组及siRNA#2组转染后36 h及48 h纤毛生成率分别高于对照组,差异有统计学意义(P<0.01,见表1)。
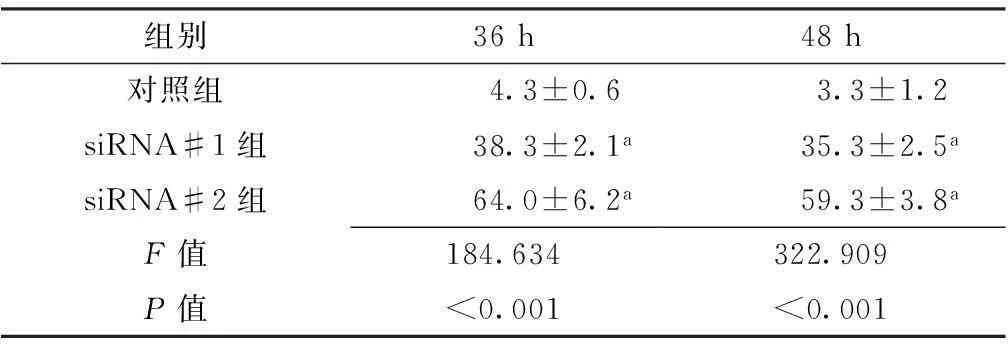
2.3RT-PCR法检测RPE1细胞内CCDC74B mRNA表达转染RPE1细胞48 h后采用RT-PCR法检测RPE1细胞内CCDC74B mRNA表达水平,siRNA#1组及siRNA#2组均有效抑制了CCDC74B mRNA表达(见图3)。
2.4下调CCDC74B表达对细胞周期的影响细胞免疫荧光染色示,下调CCDC74B表达后cyclin A表达减少(见图4),提示存在细胞周期停滞;流式细胞术检测示,下调CCDC74B表达后G1期细胞比例增高,S期及G2/M期细胞比例减少(见图5)。
3讨论
CCDC74B基因位于人类染色体2q21.1,蛋白质序列有一个CCDC结构域,目前尚未见关于该基因生物学功能的文献报道。由于局限于目前市场上尚无用于细胞免疫荧光染色的该蛋白抗体,本研究通过构建在RPE1细胞中的Tet-On表达系统,使用DOX诱导实现细胞内CCDC74B(Myc-CCDC74B)的稳定表达,然后通过抗Myc抗体的细胞免疫荧光染色法观察CCDC74B的细胞定位。本研究结果表明,CCDC74B位于中心体。由于中心体蛋白在初级纤毛生成、细胞分裂等细胞生物学行为发挥重要作用,因此本研究进一步探讨了CCDC74B对纤毛生成及细胞周期的影响,研究发现,在正常增殖的细胞中,抑制CCDC74B表达后诱导了初级纤毛的生成,提示CCDC74B可能为纤毛生成的负调控因子。

图1细胞免疫荧光染色观察Myc-CCDC74B Tet-On RPE1细胞中CCDC74B细胞定位
Figure 1CCCD74B intercellular localization was observed through immunofluorescence in Myc-CCDC74B Tet-On RPE1 cells

图2 siRNA下调CCDC74B表达后诱导RPE1细胞初级纤毛生成
Figure 2Knockdown of CCDC74B caused primary cilia formation in RPE1 cells

Table 1Comparison of the percentages of ciliated cells observed 36 and 48 hours after transfection among control group,siRNA#1 group and siRNA#2 group
组别36h48h对照组4.3±0.63.3±1.2siRNA#1组38.3±2.1a35.3±2.5asiRNA#2组64.0±6.2a59.3±3.8aF值184.634322.909P值<0.001<0.001
注:siRNA=小干扰RNA;与对照组比较,aP<0.01
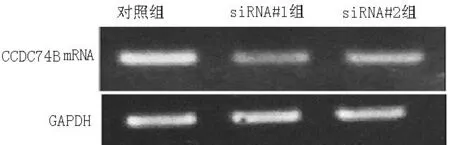
图3 CCDC74B mRNA表达电泳图
图4细胞免疫荧光染色检测CCDC74B表达下调后细胞cyclin A表达情况
Figure 4Expression of cyclin A after the decrease of CCDC74B expression observed by immunofluorescence staining

图5 流式细胞术检测CCDC74B表达下调后细胞周期分布情况
Figure 5Cell cycle distribution after the decrease of CCDC74B expression detected by FCM
初级纤毛几乎存在于所有的人类细胞类型中,是突出细胞表面的“毛发状”细胞器,由中心体一中心粒(即母中心粒)转化成基体而形成。初级纤毛和细胞周期有着密切的联系。当细胞退出细胞周期,进入G0期,纤毛则出现;而当静止细胞进入细胞周期,纤毛则被吸收,并在细胞增殖过程中不再出现,这种吸收利于释放中心体,使其形成纺锤体极,保证染色体在细胞分裂时的精确分离[5-6]。然而,在细胞增殖过程中纤毛形成受抑制的调控机制目前尚不明确。研究发现,Aurora A激酶在G0/G1期通过在基体部位和HEF1结合,特异性激活 HDAC6的微管蛋白去乙酰化活性,导致纤毛轴丝的解体[7]。Inoko等[4]研究发现,多毛蛋白Trichoplein与Aurora A激酶结合,在细胞增殖中抑制纤毛的生长。另一研究发现,CP110在Cep97和Kif24的作用下在细胞分裂间期位于母中心粒末端,抑制纤毛的生长,机制可能是通过和Cep290结合,抑制Rab8a在纤毛形成中的功能[8-9]。最新研究表明,S/G2期激酶Nek2可通过对 Kif24磷酸化改变其活性而抑制纤毛的生成[10]。CCDC74B则是本研究首次报道的在增殖细胞中抑制纤毛生成的另一个调控蛋白,但其具体作用机制尚需进一步研究。
近年研究发现,在一些增殖细胞中初级纤毛的异常出现或长度异常能阻滞细胞周期[4,7,11-12],提示纤毛本身也是调控细胞周期的“制动器”。 细胞无限制地增生是恶性肿瘤的重要特性之一,而且在许多类型恶性肿瘤细胞中不存在纤毛,因此在肿瘤细胞中诱导纤毛生长的治疗方法有望成为某些类型恶性肿瘤治疗的新途径。最近已有研究发现,在原代人类胆管癌细胞及乳腺癌细胞中诱导纤毛的生成能够显著抑制肿瘤细胞的生长[10,13]。 本研究发现,下调CCDC74B表达也导致了G1期停滞,与上述文献报道的表型一致,提示CCDC74B下调所致的细胞周期停滞可能与初级纤毛生成相关。
综上所述,在正常增殖细胞中,CCDC74B位于中心体,下调CCDC74B表达诱导了初级纤毛的生成,并致细胞周期停滞于G1期,提示中心体蛋白CCDC74B可能通过对纤毛生成的调控参与细胞增殖过程。本研究中笔者揭示了CCDC74B在纤毛生成和细胞周期调控方面的生物学功能,也为纤毛相关性疾病的机制和治疗提供了相关线索。
作者贡献:李萍进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;方霞、曹雨娜、陆惠娜进行实验实施、评估、资料收集;梁爱斌、张虹进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Burkhard P,Stetefeld J,Strelkov SV.Coiled coils:a highly versatile protein folding motif[J].Trends Cell Biol,2001,11(2):82-88.
[2]Zhong J,Zhao M,Luo Q,et al.CCDC134 is down-regulated in gastric cancer and its silencing promotes cell migration and invasion of GES-1 and AGS cells via the MAPK pathway[J].Mol Cell Biochem,2013,372(1/2):1-8.
[3]Liu Z,Mai C,Yang H,et al.Candidate tumour suppressor CCDC19 regulates miR-184 direct targeting of C-Myc thereby suppressing cell growth in non-small cell lung cancers[J].J Cell Mol Med,2014,18(8):1667-1679.
[4]Inoko A,Matsuyama M,Goto H,et al.Trichoplein and Aurora A block aberrant primary cilia assembly in proliferating cells[J].J Cell Biol,2012,197(3):391-405.
[5]Kubo T,Yanagisawa HA,Yagi T,et al.Tubulin polyglutamylation regulates axonemal motility by modulating activities of inner-arm dyneins[J].Curr Biol,2010,20(5):441-445.
[6]Huang K,Diener DR,Rosenbaum JL.The ubiquitin conjugation system is involved in the disassembly of cilia and flagella[J].J Cell Biol,2009,186(4):601-613.
[7]Pugacheva EN,Jablonski SA,Hartman TR,et al.HEF1-dependent Aurora A activation induces disassembly of the primary cilium[J].Cell,2007,129(7):1351-1363.
[8]Kobayashi T,Tsang WY,Li J,et al.Centriolar kinesin Kif24 interacts with CP110 to remodel microtubules and regulate ciliogenesis[J].Cell,2011,145(6):914-925.
[9]Tsang WY,Bossard C,Khanna H,et al.CP110 suppresses primary cilia formation through its interaction with CEP290,a protein deficient in human ciliary disease[J].Dev Cell,2008,15(2):187-197.
[10]Kim S,Lee K,Choi JH,et al.Nek2 activation of Kif24 ensures cilium disassembly during the cell cycle[J].Nat Commun,2015,6:8087.
[11]Kim S,Zaghloul NA,Bubenshchikova E,et al.Nde1-mediated inhibition of ciliogenesis affects cell cycle re-entry[J].Nat Cell Biol,2011,13(4):351-360.
[12]Li A,Saito M,Chuang JZ,et al.Ciliary transition zone activation of phosphorylated Tctex-1 controls ciliary resorption,S-phase entry and fate of neural progenitors[J].Nat Cell biol,2011,13(4):402-411.
[13]Gradilone SA,Radtke BN,Bogert PS,et al.HDAC6 inhibition restores ciliary expression and decreases tumor growth[J].Cancer Res,2013,73(7):2259-2270.
(本文编辑:陈素芳)
【关键词】卷曲螺旋结构域蛋白;纤毛;细胞周期;细胞增殖
李萍,方霞,曹雨娜,等.卷曲螺旋结构域蛋白74B对纤毛生成和细胞周期调控作用研究[J].中国全科医学,2016,19(3):292-295.[www.chinagp.net]
Li P,Fang X,Cao YN,et al.Regulatory effect of CCDC74B on cilia formation and cell cycle[J].Chinese General Practice,2016,19(3):292-295.
Regulatory Effect of CCDC74B on Cilia Formation and Cell CycleLIPing,FANGXia,CAOYu-na,etal.DepartmentofHematology,TongjiHospitalofTongjiUniversity,Shanghai200065,China
【Abstract】BackgroundCCDC protein is involved in various biological behaviors including gene transcription,apoptosis,cell cycle and regulating invasion and metastasis of cancer cells.However,most CCDC protein functions remain unknown.ObjectiveTo investigate the cellular localization and its influence on cilia formation and cell cycle.MethodsFrom March to September in 2013,Tet-On expression system of RPE1 was built,and protein expression of CCDC74B was realized.The localization of exogenous CCDC74B was observed by immunofluorescence.After siRNA transfection was performed to decrease endogenous CCDC74B protein expression in RPE1 cells,the cells were divided into control group,siRNA#1 group and siRNA#2 group.RT-PCR method was used to detect CCDC74B mRNA expression.Cilia formation and cell cycle distribution after the decrease of CCDC74B expression were further observed by immunofluorescent staining and flow cytometry.ResultsIn normal epithelial cells,CCDC74B was in centrosome,and immunofluorescent staining showed that the decrease of CCDC74B leaded to the elementary cilia formation.36 h and 48 h after transfection,siRNA#1 group and siRNA#2 group were higher than control group in the proportion of ciliated cells(P<0.05).RT-PCR method showed that siRNA#1 group and siRNA#2 group effectively inhibited the expression of CCDC74B mRNA.The immunofluorescent staining showed that after the decrease of CCDC74B expression,the expression of cyclin A decreased,which suggested that cell cycle arrest may exist.FCM suggested that the decrease of CCDC74B leaded to the increase of the proportion of G1cells and the decrease of the proportion of cells at S and G2/M phrases.ConclusionCentrosomal protein CCDC74B is involved in the regulation of cilia formation in the process of cell proliferation.
【Key words】Coiled-coil domain containing;Cilia;Cell cycle;Cell proliferation
(收稿日期:2015-08-10;修回日期:2015-12-15)
【中图分类号】R 349.53
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.03.010
通信作者:张虹,200065 上海市,同济大学附属同济医院血液科;E-mail:hongzh97@sina.com
基金项目:国家自然科学基金资助项目(31301118)
作者单位:200065 上海市,同济大学附属同济医院血液科

